- Di
- Blog
- Infertilità
- Trattamenti di fecondazione in vitro
- Nuovi progressi della fecondazione in vitro
- Terapia sostitutiva mitocondriale!
- Trattamento di fecondazione in vitro a Cipro
- IUI
- Mini fecondazione in vitro
- FIVET + ICSI
- FIV citoplasmatica
- Ciclo tandem di fecondazione in vitro
- Donazione di ovuli
- Donazione di embrioni
- Donazione di sperma
- Genere – Selezione del sesso
- Maternità gestazionale
- Surrogazione gay dello stesso sesso
- Recupero chirurgico dello sperma
- Diagnosi genetica preimpianto PGD
- Congelamento delle uova
- Selezione di genere utilizzando ovociti donati
- Prevenzione dell'anemia falciforme
- FAQ
- Viaggio
- Di
- Blog
- Infertilità
- Trattamenti di fecondazione in vitro
- Nuovi progressi della fecondazione in vitro
- Terapia sostitutiva mitocondriale!
- Trattamento di fecondazione in vitro a Cipro
- IUI
- Mini fecondazione in vitro
- FIVET + ICSI
- FIV citoplasmatica
- Ciclo tandem di fecondazione in vitro
- Donazione di ovuli
- Donazione di embrioni
- Donazione di sperma
- Genere – Selezione del sesso
- Maternità gestazionale
- Surrogazione gay dello stesso sesso
- Recupero chirurgico dello sperma
- Diagnosi genetica preimpianto PGD
- Congelamento delle uova
- Selezione di genere utilizzando ovociti donati
- Prevenzione dell'anemia falciforme
- FAQ
- Viaggio
Aborti spontanei
Aborti ripetuti (ricorrenti) e opzioni terapeutiche
La perdita di una gravidanza può essere un'esperienza molto traumatica per le coppie. Gli studi indicano che oltre un quinto delle donne che subiscono una perdita di gravidanza mostrano sintomi di ansia e depressione. Quando una singola perdita di gravidanza può avere effetti così traumatici, la perdita di gravidanza ricorrente (RPL) può avere effetti psicologici devastanti.
L'aborto spontaneo ricorrente, noto anche come perdita di gravidanza ricorrente, è generalmente definito come il verificarsi di due o più perdite di gravidanza consecutive prima delle 20 settimane di gestazione. Questo fenomeno colpisce circa 1-2% delle donne in età riproduttiva e comporta significative conseguenze fisiche ed emotive (Practice Committee of the American Society for Reproductive Medicine, 2012). A differenza degli aborti spontanei isolati, che sono spesso attribuiti ad anomalie cromosomiche casuali, gli aborti spontanei ricorrenti sono più probabilmente dovuti a patologie sottostanti. Una delle prime cose che devono essere affrontate è quando la paziente sta vivendo i suoi aborti spontanei. Gli aborti spontanei sperimentati in diversi periodi di gestazione possono indicare fattori diversi. Comprendere queste cause aiuta a guidare una gestione e un supporto efficaci per le coppie interessate.
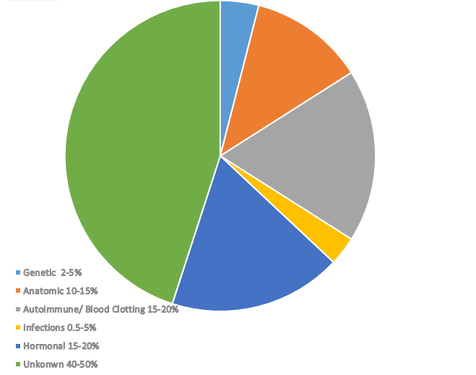
Sebbene vi siano diversi fattori accertati che possono essere collegati alle ripetute perdite di gravidanza, le cause di quasi la metà delle gravidanze ricorrenti rimangono ancora un mistero. Insieme, fattori autoimmuni, problemi ormonali e problemi di coagulazione del sangue costituiscono quasi il 70% di tutte le cause note. Pertanto, quando una donna subisce diversi aborti spontanei, il punto di partenza per i test solitamente coinvolgerebbe uno di questi tre domini.
Motivi dietro aborti consecutivi
È noto che le seguenti cause (senza un ordine specifico) sono coinvolte nelle ripetute perdite di gravidanza:
1Fattore genetico
Le cause genetiche costituiscono il 2-5 percento di tutti gli aborti spontanei. Tra le cause genetiche, le anomalie cromosomiche sono la principale causa genetica di aborto spontaneo, responsabili di circa il 50-60% delle perdite precoci di gravidanza che si verificano per motivi genetici. Queste anomalie includono difetti cromosomici sia numerici che strutturali.
A. Aneuploidia
L'aneuploidia, un numero anomalo di cromosomi, è una delle cause più comuni di aborto spontaneo. La trisomia (presenza di un cromosoma in più) è l'aneuploidia più frequente osservata, in particolare le trisomie dei cromosomi 16, 21 e 22. Anche la monosomia X (sindrome di Turner) è prevalente tra gli aborti spontanei, ma è raramente vitale oltre il primo trimestre (Hassold & Hunt, 2001). Le aneuploidie si verificano spesso a causa della non disgiunzione meiotica, un processo in cui i cromosomi non riescono a separarsi correttamente durante la divisione cellulare nei gameti, portando a embrioni con contenuto cromosomico anomalo (Nagaoka et al., 2012).
B. Anomalie cromosomiche strutturali
Anche le anomalie cromosomiche strutturali, tra cui traslocazioni, inversioni e delezioni, contribuiscono all'aborto ricorrente. Le traslocazioni si verificano quando i segmenti cromosomici vengono riorganizzati tra cromosomi non omologhi. Le traslocazioni bilanciate, che non comportano un guadagno o una perdita netta di materiale genetico, potrebbero non influenzare l'individuo ma possono portare ad aborti se i cromosomi riorganizzati interrompono lo sviluppo dell'embrione (Stephenson et al., 2002). L'analisi del cariotipo parentale può spesso rivelare anomalie strutturali nelle coppie con aborti ricorrenti.
C. Sindromi genetiche e mutazioni di singoli geni
Sebbene le anomalie cromosomiche siano significative, anche le mutazioni di singoli geni o le sindromi genetiche possono aumentare il rischio di aborto spontaneo.
Italiano: C1. Sindromi genetiche ereditarie
Le condizioni genetiche ereditarie, tra cui le sindromi autosomiche recessive o autosomiche dominanti, possono contribuire alla perdita della gravidanza. Ad esempio, le mutazioni nel gene FOXL2, associate alla sindrome Blefarofimosi-ptosi-epicanto inverso, possono portare a disfunzione ovarica, aumentando il rischio di aborto spontaneo (Crisponi et al., 2001).
Italiano: Mutazioni genetiche associate alla trombofilia
Mutazioni genetiche specifiche che causano trombofilia, o aumento della coagulazione del sangue, sono state collegate ad aborti spontanei. Mutazioni in geni come F5 (Fattore V Leiden) e F2 (protrombina) possono portare a una coagulazione anomala del sangue nella placenta, compromettendo il flusso sanguigno e causando infine aborto spontaneo (Rey et al., 2003). Sebbene la trombofilia sia una condizione multifattoriale, la predisposizione genetica è un fattore che contribuisce ad alcune perdite di gravidanza ricorrenti.
D. Fattori epigenetici ed età dei genitori
Anche i cambiamenti epigenetici, modifiche ereditarie nell'espressione genica che non comportano cambiamenti nella sequenza del DNA, contribuiscono al rischio di aborto spontaneo. Gli errori di metilazione del DNA, ad esempio, possono interrompere l'espressione genica nell'embrione, portando all'arresto dello sviluppo e all'aborto spontaneo.
Italiano: Età dei genitori
L'età avanzata della madre e del padre è associata a un rischio maggiore di anomalie genetiche, principalmente a causa di un accumulo di mutazioni nelle cellule germinali nel tempo. Le donne di età superiore ai 35 anni hanno un rischio maggiore di produrre ovociti con errori cromosomici, che portano ad aborti spontanei (Hassold & Chiu, 1985). Allo stesso modo, l'età avanzata del padre è stata collegata alla frammentazione del DNA nello sperma, che può aumentare il rischio di aborto spontaneo a causa dello sviluppo anomalo dell'embrione (Kumar et al., 2012).
Italiano: Disturbi dell'imprinting
I disturbi dell'imprinting, in cui alcuni geni sono espressi in modo specifico del genitore di origine, sono collegati al rischio di aborto spontaneo. Errori nell'imprinting possono portare a disturbi come la sindrome di Prader-Willi o la sindrome di Angelman, che possono causare aborti spontanei o esiti avversi della gravidanza (Chong & Hutchinson, 2000).
I progressi nelle tecnologie genomiche hanno notevolmente migliorato la comprensione delle cause genetiche dell'aborto spontaneo. Il sequenziamento ad alto rendimento, l'analisi di microarray cromosomici (CMA) e il test genetico preimpianto (PGT) consentono un'analisi cromosomica e genetica dettagliata di embrioni e genitori.
1. Analisi del microarray cromosomico (CMA)
La CMA ha sostituito il cariotipo in molte cliniche come test primario per identificare anomalie cromosomiche nel tessuto dell'aborto spontaneo. Questa tecnologia rileva squilibri cromosomici submicroscopici che il cariotipo tradizionale potrebbe non rilevare, fornendo informazioni sulle cause degli aborti spontanei inspiegati (Reddy et al., 2012).
2. Sequenziamento di nuova generazione (NGS)
L'NGS ha facilitato l'identificazione di mutazioni monogeniche e anomalie genetiche su piccola scala che contribuiscono all'aborto spontaneo. Ha anche aiutato a scoprire nuovi geni associati alla perdita precoce della gravidanza, fornendo ulteriori approfondimenti sulle cause genetiche (Xu et al., 2020). Quando le pazienti sperimentano perdite di gravidanza multiple, un ciclo di fecondazione in vitro che prevede test NGS diventa uno strumento molto efficace. Questo non viene fatto solo per gli aborti spontanei ricorrenti, ma è anche uno strumento efficace per i fallimenti ripetuti della fecondazione in vitro.
2. Anomalie anatomiche
Le anomalie strutturali all'interno del tratto riproduttivo possono compromettere l'impianto, interrompere il normale sviluppo fetale o portare a insufficienza placentare, tutte situazioni che possono contribuire a un evento indesiderato di aborto spontaneo. È stato stimato che le anomalie anatomiche contribuiscano fino al 15% di tutti gli aborti spontanei.
• Anomalie uterine congenite: Le malformazioni uterine, come l'utero setto, bicorne o unicorne, possono aumentare il rischio di aborto spontaneo. Un utero setto, in cui un setto fibroso divide la cavità uterina, è particolarmente associato a tassi elevati di aborto spontaneo. Il setto potrebbe non supportare un flusso sanguigno adeguato all'embrione impiantato, portando a insufficienza placentare e perdita di gravidanza (Grimbizis et al., 2001). È stato dimostrato che la correzione chirurgica del setto migliora i risultati della gravidanza.
• Anomalie uterine acquisite: Condizioni come i fibromi (in particolare i fibromi sottomucosi che deformano la cavità uterina) e le aderenze intrauterine (cicatrici all'interno dell'utero, spesso conseguenza di precedenti interventi chirurgici o infezioni) possono interferire con l'impianto o lo sviluppo fetale. Queste strutture possono deformare la forma della cavità uterina, ridurre lo spazio e limitare il flusso sanguigno all'embrione in via di sviluppo, aumentando così il rischio di aborto spontaneo (Saravelos et al., 2008).
3. Disturbi endocrini (problemi ormonali)
Le anomalie endocrine sono fattori ben documentati che contribuiscono alla perdita ricorrente di gravidanza, principalmente a causa del loro impatto sull'equilibrio ormonale e sulla ricettività uterina. È noto che i problemi ormonali svolgono un ruolo nel 15-20% degli aborti spontanei ricorrenti.
• Sindrome dell'ovaio policistico (PCOS): La PCOS è un comune disturbo endocrino caratterizzato da ovulazione irregolare, iperandrogenismo e resistenza all'insulina. Livelli elevati di insulina nelle donne con PCOS possono portare a uno scarso sviluppo dell'endometrio e possono contribuire alla perdita precoce della gravidanza (Boomsma et al., 2006). Inoltre, lo squilibrio ormonale associato alla PCOS può interrompere la fase luteale (il periodo dopo l'ovulazione in cui l'endometrio si prepara all'impianto dell'embrione), portando potenzialmente a un ambiente uterino inadeguato per l'impianto.
• Difetto della fase luteale: La fase luteale, regolata dal progesterone prodotto dal corpo luteo dopo l'ovulazione, è fondamentale per mantenere un ambiente endometriale ottimale per l'impianto e il supporto precoce dell'embrione. Una carenza nella produzione di progesterone, nota come difetto della fase luteale, può portare a una preparazione endometriale insufficiente, compromettendo l'impianto e aumentando il rischio di aborto spontaneo.
• Disturbi della tiroide: La funzione tiroidea svolge un ruolo significativo nel mantenimento della gravidanza. L'ipotiroidismo (tiroide ipoattiva) può portare a una produzione insufficiente di ormoni tiroidei, essenziali per lo sviluppo fetale, soprattutto nel primo trimestre, quando il feto dipende dagli ormoni tiroidei materni. Anche nelle donne eutiroidee (funzione tiroidea normale), la presenza di autoanticorpi tiroidei, in particolare anticorpi anti-perossidasi tiroidea (TPO), è associata a un rischio di aborto spontaneo 2-3 volte maggiore (Thangaratinam et al., 2011). Questi anticorpi possono influenzare il sistema immunitario materno, compromettendo l'ambiente uterino.
4. Fattori immunologici
Il sistema immunitario deve adattarsi per supportare la gravidanza, poiché il feto è geneticamente distinto dalla madre. Le interruzioni di questo adattamento possono portare all'aborto spontaneo.
• Sindrome da anticorpi antifosfolipidi (APS): L'APS è una condizione autoimmune caratterizzata dalla presenza di anticorpi antifosfolipidi, come l'anticoagulante lupico e gli anticorpi anticardiolipina. Questi anticorpi aumentano il rischio di formazione di coaguli nei vasi sanguigni, compresi quelli nella placenta. I coaguli placentari riducono l'apporto di ossigeno e nutrienti al feto, portando all'aborto spontaneo. L'APS è una causa ben documentata di aborto ricorrente e la sua gestione in genere prevede una terapia anticoagulante (Rai et al., 2005).
• Anomalie delle cellule Natural Killer (NK): Le cellule NK svolgono un ruolo nella gravidanza precoce, aiutando lo sviluppo della placenta. Si ipotizza che livelli elevati di cellule NK o una funzione anomala delle cellule NK contribuiscano all'aborto spontaneo ricorrente, poiché le cellule NK iperattive possono attaccare le cellule placentari. Tuttavia, il ruolo esatto delle cellule NK nell'aborto spontaneo è ancora dibattuto, con prove contrastanti sul fatto che la modulazione delle cellule NK migliori i risultati della gravidanza (Quenby et al., 2009).
5. Disturbi trombofilici
Le trombofilie ereditarie sono condizioni genetiche che predispongono gli individui a una coagulazione del sangue anomala, che può avere effetti negativi durante la gravidanza.
• Mutazione del fattore V di Leiden: Questa mutazione porta alla resistenza alla proteina C attivata, un anticoagulante cruciale, con conseguente stato di ipercoagulabilità. Durante la gravidanza, questa mutazione può portare a trombosi placentare (formazione di coaguli nella placenta), compromettendo l'apporto di ossigeno e nutrienti al feto, il che può causare aborto spontaneo, in particolare nel secondo trimestre (Preston et al., 2002).
• Mutazione del gene della protrombina: Questa mutazione promuove anche uno stato ipercoagulabile, aumentando il rischio di coaguli di sangue nella placenta. Le donne con questa mutazione hanno un rischio più elevato di aborto spontaneo, soprattutto nella fase avanzata della gravidanza.
• Carenze di proteine C e S: Le proteine C e S sono anticoagulanti naturali. Le carenze di queste proteine portano a una maggiore formazione di coaguli, che può compromettere la funzionalità della placenta. Tuttavia, il collegamento tra trombofilie e aborti precoci rimane controverso, con alcuni studi che suggeriscono che sono più rilevanti per le complicazioni della gravidanza tardiva (Lockwood, 2002).
6. Stile di vita e fattori ambientali
Diversi fattori modificabili legati allo stile di vita possono influire sull'esito della gravidanza.
• Fumo: La nicotina e altre tossine presenti nel fumo di sigaretta compromettono il flusso sanguigno uterino, creando un ambiente ipossico (con poco ossigeno) che può interrompere lo sviluppo dell'embrione e aumentare il rischio di aborto spontaneo. Il fumo è associato a un rischio più elevato di anomalie cromosomiche nell'embrione, probabilmente a causa dello stress ossidativo del tabacco (Green et al., 2007).
• Assunzione di alcol e caffeina: Un consumo eccessivo di alcol è associato a tossicità fetale, che può contribuire all'aborto spontaneo. Un'elevata assunzione di caffeina (tipicamente superiore a 200-300 mg al giorno) è stata collegata a un aumento del rischio di aborto spontaneo, potenzialmente dovuto ai suoi effetti sui sistemi cardiovascolare e ormonale che supportano la gravidanza (Ford & Schust, 2009).
• Obesità: L'obesità è associata a un rischio più elevato di aborto spontaneo dovuto a squilibri ormonali, aumentata resistenza all'insulina e infiammazione cronica di basso grado. L'obesità può anche compromettere la ricettività endometriale, che è fondamentale per l'impianto di successo e il mantenimento della gravidanza (Metwally et al., 2008).
7. Infezioni
Alcune infezioni possono aumentare il rischio di aborto spontaneo causando risposte infiammatorie che danneggiano i tessuti fetali o interrompono l'interfaccia materno-fetale. Mentre le cause infettive sono spesso suscettibili di indurre una perdita di gravidanza durante la fase attiva, alcune infezioni possono causare problemi cronici che possono essere un fattore per aborti spontanei ricorrenti:
• Chlamydia trachomatis e Ureaplasma urealyticum: Questi batteri possono causare endometrite cronica, un'infiammazione del rivestimento uterino, che può compromettere l'impianto o interrompere la funzione placentare, portando ad aborto spontaneo. L'infezione cronica con questi batteri è stata associata a esiti avversi della gravidanza, sebbene le prove che li collegano specificamente ad aborti spontanei ricorrenti siano contrastanti (Baud et al., 2008).
• Citomegalovirus (CMV): Il CMV è un herpesvirus che può essere trasmesso al feto se la madre è infetta durante la gravidanza. L'infezione fetale da CMV può portare ad anomalie dello sviluppo e aumentare il rischio di aborto spontaneo, in particolare quando l'infezione avviene all'inizio della gravidanza. È probabile che ciò rappresenti un problema nella fase attiva dell'infezione.
8. Cause inspiegabili
Circa la metà di tutti gli aborti ricorrenti rimangono inspiegati nonostante una valutazione approfondita. Gli aborti ricorrenti inspiegati possono comportare sottili anomalie nella funzione immunitaria, genetica o ormonale che gli attuali test diagnostici non sono in grado di rilevare. Inoltre, in molti casi sono probabili cause multifattoriali, in cui piccole anomalie in più sistemi contribuiscono collettivamente alla perdita della gravidanza (Coomarasamy et al., 2014). In alcuni casi, anche se non vi è una causa nota, possono essere adottate alcune misure profilattiche e osserviamo risultati positivi con queste misure, il che dimostra che anche se alcuni problemi potrebbero non presentarsi nei laboratori, potrebbero comunque rispondere ad anticoagulanti, corticosteroidi, antibiotici e altre misure profilattiche.
Riferimenti
• Baud, D., Regan, L., & Greub, G. (2008). Ruolo emergente della Chlamydia e degli organismi simili alla Chlamydia negli esiti avversi della gravidanza. Current Opinion in Infectious Diseases, 21(1), 70-76.
• Boomsma, CM, Fauser, BC, & Macklon, NS (2006). Complicanze della gravidanza nelle donne con sindrome dell'ovaio policistico. Seminari in Medicina Riproduttiva, 24(1), 35-43.
• Chong, S., & Hutchinson, W. (2000). Il ruolo dell'imprinting genomico nello sviluppo e nella malattia. The Lancet, 355(9197), 2117–2122.
• Coomarasamy, A., et al. (2014). Studio PROMISE: effetti del progesterone negli aborti spontanei ricorrenti. Health Technology Assessment, 18(40), 1-70.
• Crisponi, L., Deiana, M., Loi, A., et al. (2001). Il presunto fattore di trascrizione forkhead FOXL2 è mutato nella sindrome blefarofimosi/ptosi/epicanto inverso. Nature Genetics, 27(2), 159–166.
• Ford, HB, & Schust, DJ (2009). Perdita ricorrente di gravidanza: eziologia, diagnosi e terapia. Reviews in Obstetrics and Gynecology, 2(2), 76-83.
• Grimbizis, GF, et al. (2001). Malformazioni uterine e risultati del trattamento isteroscopico. Human Reproduction Update, 7(2), 161-174.
• Green, KA, et al. (2007). Fumo e aborto spontaneo: una revisione sistematica. Controllo del tabacco, 16(2), 120-124.
• Hassold, T., et al. (2007). L'origine dell'aneuploidia umana. Human Molecular Genetics, 16(R2), R203-R208.
• Kumar, N., Singh, AK, & Yadav, P. (2012). Infertilità maschile: una panoramica degli aspetti genetici. Journal of Postgraduate Medicine, 58(3), 243–249.
• Lockwood, CJ (2002). Meccanismi di sanguinamento endometriale. Menopausa, 9(6), 411-417.
• Metwally, M., et al. (2008). Impatto dell'obesità sulla funzione riproduttiva femminile. Obesity Reviews, 9(5), 456-468.
• Nagaoka, SI, Hassold, TJ, & Hunt, PA (2012). Aneuploidia umana: meccanismi e nuove intuizioni su un problema antico. Nature Reviews Genetics, 13(7), 493–504.
• Comitato di pratica dell'American Society for Reproductive Medicine. (2012). Definizioni di infertilità e perdita ricorrente di gravidanza. Fertilità e sterilità, 98(3), 1-2.
• Preston, FE, et al. (2002). Aumento della perdita fetale nelle donne con trombofilia. The Lancet, 356(9225), 270-273.
• Quenby, S., et al. (2009). Leucociti endometriali preimpianto in donne con aborto spontaneo ricorrente. Human Reproduction, 14(8), 2386-2391.
• Rai, R., et al. (2005). Anticorpi antifosfolipidi nell'aborto ricorrente. Riproduzione umana, 10(7), 1818-1823.
• Reddy, UM, Page, GP, & Saade, GR (2012). Il ruolo dei microarray del DNA nella valutazione della morte fetale. American Journal of Obstetrics and Gynecology, 207(4), 279–288.
• Rey, E., Kahn, SR, David, M., & Shrier, I. (2003). Disturbi trombofilici e perdita fetale: una meta-analisi. Lancet, 361(9361), 901–908.
• Saravelos, SH, et al. (2008). Modello di perdita di gravidanza nelle anomalie uterine. Reproductive BioMedicine Online, 17(1), 134-138.
• Stephenson, MD, Awartani, KA, & Robinson, WP (2002). Analisi citogenetica di aborti spontanei da coppie con aborto spontaneo ricorrente: uno studio caso-controllo. Human Reproduction, 17(2), 446–451.
• Thangaratinam, S., et al. (2011). Autoanticorpi tiroidei e rischio di aborto spontaneo. British Medical Journal, 342, d2616.
• Xu, Y., Li, L., Zhang, H., et al. (2020). Applicazione clinica del sequenziamento dell'intero esoma nella perdita di gravidanza ricorrente. Journal of Clinical Medicine, 9(4), 1156.
Centro FIVET di Cipro del Nord
North Cyprus IVF Center è una clinica per la fertilità incentrata sul paziente, situata all'interno di "Elite Research and Surgical Hospital” a Nicosia, Cipro. La nostra clinica è una delle cliniche per la fertilità più avanzate al mondo e offre una più ampia scelta di opzioni di trattamento a prezzi convenienti.
Contattaci
Telefono
Inglese: +90 548 875 8000
Francese: +90 548 876 8000
Turco: +90 542 869 8000
Arabo: +90 548 875 8000
Tedesco: +90 548 830 1987
Russo: +90 548 828 9955
info@northcyprusivf.net
© 2020 LowCostIVF - Tutti i diritti riservati. politica sulla riservatezza