- Über Uns
- Blog
- Unfruchtbarkeit
- IVF-Behandlungen
- Neue IVF-Fortschritte
- Mitochondriale Ersatztherapie!
- IVF-Behandlung in Zypern
- IUI
- Mini-IVF
- IVF + ICSI
- Zytoplasmatische IVF
- Tandem-IVF-Zyklus
- Eizellspende
- Embryonenspende
- Samenspende
- Geschlecht – Geschlechtsauswahl
- Schwangerschafts-Leihmutterschaft
- Gleichgeschlechtliche Leihmutterschaft für Schwule
- Chirurgische Spermienentnahme
- Genetische Diagnostik vor der Implantation, PID
- Einfrieren von Eiern
- Geschlechtsauswahl mithilfe von Spendereizellen
- Prävention von Sichelzellanämie
- FAQ
- Reisen
- Über Uns
- Blog
- Unfruchtbarkeit
- IVF-Behandlungen
- Neue IVF-Fortschritte
- Mitochondriale Ersatztherapie!
- IVF-Behandlung in Zypern
- IUI
- Mini-IVF
- IVF + ICSI
- Zytoplasmatische IVF
- Tandem-IVF-Zyklus
- Eizellspende
- Embryonenspende
- Samenspende
- Geschlecht – Geschlechtsauswahl
- Schwangerschafts-Leihmutterschaft
- Gleichgeschlechtliche Leihmutterschaft für Schwule
- Chirurgische Spermienentnahme
- Genetische Diagnostik vor der Implantation, PID
- Einfrieren von Eiern
- Geschlechtsauswahl mithilfe von Spendereizellen
- Prävention von Sichelzellanämie
- FAQ
- Reisen
Fehlgeburten
Wiederholte (wiederkehrende) Fehlgeburten und Behandlungsmöglichkeiten
Der Verlust einer Schwangerschaft kann für Paare eine sehr traumatische Erfahrung sein. Studien zufolge zeigen über ein Fünftel der Frauen, die eine Fehlgeburt erleiden, Symptome von Angst und Depression. Während ein einzelner Schwangerschaftsverlust derart traumatische Auswirkungen haben kann, können wiederholte Fehlgeburten (RPL) verheerende psychologische Auswirkungen haben.
Wiederholte Fehlgeburten, auch bekannt als wiederholte Fehlgeburten, werden im Allgemeinen als das Auftreten von zwei oder mehr aufeinanderfolgenden Fehlgeburten vor der 20. Schwangerschaftswoche definiert. Dieses Phänomen betrifft etwa 1-21 der gebärfähigen Frauen und hat erhebliche körperliche und emotionale Folgen (Practice Committee of the American Society for Reproductive Medicine, 2012). Im Gegensatz zu isolierten Fehlgeburten, die oft auf zufällige Chromosomenanomalien zurückgeführt werden, sind wiederholte Fehlgeburten eher auf zugrunde liegende Pathologien zurückzuführen. Eines der ersten Dinge, die angegangen werden müssen, ist, wann die Patientin Fehlgeburten erlebt. Fehlgeburten in verschiedenen Schwangerschaftsperioden können auf unterschiedliche Faktoren hinweisen. Das Verständnis dieser Ursachen hilft dabei, betroffene Paare effektiv zu behandeln und zu unterstützen.
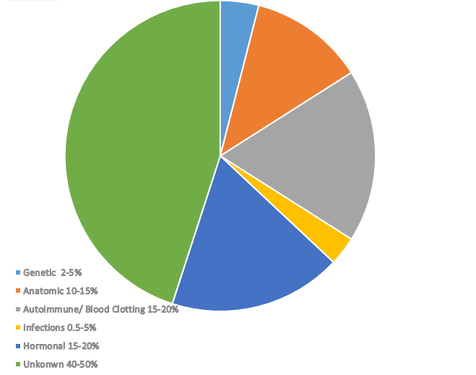
Obwohl es eine Reihe von Faktoren gibt, die mit wiederholten Fehlgeburten in Verbindung gebracht werden können, sind die Ursachen für fast die Hälfte der wiederholten Schwangerschaften immer noch ein Rätsel. Zusammen machen Autoimmunfaktoren, hormonelle Probleme und Probleme mit der Blutgerinnung fast 70% aller bekannten Ursachen aus. Wenn eine Frau also mehrere Fehlgeburten erleidet, liegt der Ausgangspunkt für die Tests normalerweise in einem dieser drei Bereiche.
Gründe für aufeinanderfolgende Fehlgeburten
Die folgenden Ursachen (in keiner bestimmten Reihenfolge) sind für wiederholte Schwangerschaftsverluste bekannt:
1Genetischer Faktor
Genetische Ursachen sind für 2-5 Prozent aller Fehlgeburten verantwortlich. Unter den genetischen Ursachen sind Chromosomenanomalien die häufigste genetische Ursache für Fehlgeburten. Sie sind für etwa 50-60% der frühen Schwangerschaftsverluste verantwortlich, die aus genetischen Gründen auftreten. Diese Anomalien umfassen sowohl numerische als auch strukturelle Chromosomendefekte.
A. Aneuploidie
Aneuploidie, eine abnormale Anzahl von Chromosomen, ist eine der häufigsten Ursachen für Fehlgeburten. Trisomie (das Vorhandensein eines zusätzlichen Chromosoms) ist die am häufigsten beobachtete Aneuploidie, insbesondere Trisomien der Chromosomen 16, 21 und 22. Monosomie X (Turner-Syndrom) kommt bei Fehlgeburten ebenfalls häufig vor, ist aber selten über das erste Trimester hinaus lebensfähig (Hassold & Hunt, 2001). Aneuploidien treten häufig aufgrund meiotischer Nondisjunction auf, einem Prozess, bei dem sich Chromosomen während der Zellteilung in Gameten nicht richtig trennen, was zu Embryonen mit abnormalem Chromosomengehalt führt (Nagaoka et al., 2012).
B. Strukturelle Chromosomenanomalien
Strukturelle Chromosomenanomalien, einschließlich Translokationen, Inversionen und Deletionen, tragen ebenfalls zu wiederholten Fehlgeburten bei. Translokationen treten auf, wenn Chromosomensegmente zwischen nicht homologen Chromosomen neu angeordnet werden. Ausgeglichene Translokationen, die nicht zu einem Nettogewinn oder -verlust von genetischem Material führen, beeinträchtigen das Individuum möglicherweise nicht, können aber zu Fehlgeburten führen, wenn die neu angeordneten Chromosomen die Embryonalentwicklung stören (Stephenson et al., 2002). Eine elterliche Karyotypanalyse kann bei Paaren mit wiederholten Fehlgeburten häufig strukturelle Anomalien aufdecken.
C. Genetische Syndrome und Einzelgenmutationen
Obwohl Chromosomenanomalien bedeutsam sind, können auch Mutationen einzelner Gene oder genetische Syndrome das Fehlgeburtsrisiko erhöhen.
C1. Vererbte genetische Syndrome
Vererbte genetische Erkrankungen, darunter autosomal-rezessive oder autosomal-dominante Syndrome, können zu Fehlgeburten beitragen. So können beispielsweise Mutationen im FOXL2-Gen, die mit dem Blepharophimosis-Ptosis-Epicanthus-inversus-Syndrom in Zusammenhang stehen, zu Funktionsstörungen der Eierstöcke führen und so das Risiko einer Fehlgeburt erhöhen (Crisponi et al., 2001).
C2. Thrombophilie-assoziierte Genmutationen
Bestimmte Genmutationen, die Thrombophilie oder eine erhöhte Blutgerinnung verursachen, stehen in Zusammenhang mit Fehlgeburten. Mutationen in Genen wie F5 (Faktor V Leiden) und F2 (Prothrombin) können zu einer abnormalen Blutgerinnung in der Plazenta führen, was den Blutfluss beeinträchtigt und letztendlich zu Fehlgeburten führt (Rey et al., 2003). Obwohl Thrombophilie eine multifaktorielle Erkrankung ist, ist eine genetische Veranlagung ein Faktor, der zu einigen wiederholten Schwangerschaftsverlusten beiträgt.
D. Epigenetische Faktoren und Alter der Eltern
Epigenetische Veränderungen, also vererbbare Modifikationen der Genexpression, die keine Änderungen der DNA-Sequenz mit sich bringen, erhöhen ebenfalls das Fehlgeburtsrisiko. DNA-Methylierungsfehler können beispielsweise die Genexpression des Embryos stören und so zu Entwicklungsstörungen und Fehlgeburten führen.
T1. Alter der Eltern
Höheres mütterliches und väterliches Alter ist mit einem erhöhten Risiko genetischer Anomalien verbunden, was hauptsächlich auf eine Anhäufung von Mutationen in Keimzellen im Laufe der Zeit zurückzuführen ist. Frauen über 35 haben ein höheres Risiko, Eizellen mit Chromosomenfehlern zu produzieren, was zu Fehlgeburten führen kann (Hassold & Chiu, 1985). Ebenso wurde höheres väterliches Alter mit DNA-Fragmentierung in Spermien in Verbindung gebracht, was das Fehlgeburtsrisiko aufgrund abnormaler Embryonalentwicklung erhöhen kann (Kumar et al., 2012).
T2. Prägungsstörungen
Prägungsstörungen, bei denen bestimmte Gene auf eine elternspezifische Weise exprimiert werden, stehen mit dem Risiko einer Fehlgeburt in Zusammenhang. Fehler bei der Prägung können zu Störungen wie dem Prader-Willi-Syndrom oder dem Angelman-Syndrom führen, die wiederum Fehlgeburten oder ungünstige Schwangerschaftsergebnisse zur Folge haben können (Chong & Hutchinson, 2000).
Fortschritte in der Genomik haben das Verständnis der genetischen Ursachen von Fehlgeburten erheblich verbessert. Hochdurchsatzsequenzierung, Chromosomenmikroarrayanalyse (CMA) und Präimplantationsdiagnostik (PGT) ermöglichen eine detaillierte Chromosomen- und Genanalyse von Embryonen und Eltern.
1. Chromosomale Microarray-Analyse (CMA)
Die Karyotypisierung hat in vielen Kliniken die Karyotypisierung als primäre Untersuchung zur Erkennung von Chromosomenanomalien in Fehlgeburtsgewebe abgelöst. Diese Technologie erkennt submikroskopische Chromosomenungleichgewichte, die bei der herkömmlichen Karyotypisierung übersehen werden können, und bietet so Einblicke in die Ursachen unerklärlicher Fehlgeburten (Reddy et al., 2012).
2. Sequenzierung der nächsten Generation (NGS)
NGS hat die Identifizierung von Einzelgenmutationen und kleinen genetischen Anomalien erleichtert, die zu Fehlgeburten beitragen. Es hat auch zur Entdeckung neuer Gene beigetragen, die mit frühen Fehlgeburten in Zusammenhang stehen, und so weitere Einblicke in die genetischen Ursachen gegeben (Xu et al., 2020). Wenn Patientinnen mehrere Fehlgeburten erleiden, ist ein IVF-Zyklus mit NGS-Tests ein sehr wirksames Mittel. Dies wird nicht nur bei wiederholten Fehlgeburten durchgeführt, sondern ist auch ein wirksames Mittel bei wiederholten IVF-Misserfolgen.
2. Anatomische Anomalien
Strukturelle Anomalien im Genitaltrakt können die Einnistung beeinträchtigen, die normale Entwicklung des Fötus stören oder zu einer Plazentainsuffizienz führen, was alles zu einer unerwünschten Fehlgeburt führen kann. Schätzungen zufolge sind anatomische Anomalien für bis zu 15% aller Fehlgeburten verantwortlich.
• Angeborene Gebärmutteranomalien: Uterusfehlbildungen wie ein septierter, zwei- oder einhörniger Uterus können das Risiko einer Fehlgeburt erhöhen. Ein septierter Uterus, bei dem ein faseriges Septum die Gebärmutterhöhle teilt, ist besonders mit hohen Fehlgeburtsraten verbunden. Das Septum kann möglicherweise nicht ausreichend Blut zum implantierten Embryo fließen lassen, was zu einer Plazentainsuffizienz und einem Schwangerschaftsverlust führen kann (Grimbizis et al., 2001). Eine chirurgische Korrektur des Septums hat sich als hilfreich für die Schwangerschaftsergebnisse erwiesen.
• Erworbene Gebärmutteranomalien: Erkrankungen wie Myome (insbesondere submuköse Myome, die die Gebärmutterhöhle verformen) und intrauterine Verwachsungen (Narbenbildung in der Gebärmutter, oft infolge früherer Operationen oder Infektionen) können die Einnistung oder die Entwicklung des Fötus beeinträchtigen. Diese Strukturen können die Form der Gebärmutterhöhle verformen, den Platz verengen und den Blutfluss zum sich entwickelnden Embryo einschränken, wodurch das Risiko einer Fehlgeburt steigt (Saravelos et al., 2008).
3. Endokrine Störungen (Hormonelle Probleme)
Endokrine Anomalien sind gut dokumentierte Faktoren, die zu wiederholten Fehlgeburten beitragen, vor allem aufgrund ihrer Auswirkungen auf den Hormonhaushalt und die Empfänglichkeit der Gebärmutter. Hormonelle Probleme spielen bekanntermaßen bei 15-20% der wiederholten Fehlgeburten eine Rolle.
• Polyzystisches Ovarialsyndrom (PCOS): PCOS ist eine häufige endokrine Störung, die durch unregelmäßigen Eisprung, Hyperandrogenismus und Insulinresistenz gekennzeichnet ist. Erhöhte Insulinspiegel bei Frauen mit PCOS können zu einer schlechten Entwicklung des Endometriums führen und zu einem frühen Schwangerschaftsverlust beitragen (Boomsma et al., 2006). Darüber hinaus kann das mit PCOS verbundene hormonelle Ungleichgewicht die Lutealphase (die Zeit nach dem Eisprung, in der sich das Endometrium auf die Einnistung des Embryos vorbereitet) stören, was möglicherweise zu einem unzureichenden Uterusmilieu für die Einnistung führt.
• Lutealphasendefekt: Die Lutealphase wird durch das vom Corpus luteum nach dem Eisprung produzierte Progesteron reguliert und ist entscheidend für die Aufrechterhaltung einer optimalen endometrialen Umgebung für die Implantation und die frühe Unterstützung des Embryos. Ein Mangel an Progesteronproduktion, bekannt als Lutealphasendefekt, kann zu einer unzureichenden Vorbereitung des Endometriums führen, was die Implantation beeinträchtigt und das Risiko einer Fehlgeburt erhöht.
• Schilddrüsenerkrankungen: Die Schilddrüsenfunktion spielt eine wichtige Rolle bei der Aufrechterhaltung der Schwangerschaft. Eine Hypothyreose (Unterfunktion der Schilddrüse) kann zu einer unzureichenden Produktion von Schilddrüsenhormonen führen, die für die Entwicklung des Fötus unerlässlich sind, insbesondere im ersten Trimester, wenn der Fötus auf mütterliche Schilddrüsenhormone angewiesen ist. Selbst bei euthyreoten Frauen (normale Schilddrüsenfunktion) ist das Vorhandensein von Schilddrüsenautoantikörpern, insbesondere Antikörpern gegen Schilddrüsenperoxidase (TPO), mit einem 2-3-fach erhöhten Risiko einer Fehlgeburt verbunden (Thangaratinanam et al., 2011). Diese Antikörper können das mütterliche Immunsystem beeinträchtigen und das Uterusmilieu beeinträchtigen.
4. Immunologische Faktoren
Das Immunsystem muss sich anpassen, um eine Schwangerschaft zu unterstützen, da der Fötus genetisch von der Mutter verschieden ist. Störungen bei dieser Anpassung können zu einer Fehlgeburt führen.
• Antiphospholipid-Syndrom (APS): APS ist eine Autoimmunerkrankung, die durch das Vorhandensein von Antiphospholipid-Antikörpern wie Lupus-Antikoagulans und Anticardiolipin-Antikörpern gekennzeichnet ist. Diese Antikörper erhöhen das Risiko einer Blutgerinnselbildung in Blutgefäßen, einschließlich derjenigen in der Plazenta. Plazenta-Gerinnsel verringern die Sauerstoff- und Nährstoffversorgung des Fötus und führen zu Fehlgeburten. APS ist eine gut dokumentierte Ursache für wiederholte Fehlgeburten und wird in der Regel mit einer Antikoagulationstherapie behandelt (Rai et al., 2005).
• Anomalien der natürlichen Killerzellen (NK-Zellen): NK-Zellen spielen in der Frühschwangerschaft eine Rolle, indem sie die Entwicklung der Plazenta unterstützen. Erhöhte NK-Zellwerte oder eine abnormale NK-Zellfunktion werden als Ursache wiederholter Fehlgeburten vermutet, da überaktive NK-Zellen Plazentazellen angreifen können. Die genaue Rolle der NK-Zellen bei Fehlgeburten ist jedoch noch immer umstritten, und es gibt widersprüchliche Beweise dafür, ob eine NK-Zellmodulation den Schwangerschaftsverlauf verbessert (Quenby et al., 2009).
5. Thrombophile Erkrankungen
Bei vererbter Thrombophilie handelt es sich um genetische Erkrankungen, die eine Anfälligkeit für eine abnormale Blutgerinnung begründen, die während einer Schwangerschaft nachteilige Auswirkungen haben kann.
• Faktor V Leiden Mutation: Diese Mutation führt zu einer Resistenz gegen aktiviertes Protein C, ein wichtiges Antikoagulans, was zu einem hyperkoagulierbaren Zustand führt. Während der Schwangerschaft kann diese Mutation zu einer Plazentathrombose (Blutgerinnselbildung in der Plazenta) führen, wodurch die Sauerstoff- und Nährstoffversorgung des Fötus beeinträchtigt wird, was insbesondere im zweiten Trimester zu Fehlgeburten führen kann (Preston et al., 2002).
• Prothrombin-Genmutation: Diese Mutation fördert auch einen Zustand der Hyperkoagulabilität und erhöht das Risiko von Blutgerinnseln in der Plazenta. Frauen mit dieser Mutation haben ein höheres Risiko einer Fehlgeburt, insbesondere gegen Ende der Schwangerschaft.
• Protein C- und S-Mangel: Protein C und S sind natürliche Antikoagulanzien. Ein Mangel an diesen Proteinen führt zu vermehrter Gerinnselbildung, was die Funktion der Plazenta beeinträchtigen kann. Der Zusammenhang zwischen Thrombophilie und frühen Fehlgeburten bleibt jedoch umstritten, wobei einige Studien darauf schließen lassen, dass sie eher für Komplikationen in der Spätschwangerschaft relevant sind (Lockwood, 2002).
6. Lebensstil und Umweltfaktoren
Mehrere veränderbare Lebensstilfaktoren können den Schwangerschaftsausgang beeinflussen.
• Rauchen: Nikotin und andere Giftstoffe im Zigarettenrauch beeinträchtigen die Durchblutung der Gebärmutter und erzeugen eine hypoxische (sauerstoffarme) Umgebung, die die Embryonalentwicklung stören und das Risiko einer Fehlgeburt erhöhen kann. Rauchen ist mit einem höheren Risiko für Chromosomenanomalien beim Embryo verbunden, möglicherweise aufgrund des oxidativen Stresses durch Tabak (Green et al., 2007).
• Alkohol- und Koffeinkonsum: Übermäßiger Alkoholkonsum wird mit fötaler Toxizität in Verbindung gebracht, die zu Fehlgeburten führen kann. Hoher Koffeinkonsum (normalerweise über 200-300 mg pro Tag) wird mit einem erhöhten Fehlgeburtsrisiko in Verbindung gebracht, möglicherweise aufgrund seiner Auswirkungen auf das Herz-Kreislauf- und Hormonsystem, das die Schwangerschaft unterstützt (Ford & Schust, 2009).
• Fettleibigkeit: Fettleibigkeit ist mit einem höheren Risiko einer Fehlgeburt aufgrund von hormonellen Ungleichgewichten, erhöhter Insulinresistenz und chronischer leichter Entzündung verbunden. Fettleibigkeit kann auch die Empfänglichkeit des Endometriums beeinträchtigen, die für eine erfolgreiche Implantation und den Erhalt der Schwangerschaft entscheidend ist (Metwally et al., 2008).
7. Infektionen
Bestimmte Infektionen können das Risiko einer Fehlgeburt erhöhen, indem sie Entzündungsreaktionen auslösen, die das fetale Gewebe schädigen oder die mütterlich-fötale Schnittstelle stören. Während infektiöse Ursachen häufig zu einem Schwangerschaftsverlust während der aktiven Phase führen, können einige Infektionen chronische Probleme verursachen, die ein Faktor für wiederholte Fehlgeburten sein können:
• Chlamydia trachomatis und Ureaplasma urealyticum: Diese Bakterien können chronische Endometritis verursachen, eine Entzündung der Gebärmutterschleimhaut, die die Einnistung beeinträchtigen oder die Funktion der Plazenta stören und zu Fehlgeburten führen kann. Eine chronische Infektion mit diesen Bakterien wird mit negativen Schwangerschaftsergebnissen in Verbindung gebracht, obwohl es keine eindeutigen Belege dafür gibt, dass sie speziell mit wiederholten Fehlgeburten in Zusammenhang stehen (Baud et al., 2008).
• Zytomegalievirus (CMV): CMV ist ein Herpesvirus, das auf den Fötus übertragen werden kann, wenn sich die Mutter während der Schwangerschaft infiziert. Eine CMV-Infektion des Fötus kann zu Entwicklungsstörungen führen und das Risiko einer Fehlgeburt erhöhen, insbesondere wenn die Infektion früh in der Schwangerschaft auftritt. Dies ist wahrscheinlich in der aktiven Phase der Infektion ein Problem.
8. Unerklärliche Ursachen
Ungefähr die Hälfte aller wiederholten Fehlgeburten bleibt trotz gründlicher Untersuchung ungeklärt. Unerklärliche wiederholte Fehlgeburten können subtile Anomalien der Immun-, genetischen oder hormonellen Funktion beinhalten, die mit aktuellen Diagnosetests nicht erkannt werden können. Darüber hinaus sind in vielen Fällen multifaktorielle Ursachen wahrscheinlich, bei denen geringfügige Anomalien in mehreren Systemen gemeinsam zum Schwangerschaftsverlust beitragen (Coomarasamy et al., 2014). In einigen Fällen können, auch wenn die Ursache nicht bekannt ist, bestimmte vorbeugende Maßnahmen ergriffen werden, und wir beobachten mit diesen Maßnahmen positive Ergebnisse, was zeigt, dass bestimmte Probleme, auch wenn sie im Labor möglicherweise nicht erkennbar sind, dennoch auf Antikoagulation, Kortikosteroide, Antibiotika und andere vorbeugende Maßnahmen ansprechen können.
Verweise
• Baud, D., Regan, L., & Greub, G. (2008). Neue Rolle von Chlamydien und Chlamydien-ähnlichen Organismen bei ungünstigen Schwangerschaftsausgängen. Current Opinion in Infectious Diseases, 21(1), 70-76.
• Boomsma, CM, Fauser, BC, & Macklon, NS (2006). Schwangerschaftskomplikationen bei Frauen mit polyzystischem Ovarialsyndrom. Seminars in Reproductive Medicine, 24(1), 35-43.
• Chong, S., & Hutchinson, W. (2000). Die Rolle der genomischen Prägung bei Entwicklung und Krankheit. The Lancet, 355(9197), 2117–2122.
• Coomarasamy, A., et al. (2014). PROMISE-Studie: Auswirkungen von Progesteron bei wiederholten Fehlgeburten. Health Technology Assessment, 18(40), 1-70.
• Crisponi, L., Deiana, M., Loi, A., et al. (2001). Der mutmaßliche Forkhead-Transkriptionsfaktor FOXL2 ist beim Blepharophimose/Ptosis/Epicanthus inversus-Syndrom mutiert. Nature Genetics, 27(2), 159–166.
• Ford, HB, & Schust, DJ (2009). Wiederholte Fehlgeburten: Ätiologie, Diagnose und Therapie. Reviews in Obstetrics and Gynecology, 2(2), 76-83.
• Grimbizis, GF, et al. (2001). Uterusfehlbildungen und hysteroskopische Behandlungsergebnisse. Human Reproduction Update, 7(2), 161-174.
• Green, KA, et al. (2007). Rauchen und Fehlgeburt: eine systematische Übersicht. Tobacco Control, 16(2), 120-124.
• Hassold, T., et al. (2007). Der Ursprung der menschlichen Aneuploidie. Human Molecular Genetics, 16(R2), R203-R208.
• Kumar, N., Singh, AK, & Yadav, P. (2012). Männliche Unfruchtbarkeit: Ein Überblick über genetische Aspekte. Journal of Postgraduate Medicine, 58(3), 243–249.
• Lockwood, CJ (2002). Mechanismen der Endometriumblutung. Menopause, 9(6), 411-417.
• Metwally, M., et al. (2008). Auswirkungen von Fettleibigkeit auf die weibliche Fortpflanzungsfunktion. Obesity Reviews, 9(5), 456-468.
• Nagaoka, SI, Hassold, TJ, & Hunt, PA (2012). Menschliche Aneuploidie: Mechanismen und neue Erkenntnisse zu einem uralten Problem. Nature Reviews Genetics, 13(7), 493–504.
• Praxisausschuss der Amerikanischen Gesellschaft für Reproduktionsmedizin. (2012). Definitionen von Unfruchtbarkeit und wiederholten Fehlgeburten. Fertility and Sterility, 98(3), 1-2.
• Preston, FE, et al. (2002). Erhöhte fetale Verluste bei Frauen mit Thrombophilie. The Lancet, 356(9225), 270-273.
• Quenby, S., et al. (2009). Präimplantations-Endometriumleukozyten bei Frauen mit wiederholten Fehlgeburten. Human Reproduction, 14(8), 2386-2391.
• Rai, R., et al. (2005). Antiphospholipid-Antikörper bei wiederholten Fehlgeburten. Human Reproduction, 10(7), 1818-1823.
• Reddy, UM, Page, GP, & Saade, GR (2012). Die Rolle von DNA-Microarrays bei der Beurteilung des fetalen Todes. American Journal of Obstetrics and Gynecology, 207(4), 279–288.
• Rey, E., Kahn, SR, David, M., & Shrier, I. (2003). Thrombophile Erkrankungen und fetaler Verlust: Eine Metaanalyse. Lancet, 361(9361), 901–908.
• Saravelos, SH, et al. (2008). Muster von Schwangerschaftsverlusten bei Uterusanomalien. Reproductive BioMedicine Online, 17(1), 134-138.
• Stephenson, MD, Awartani, KA, & Robinson, WP (2002). Zytogenetische Analyse von Fehlgeburten bei Paaren mit wiederholten Fehlgeburten: Eine Fall-Kontroll-Studie. Human Reproduction, 17(2), 446–451.
• Thangaratinam, S., et al. (2011). Schilddrüsen-Autoantikörper und Fehlgeburtsrisiko. British Medical Journal, 342, d2616.
• Xu, Y., Li, L., Zhang, H., et al. (2020). Klinische Anwendung der Exomsequenzierung bei wiederholten Fehlgeburten. Journal of Clinical Medicine, 9(4), 1156.
IVF-Zentrum Nordzypern
Das IVF-Zentrum Nordzypern ist eine patientenorientierte Fruchtbarkeitsklinik mit Sitz in „Elite-Forschungs- und Chirurgiekrankenhaus“ in Nikosia, Zypern. Unsere Klinik ist eine der fortschrittlichsten Fruchtbarkeitskliniken der Welt und bietet eine größere Auswahl an Behandlungsmöglichkeiten zu erschwinglichen Preisen.
Kontakt
Telefon
Englisch: +90 548 875 8000
Französisch: +90 548 876 8000
Türkisch: +90 542 869 8000
Arabisch: +90 548 875 8000
Deutsch: +90 548 830 1987
Russisch: +90 548 828 9955
info@northcyprusivf.net
© 2020 LowCostIVF – Alle Rechte vorbehalten. Datenschutz-Bestimmungen