- À propos
- Blog
- Infertilité
- Traitements de FIV
- Nouvelles avancées FIV
- Thérapie de remplacement mitochondrial!
- Traitement de FIV à Chypre
- IUI
- Mini FIV
- FIV + ICSI
- FIV cytoplasmique
- Cycle de FIV en tandem
- Don d'ovules
- Don d'embryons
- Don de sperme
- Genre – Sélection du sexe
- GPA gestationnelle
- Gestation pour autrui gay de même sexe
- Récupération chirurgicale de sperme
- Diagnostic Génétique Pré Implantation PGD
- Congélation d'oeufs
- Sélection du sexe à l'aide d'ovules de donneur
- Prévention de la drépanocytose
- FAQ
- Voyage
- À propos
- Blog
- Infertilité
- Traitements de FIV
- Nouvelles avancées FIV
- Thérapie de remplacement mitochondrial!
- Traitement de FIV à Chypre
- IUI
- Mini FIV
- FIV + ICSI
- FIV cytoplasmique
- Cycle de FIV en tandem
- Don d'ovules
- Don d'embryons
- Don de sperme
- Genre – Sélection du sexe
- GPA gestationnelle
- Gestation pour autrui gay de même sexe
- Récupération chirurgicale de sperme
- Diagnostic Génétique Pré Implantation PGD
- Congélation d'oeufs
- Sélection du sexe à l'aide d'ovules de donneur
- Prévention de la drépanocytose
- FAQ
- Voyage
Fausses couches
Fausses couches répétées (récurrentes) et options de traitement
La perte d’une grossesse peut être une expérience très traumatisante pour les couples. Des études indiquent que plus d’un cinquième des femmes qui subissent une perte de grossesse présentent des symptômes d’anxiété et de dépression. Lorsqu’une seule perte de grossesse peut avoir des effets aussi traumatisants, les pertes de grossesse récurrentes (RPL) peuvent avoir des effets psychologiques dévastateurs.
Les fausses couches à répétition, également appelées fausses couches à répétition, sont généralement définies comme la survenue de deux fausses couches consécutives ou plus avant 20 semaines de gestation. Ce phénomène touche environ 1 à 21 femmes en âge de procréer et entraîne des conséquences physiques et émotionnelles importantes (Practice Committee of the American Society for Reproductive Medicine, 2012). Contrairement aux fausses couches isolées, qui sont souvent attribuées à des anomalies chromosomiques aléatoires, les fausses couches à répétition sont plus probablement dues à des pathologies sous-jacentes. L’une des premières choses à prendre en compte est le moment où la patiente fait ses fausses couches. Les fausses couches survenues à différentes périodes de gestation peuvent indiquer différents facteurs. La compréhension de ces causes permet de guider une gestion et un soutien efficaces pour les couples concernés.
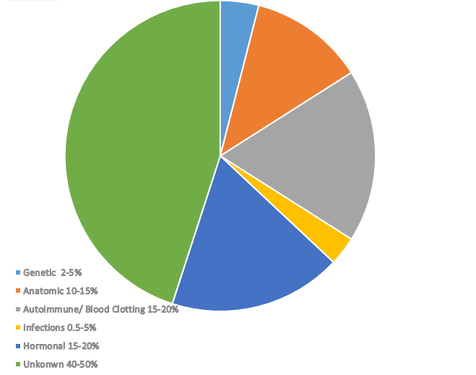
Bien qu’il existe un certain nombre de facteurs reconnus pouvant être liés aux fausses couches répétées, les causes de près de la moitié des grossesses récurrentes restent encore mystérieuses. Ensemble, les facteurs auto-immuns, les problèmes hormonaux et les problèmes de coagulation sanguine représentent près de 70% de toutes les causes connues. Par conséquent, lorsqu’une femme subit plusieurs fausses couches, le point de départ des tests concerne généralement l’un de ces trois domaines.
Raisons des fausses couches consécutives
Les causes suivantes (sans ordre spécifique) sont connues pour être impliquées dans les fausses couches répétées :
1. Facteur génétique
Les causes génétiques sont responsables de 2 à 5 % de toutes les fausses couches. Parmi les causes génétiques, les anomalies chromosomiques sont la principale cause génétique de fausses couches, représentant environ 50 à 60% des fausses couches précoces qui surviennent pour des raisons génétiques. Ces anomalies comprennent des défauts chromosomiques numériques et structurels.
A. Aneuploïdie
L'aneuploïdie, un nombre anormal de chromosomes, est l'une des causes les plus courantes de fausses couches. La trisomie (présence d'un chromosome supplémentaire) est l'aneuploïdie la plus fréquemment observée, en particulier les trisomies des chromosomes 16, 21 et 22. La monosomie X (syndrome de Turner) est également fréquente parmi les fausses couches, mais elle est rarement viable au-delà du premier trimestre (Hassold et Hunt, 2001). Les aneuploïdies surviennent souvent en raison d'une non-disjonction méiotique, un processus dans lequel les chromosomes ne se séparent pas correctement pendant la division cellulaire des gamètes, ce qui conduit à des embryons avec un contenu chromosomique anormal (Nagaoka et al., 2012).
B. Anomalies chromosomiques structurelles
Les anomalies chromosomiques structurelles, notamment les translocations, les inversions et les délétions, contribuent également aux fausses couches à répétition. Les translocations se produisent lorsque des segments chromosomiques sont réarrangés entre des chromosomes non homologues. Les translocations équilibrées, qui n'entraînent pas de gain ou de perte nette de matériel génétique, peuvent ne pas affecter l'individu, mais peuvent entraîner des fausses couches si les chromosomes réarrangés perturbent le développement de l'embryon (Stephenson et al., 2002). L'analyse du caryotype parental peut souvent révéler des anomalies structurelles chez les couples présentant des fausses couches à répétition.
C. Syndromes génétiques et mutations monogéniques
Bien que les anomalies chromosomiques soient importantes, les mutations monogéniques ou les syndromes génétiques peuvent également augmenter le risque de fausse couche.
C1. Syndromes génétiques héréditaires
Des maladies génétiques héréditaires, notamment les syndromes autosomiques récessifs ou autosomiques dominants, peuvent contribuer à la fausse couche. Par exemple, des mutations du gène FOXL2, associées au syndrome de blépharophimosis-ptosis-Epicanthus Inversus, peuvent entraîner un dysfonctionnement ovarien, augmentant ainsi le risque de fausse couche (Crisponi et al., 2001).
C2. Mutations génétiques associées à la thrombophilie
Des mutations génétiques spécifiques à l’origine de la thrombophilie, ou augmentation de la coagulation sanguine, ont été associées aux fausses couches. Des mutations dans des gènes tels que F5 (facteur V Leiden) et F2 (prothrombine) peuvent entraîner une coagulation anormale du sang dans le placenta, altérant la circulation sanguine et provoquant finalement une fausse couche (Rey et al., 2003). Bien que la thrombophilie soit une maladie multifactorielle, la prédisposition génétique est un facteur contribuant à certaines fausses couches récurrentes.
D. Facteurs épigénétiques et âge des parents
Les changements épigénétiques, c’est-à-dire les modifications héréditaires de l’expression des gènes qui n’impliquent pas de modifications de la séquence d’ADN, contribuent également au risque de fausse couche. Les erreurs de méthylation de l’ADN, par exemple, peuvent perturber l’expression des gènes dans l’embryon, entraînant un arrêt du développement et une fausse couche.
D1. Âge des parents
L’âge avancé de la mère et du père est associé à des risques accrus d’anomalies génétiques, principalement en raison d’une accumulation de mutations dans les cellules germinales au fil du temps. Les femmes de plus de 35 ans présentent un risque plus élevé de produire des ovocytes présentant des erreurs chromosomiques, ce qui peut entraîner des fausses couches (Hassold et Chiu, 1985). De même, l’âge avancé du père a été associé à la fragmentation de l’ADN dans les spermatozoïdes, ce qui peut augmenter le risque de fausse couche en raison d’un développement anormal de l’embryon (Kumar et al., 2012).
D2. Troubles de l'empreinte
Les troubles de l'empreinte génétique, dans lesquels certains gènes sont exprimés de manière spécifique au parent d'origine, sont liés au risque de fausse couche. Les erreurs d'empreinte génétique peuvent conduire à des troubles tels que le syndrome de Prader-Willi ou le syndrome d'Angelman, qui peuvent entraîner des fausses couches ou des grossesses à issue défavorable (Chong et Hutchinson, 2000).
Les progrès des technologies génomiques ont grandement amélioré la compréhension des causes génétiques des fausses couches. Le séquençage à haut débit, l’analyse des microréseaux chromosomiques (CMA) et les tests génétiques préimplantatoires (PGT) permettent une analyse chromosomique et génétique détaillée des embryons et des parents.
1. Analyse de microréseaux chromosomiques (CMA)
Dans de nombreuses cliniques, le caryotype a remplacé le caryotype comme principal test d'identification des anomalies chromosomiques dans les tissus des fausses couches. Cette technologie détecte les déséquilibres chromosomiques submicroscopiques que le caryotype traditionnel peut manquer, ce qui permet de mieux comprendre les causes des fausses couches inexpliquées (Reddy et al., 2012).
2. Séquençage de nouvelle génération (NGS)
Le NGS a facilité l’identification de mutations monogéniques et d’anomalies génétiques à petite échelle qui contribuent aux fausses couches. Il a également contribué à la découverte de nouveaux gènes associés aux fausses couches précoces, offrant ainsi de meilleures perspectives sur les causes génétiques (Xu et al., 2020). Lorsque les patientes subissent plusieurs fausses couches, un cycle de FIV impliquant un test NGS devient un outil très efficace. Cela n’est pas seulement fait pour les fausses couches récurrentes, mais c’est également un outil efficace pour les échecs répétés de FIV.
2. Anomalies anatomiques
Les anomalies structurelles de l'appareil reproducteur peuvent altérer l'implantation, perturber le développement normal du fœtus ou entraîner une insuffisance placentaire, autant de facteurs qui peuvent contribuer à une fausse couche non désirée. On estime que les anomalies anatomiques sont responsables de 151 fausses couches.
• Anomalies utérines congénitales:Les malformations utérines, telles que l'utérus cloisonné, bicorne ou unicorne, peuvent augmenter le risque de fausse couche. Un utérus cloisonné, où un septum fibreux divise la cavité utérine, est particulièrement associé à des taux élevés de fausses couches. Le septum peut ne pas permettre un flux sanguin adéquat vers l'embryon implanté, ce qui entraîne une insuffisance placentaire et une fausse couche (Grimbizis et al., 2001). Il a été démontré que la correction chirurgicale du septum améliore les résultats de la grossesse.
• Anomalies utérines acquises:Des pathologies telles que les fibromes (en particulier les fibromes sous-muqueux qui déforment la cavité utérine) et les adhérences intra-utérines (cicatrisations dans l'utérus, souvent le résultat d'interventions chirurgicales ou d'infections antérieures) peuvent interférer avec l'implantation ou le développement du fœtus. Ces structures peuvent déformer la cavité utérine, réduire l'espace et limiter le flux sanguin vers l'embryon en développement, augmentant ainsi le risque de fausse couche (Saravelos et al., 2008).
3. Troubles endocriniens (problèmes hormonaux)
Les anomalies endocriniennes sont des facteurs bien documentés contribuant aux fausses couches à répétition, principalement en raison de leur impact sur l'équilibre hormonal et la réceptivité utérine. On sait que les problèmes hormonaux jouent un rôle dans les fausses couches à répétition.
• Syndrome des ovaires polykystiques (SOPK):Le SOPK est un trouble endocrinien courant caractérisé par une ovulation irrégulière, une hyperandrogénie et une résistance à l'insuline. Des taux élevés d'insuline chez les femmes atteintes du SOPK peuvent entraîner un mauvais développement de l'endomètre et contribuer à une fausse couche précoce (Boomsma et al., 2006). De plus, le déséquilibre hormonal associé au SOPK peut perturber la phase lutéale (la période après l'ovulation pendant laquelle l'endomètre se prépare à l'implantation de l'embryon), ce qui peut conduire à un environnement utérin inadéquat pour l'implantation.
• Défaut de la phase lutéale : La phase lutéale, régulée par la progestérone produite par le corps jaune après l'ovulation, est essentielle au maintien d'un environnement endométrial optimal pour l'implantation et le soutien précoce de l'embryon. Une déficience de la production de progestérone, appelée défaut de phase lutéale, peut entraîner une préparation endométriale insuffisante, ce qui altère l'implantation et augmente le risque de fausse couche.
• Troubles de la thyroïde:La fonction thyroïdienne joue un rôle important dans le maintien de la grossesse. L'hypothyroïdie (thyroïde sous-active) peut entraîner une production insuffisante d'hormones thyroïdiennes, essentielles au développement du fœtus, en particulier au cours du premier trimestre, lorsque le fœtus dépend des hormones thyroïdiennes maternelles. Même chez les femmes euthyroïdiennes (fonction thyroïdienne normale), la présence d'autoanticorps thyroïdiens, en particulier d'anticorps anti-thyroïde peroxydase (TPO), est associée à un risque de fausse couche 2 à 3 fois plus élevé (Thangaratinam et al., 2011). Ces anticorps peuvent affecter le système immunitaire maternel, altérant l'environnement utérin.
4. Facteurs immunologiques
Le système immunitaire doit s'adapter pour soutenir la grossesse, car le fœtus est génétiquement différent de la mère. Des perturbations dans cette adaptation peuvent entraîner une fausse couche.
• Syndrome des antiphospholipides (APS):Le SAPL est une maladie auto-immune caractérisée par la présence d'anticorps antiphospholipides, tels que les anticorps anticoagulants lupiques et les anticorps anticardiolipine. Ces anticorps augmentent le risque de formation de caillots dans les vaisseaux sanguins, y compris ceux du placenta. Les caillots placentaires réduisent l'apport d'oxygène et de nutriments au fœtus, ce qui entraîne une fausse couche. Le SAPL est une cause bien documentée de fausses couches récurrentes et sa prise en charge implique généralement un traitement anticoagulant (Rai et al., 2005).
• Anomalies des cellules tueuses naturelles (NK):Les cellules NK jouent un rôle en début de grossesse, en contribuant au développement du placenta. On suppose que des taux élevés de cellules NK ou une fonction anormale des cellules NK contribuent aux fausses couches à répétition, car les cellules NK hyperactives peuvent attaquer les cellules placentaires. Cependant, le rôle exact des cellules NK dans les fausses couches fait encore l'objet de débats, les preuves étant contradictoires quant à savoir si la modulation des cellules NK améliore les résultats de la grossesse (Quenby et al., 2009).
5. Troubles thrombophiliques
Les thrombophilies héréditaires sont des maladies génétiques qui prédisposent les individus à une coagulation sanguine anormale, ce qui peut avoir des effets indésirables pendant la grossesse.
• Mutation du facteur V de Leiden:Cette mutation entraîne une résistance à la protéine C activée, un anticoagulant essentiel, ce qui entraîne un état d'hypercoagulabilité. Pendant la grossesse, cette mutation peut entraîner une thrombose placentaire (formation de caillots dans le placenta), altérant l'apport d'oxygène et de nutriments au fœtus, ce qui peut provoquer une fausse couche, en particulier au cours du deuxième trimestre (Preston et al., 2002).
• Mutation du gène de la prothrombine:Cette mutation favorise également un état d'hypercoagulabilité, augmentant le risque de caillots sanguins placentaires. Les femmes porteuses de cette mutation ont un risque plus élevé de fausse couche, surtout en fin de grossesse.
• Déficits en protéines C et S:Les protéines C et S sont des anticoagulants naturels. Les carences en ces protéines entraînent une augmentation de la formation de caillots, ce qui peut compromettre la fonction placentaire. Cependant, le lien entre thrombophilies et fausses couches précoces reste controversé, certaines études suggérant qu'elles sont plus pertinentes pour les complications de fin de grossesse (Lockwood, 2002).
6. Mode de vie et facteurs environnementaux
Plusieurs facteurs de style de vie modifiables peuvent avoir un impact sur les résultats de la grossesse.
• Fumeur:La nicotine et d'autres toxines présentes dans la fumée de cigarette altèrent la circulation sanguine utérine, créant un environnement hypoxique (faible teneur en oxygène) qui peut perturber le développement de l'embryon et augmenter le risque de fausse couche. Le tabagisme est associé à un risque plus élevé d'anomalies chromosomiques chez l'embryon, probablement en raison du stress oxydatif dû au tabac (Green et al., 2007).
• Consommation d'alcool et de caféine:Une consommation excessive d'alcool est associée à une toxicité fœtale, qui peut contribuer à une fausse couche. Une consommation élevée de caféine (généralement supérieure à 200-300 mg par jour) a été associée à un risque accru de fausse couche, potentiellement en raison de ses effets sur les systèmes cardiovasculaire et hormonal qui soutiennent la grossesse (Ford & Schust, 2009).
• Obésité:L'obésité est associée à un risque plus élevé de fausse couche en raison de déséquilibres hormonaux, d'une résistance accrue à l'insuline et d'une inflammation chronique de faible intensité. L'obésité peut également altérer la réceptivité endométriale, essentielle à la réussite de l'implantation et au maintien de la grossesse (Metwally et al., 2008).
7. Infections
Certaines infections peuvent augmenter le risque de fausse couche en provoquant des réactions inflammatoires qui endommagent les tissus fœtaux ou perturbent l'interface mère-fœtus. Si les causes infectieuses sont souvent susceptibles d'induire une fausse couche pendant la phase active, certaines infections peuvent provoquer des problèmes chroniques qui peuvent être un facteur de fausses couches récurrentes :
• Chlamydia trachomatis et Ureaplasma urealyticum:Ces bactéries peuvent provoquer une endométrite chronique, une inflammation de la muqueuse utérine, qui peut altérer l'implantation ou perturber la fonction placentaire, entraînant une fausse couche. Une infection chronique par ces bactéries a été associée à des issues de grossesse défavorables, bien que les preuves les reliant spécifiquement aux fausses couches à répétition soient mitigées (Baud et al., 2008).
• Cytomégalovirus (CMV): Le CMV est un virus de l'herpès qui peut être transmis au fœtus si la mère est infectée pendant la grossesse. L'infection fœtale par le CMV peut entraîner des anomalies du développement et augmenter le risque de fausse couche, en particulier lorsque l'infection survient en début de grossesse. Cela est susceptible de poser problème pendant la phase active de l'infection.
8. Causes inexpliquées
Environ la moitié des fausses couches à répétition restent inexpliquées malgré une évaluation approfondie. Les fausses couches à répétition inexpliquées peuvent impliquer des anomalies subtiles de la fonction immunitaire, génétique ou hormonale que les tests diagnostiques actuels ne peuvent pas détecter. De plus, des causes multifactorielles sont probables dans de nombreux cas, où des anomalies mineures dans plusieurs systèmes contribuent collectivement à la perte de grossesse (Coomarasamy et al., 2014). Dans certains cas, même si la cause n'est pas connue, certaines mesures prophylactiques peuvent être prises et nous observons des résultats positifs avec ces mesures, ce qui montre que même si certains problèmes peuvent ne pas apparaître dans les analyses de laboratoire, ils peuvent toujours répondre à l'anticoagulation, aux corticostéroïdes, aux antibiotiques et à d'autres mesures prophylactiques.
Les références
• Baud, D., Regan, L., & Greub, G. (2008). Rôle émergent des organismes Chlamydia et apparentés dans les issues défavorables de la grossesse. Current Opinion in Infectious Diseases, 21(1), 70-76.
• Boomsma, CM, Fauser, BC, et Macklon, NS (2006). Complications de la grossesse chez les femmes atteintes du syndrome des ovaires polykystiques. Séminaires en médecine de la reproduction, 24(1), 35-43.
• Chong, S. et Hutchinson, W. (2000). Le rôle de l'empreinte génomique dans le développement et la maladie. The Lancet, 355(9197), 2117–2122.
• Coomarasamy, A., et al. (2014). Essai PROMISE : effets de la progestérone sur les fausses couches à répétition. Health Technology Assessment, 18(40), 1-70.
• Crisponi, L., Deiana, M., Loi, A., et al. (2001). Le facteur de transcription putatif FOXL2 est muté dans le syndrome blépharophimosis/ptosis/epicanthus inversus. Nature Genetics, 27(2), 159–166.
• Ford, HB et Schust, DJ (2009). Pertes de grossesse récurrentes : étiologie, diagnostic et traitement. Revues en obstétrique et gynécologie, 2(2), 76-83.
• Grimbizis, GF, et al. (2001). Malformations utérines et résultats du traitement hystéroscopique. Human Reproduction Update, 7(2), 161-174.
• Green, KA, et al. (2007). Tabagisme et fausses couches : une revue systématique. Tobacco Control, 16(2), 120-124.
• Hassold, T., et al. (2007). L'origine de l'aneuploïdie humaine. Génétique moléculaire humaine, 16(R2), R203-R208.
• Kumar, N., Singh, AK et Yadav, P. (2012). Infertilité masculine : aperçu des aspects génétiques. Journal of Postgraduate Medicine, 58(3), 243–249.
• Lockwood, CJ (2002). Mécanismes des saignements endométriaux. Ménopause, 9(6), 411-417.
• Metwally, M., et al. (2008). Impact de l'obésité sur la fonction reproductrice féminine. Obesity Reviews, 9(5), 456-468.
• Nagaoka, SI, Hassold, TJ et Hunt, PA (2012). Aneuploïdie humaine : mécanismes et nouvelles perspectives sur un problème ancien. Nature Reviews Genetics, 13(7), 493–504.
• Comité de pratique de l'American Society for Reproductive Medicine. (2012). Définitions de l'infertilité et des fausses couches à répétition. Fertility and Sterility, 98(3), 1-2.
• Preston, FE, et al. (2002). Augmentation des pertes fœtales chez les femmes atteintes de thrombophilie. The Lancet, 356(9225), 270-273.
• Quenby, S., et al. (2009). Leucocytes endométriaux préimplantatoires chez les femmes ayant des fausses couches à répétition. Human Reproduction, 14(8), 2386-2391.
• Rai, R., et al. (2005). Anticorps antiphospholipides dans les fausses couches à répétition. Reproduction humaine, 10(7), 1818-1823.
• Reddy, UM, Page, GP, & Saade, GR (2012). Le rôle des microarrays d'ADN dans l'évaluation de la mort fœtale. American Journal of Obstetrics and Gynecology, 207(4), 279–288.
• Rey, E., Kahn, SR, David, M. et Shrier, I. (2003). Troubles thrombophiliques et perte fœtale : une méta-analyse. Lancet, 361(9361), 901–908.
• Saravelos, SH, et al. (2008). Schéma de fausse couche en cas d'anomalies utérines. Reproductive BioMedicine Online, 17(1), 134-138.
• Stephenson, MD, Awartani, KA et Robinson, WP (2002). Analyse cytogénétique des fausses couches chez les couples ayant des fausses couches à répétition : une étude cas-témoins. Human Reproduction, 17(2), 446–451.
• Thangaratinam, S., et al. (2011). Autoanticorps thyroïdiens et risque de fausse couche. British Medical Journal, 342, d2616.
• Xu, Y., Li, L., Zhang, H., et al. (2020). Application clinique du séquençage de l'exome entier dans les fausses couches à répétition. Journal of Clinical Medicine, 9(4), 1156.
Centre de FIV de Chypre du Nord
Le centre de FIV de Chypre du Nord est une clinique de fertilité axée sur le patient, située dans "Hôpital de recherche et de chirurgie d'élite» à Nicosie, Chypre. Notre clinique est l’une des cliniques de fertilité les plus avancées au monde, offrant une plus large sélection d’options de traitement à des prix abordables.
Nous Contacter
Téléphone
Anglais: +90 548 875 8000
Français: +90 548 876 8000
Turc: +90 542 869 8000
Arabe: +90 548 875 8000
Allemand: +90 548 830 1987
Russe: +90 548 828 9955
info@northcyprusivf.net
© 2020 LowCostIVF - Tous droits réservés. politique de confidentialité