- À propos
- Blog
- Infertilité
- Traitements de FIV
- Nouvelles avancées FIV
- Thérapie de remplacement mitochondrial!
- Traitement de FIV à Chypre
- IUI
- Mini FIV
- FIV + ICSI
- FIV cytoplasmique
- Cycle de FIV en tandem
- Don d'ovules
- Don d'embryons
- Don de sperme
- Genre – Sélection du sexe
- GPA gestationnelle
- Gestation pour autrui gay de même sexe
- Récupération chirurgicale de sperme
- Diagnostic Génétique Pré Implantation PGD
- Congélation d'oeufs
- Sélection du sexe à l'aide d'ovules de donneur
- Prévention de la drépanocytose
- FAQ
- Voyage
- À propos
- Blog
- Infertilité
- Traitements de FIV
- Nouvelles avancées FIV
- Thérapie de remplacement mitochondrial!
- Traitement de FIV à Chypre
- IUI
- Mini FIV
- FIV + ICSI
- FIV cytoplasmique
- Cycle de FIV en tandem
- Don d'ovules
- Don d'embryons
- Don de sperme
- Genre – Sélection du sexe
- GPA gestationnelle
- Gestation pour autrui gay de même sexe
- Récupération chirurgicale de sperme
- Diagnostic Génétique Pré Implantation PGD
- Congélation d'oeufs
- Sélection du sexe à l'aide d'ovules de donneur
- Prévention de la drépanocytose
- FAQ
- Voyage
Thérapie par cellules souches pour l'azoospermie
Traitement de l'azoospermie
Comment le traitement par cellules souches peut-il aider à lutter contre l'infertilité masculine ?
L'azoospermie est une condition dans laquelle il n'y a pas de spermatozoïdes vivants ou matures dans l'éjaculat d'un homme. Dans la plupart des cas, l'éjaculat peut contenir du sperme avec d'autres cellules, par conséquent, l'existence d'un éjaculat liquide ne suggère pas l'existence de spermatozoïdes. L'azoospermie peut être divisée en deux catégories principales :
Azoospermie obstructive:Lorsqu'une obstruction se produit, les spermatozoïdes ne peuvent pas être libérés dans l'éjaculat, même si la production de spermatozoïdes reste active. L'azoospermie obstructive peut résulter de diverses causes. La cause la plus courante aujourd'hui est la vasectomie, une condition dont les patients sont généralement conscients. Cependant, d'autres facteurs peuvent également empêcher les spermatozoïdes de pénétrer dans l'éjaculat. Ces facteurs comprennent :
1. Anomalies du système canalaire
Les spermatozoïdes doivent traverser le système canalaire pour atteindre l'urètre. Après avoir été produits dans les testicules, les spermatozoïdes traversent plusieurs structures, notamment l'épididyme, le canal déférent (ou canal déférent), le canal éjaculateur et l'urètre. Toute perturbation du transport des spermatozoïdes à travers ou entre ces structures peut obstruer leur passage. (Reportez-vous à la figure ci-dessous pour une représentation visuelle de ces structures.)
2. Dysfonction éjaculatoire
Le processus d'émission, au cours duquel le sperme est déposé dans l'urètre avant l'éjaculation, peut présenter un dysfonctionnement. Ce dysfonctionnement peut résulter d'une lésion neurologique ou, dans certains cas, d'un diabète non contrôlé.
En cas d'azoospermie obstructive, utiliser techniques chirurgicales d'extraction de sperme aident souvent à obtenir un nombre acceptable de spermatozoïdes viables à utiliser au cours d’un cycle de FIV.
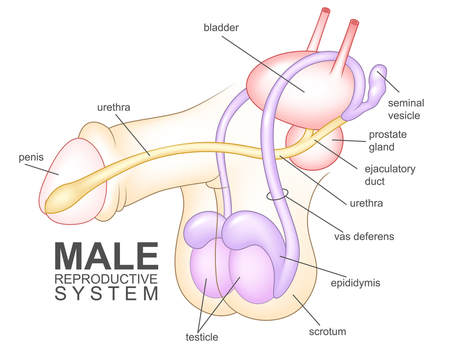
Traitement de l'azoospermie non obstructive:L'azoospermie non obstructive (ANO) est une affection caractérisée par l'absence de spermatozoïdes dans l'éjaculat en raison d'une production altérée de spermatozoïdes dans les testicules. Contrairement à l'azoospermie obstructive, qui résulte de blocages dans l'appareil reproducteur, l'ANO résulte d'un dysfonctionnement testiculaire intrinsèque. Cela peut se produire en raison d'anomalies génétiques (telles que le syndrome de Klinefelter ou les microdélétions du chromosome Y), de déséquilibres hormonaux ou de lésions des testicules dues à des infections, à un traumatisme, à une chimiothérapie ou à une radiothérapie. Dans de nombreux cas, la cause sous-jacente reste idiopathique. L'ANO est une cause importante d'infertilité masculine et se présente souvent avec un volume testiculaire plus petit et des niveaux élevés d'hormone folliculo-stimulante (FSH) alors que le corps tente de compenser une spermatogenèse réduite. Le diagnostic implique généralement un profil hormonal, des tests génétiques et parfois une biopsie testiculaire pour confirmer l'absence de spermatozoïdes matures.
Le but d'une biopsie testiculaire est d'inspecter minutieusement le tissu testiculaire pour détecter la présence de spermatozoïdes moins matures. Même lorsque la spermatogenèse (le processus de production et de maturation des spermatozoïdes) n'est pas complètement achevée, il peut y avoir des spermatozoïdes à des stades antérieurs qui peuvent éventuellement être utilisés. Le diagramme suivant montre le cycle complet de la spermatogenèse, des cellules souches aux spermatozoïdes matures :
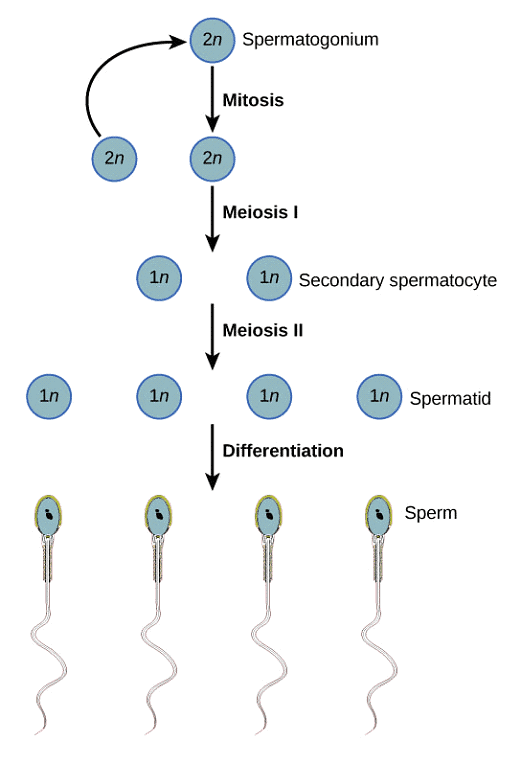
Si la biopsie du patient révèle la présence de spermatides à un stade avancé (spermatides allongées), même si la conception naturelle ne fonctionne pas, les spermatides à un stade avancé sont souvent utilisées avec succès lors d'un cycle de FIV avec recours à l'ICSI. Cependant, tout stade de maturation des spermatides avant l'apparition des spermatides allongées ne permettra pas une FIV réussie.
À ce stade, s'il n'y a pas de cellules germinales présentes et que le diagnostic du syndrome des cellules de Sertoli est posé, la seule autre option pour engendrer un enfant sera alors l'utilisation du sperme d'un donneur ou l'adoption. Les cellules germinales sont des spermatozoïdes immatures qui ont le potentiel de se développer et de se différencier en spermatozoïdes matures. Ceux-ci peuvent être considérés comme des spermatozoïdes immatures et indifférenciés. Ils comprennent :
– Spermatogonies
– Spermatocytes primaires
– Spermatocytes secondaires
– Spermatides à un stade précoce
– Spermatides à un stade avancé
La présence de cellules germinales dans le tissu testiculaire est une condition préalable à la thérapie par cellules souches. La raison est simple. Nous utilisons des cellules souches mésenchymateuses provenant du tissu adipeux du patient pour le traitement par cellules souches. Les cellules souches mésenchymateuses ont un potentiel de différenciation limité. Cependant, dans les bonnes conditions, elles peuvent se différencier en de nombreux types de cellules. Les cellules souches mésenchymateuses ont principalement tendance à se différencier en types de cellules environnantes, à moins qu'elles ne soient spécifiquement programmées pour se différencier en un type de cellule spécifique. Dans nos traitements, aucune programmation cellulaire n'est impliquée. Les cellules souches dérivées du tissu adipeux du patient sont isolées et injectées dans le tissu testiculaire où sont présentes les cellules germinales. Ayant des cellules germinales dans le tissu adipeux environnant, les cellules souches les suivent comme modèle et se différencient également en cellules germinales. Cependant, ce n'est qu'une partie du processus. Étant donné que les cellules germinales existantes dans les testicules du patient ne sont pas en mesure d'achever la spermatogenèse et de devenir des spermatozoïdes pleinement matures, des étapes supplémentaires doivent être mises en place pour favoriser cette différenciation.
Lorsque nous introduisons des cellules souches dans les tubes séminifères, nous injectons également le plasma riche en plaquettes du patient, issu de son échantillon de sang périphérique. Le plasma riche en plaquettes est riche en facteurs de croissance qui permettent la croissance et le développement cellulaires ainsi qu'une meilleure irrigation sanguine des tissus. Par conséquent, les cellules souches bénéficient d'une riche infusion de facteurs de croissance dans leur environnement afin de faciliter leur développement. De plus, nous utilisons des exosomes dérivés du placenta afin d'améliorer la communication cellulaire dans les testicules.
La thérapie par cellules souches, dans son intégralité, vise à :
1- Augmenter la population de cellules germinales dans le tissu testiculaire en fournissant des cellules souches dans le tissu testiculaire.
2- Permettre à ces cellules germinales de croître et de se développer à l’aide de facteurs de croissance.
3- Améliorer la communication cellulaire et faciliter la réponse à la stimulation hormonale à l’aide d’exosomes.
Qu'est-ce que le plasma riche en plaquettes (PRP)? Le PRP est une concentration de plaquettes provenant du sang d'un individu, enrichie de facteurs de croissance et de protéines bioactives qui favorisent la cicatrisation et la régénération des tissus. Le PRP est couramment utilisé dans les traitements médicaux et esthétiques pour accélérer la réparation des tissus endommagés, réduire l'inflammation et stimuler la prolifération cellulaire.
Les plaquettes jouent un rôle clé dans la cicatrisation des plaies et la réparation des tissus en libérant des facteurs de croissance tels que :
⦁ Facteur de croissance dérivé des plaquettes (PDGF):Stimule la croissance cellulaire et la formation de nouveaux vaisseaux sanguins.
⦁ Facteur de croissance transformant bêta (TGF-β):Favorise la réparation des tissus et réduit l’inflammation.
⦁ Facteur de croissance endothélial vasculaire (VEGF):Favorise la formation de nouveaux vaisseaux sanguins.
⦁ Facteur de croissance épidermique (EGF):Soutient la régénération cellulaire et la cicatrisation des plaies.
Lorsque le PRP est injecté dans une zone cible, ces facteurs de croissance recrutent et activent les processus de guérison naturels du corps, notamment l'activation des cellules souches et la synthèse du collagène.
Que sont les Exosomes ?
Les exosomes sont de minuscules nanovésicules présentes dans les espaces interstitiels ainsi que dans les fluides corporels. En raison de leur taille, les exosomes ont toujours été considérés comme des artefacts ou des déchets cellulaires sans fonction physiologique. Cependant, avec les progrès de la recherche dans le domaine de la médecine, ils sont maintenant connus pour faire partie d'un système de communication intracellulaire méticuleux.
Les exosomes sont connus pour leur implication dans tous les types de communication cellulaire. Ils fournissent des signaux autocrines locaux entre des types de cellules similaires, des signaux paracrines locaux entre différents types de cellules ainsi que des signaux endocriniens distants. Leur implication dans une signalisation cellulaire aussi étendue leur a valu le nom de « signalosomes ». Lorsque les exosomes sont introduits dans le corps, ils améliorent la communication via tous les canaux, ce qui contribue à la santé globale et à la fonction des cellules.
Par rapport aux cellules souches adultes, les exosomes contiennent 300% plus de facteurs de croissance, qui sont essentiels à la croissance, au développement et à la régénération cellulaires. Les exosomes peuvent être administrés par perfusion IV ou peuvent être dirigés vers un site spécifique par injection directe.
Comment se déroule la thérapie par cellules souches ?
Au Centre de FIV de Chypre du Nord, les thérapies à base de cellules souches que nous pratiquons pour le traitement de l'azoospermie non obstructive utilisent un cocktail de cellules souches mésenchymateuses, de plasma riche en plaquettes et d'exosomes. L'isolement des cellules souches nécessite une intervention chirurgicale appelée liposuccion.
Le procédure de liposuccion pour obtenir cellules souches mésenchymateuses (CSM) Il s'agit d'une technique chirurgicale mini-invasive utilisée pour prélever du tissu adipeux, riche en cellules souches mésenchymateuses (CSM). L'intervention chirurgicale comprend plusieurs étapes :
1. Préparation préopératoire :
Le patient est soumis à une évaluation médicale pour s'assurer qu'il est apte à subir l'intervention. Cette évaluation comprend une série de tests hormonaux, éventuellement une évaluation du scrotum et une biopsie testiculaire pour évaluer la cellularité des tubes séminifères.
Il est également demandé au patient d'effectuer un certain nombre d'analyses sanguines pour vérifier la fonction hépatique et rénale ainsi que certains marqueurs tumoraux tels que l'alpha-foetoprotéine (AFP) et la bêta-gonadotrophine chorionique humaine (b-hCG).
2. Solution injectable tumescente:
Une solution tumescente contenant une solution saline, de la lidocaïne (un anesthésique local) et de l'épinéphrine (pour réduire le saignement) est injectée dans la zone ciblée. Cette solution aide à détacher les cellules graisseuses, réduit la douleur et minimise le saignement pendant l'intervention.
3. Extraction de graisse (liposuccion):
Une petite incision est pratiquée dans la peau et un canule (un tube fin et creux) est inséré. La canule est reliée à un dispositif à vide qui aspire délicatement le tissu adipeux de zones telles que l'abdomen, les cuisses ou les fesses.
4. Traitement du tissu adipeux:
La graisse extraite est recueillie dans des récipients stériles et traitée pour isoler les CSM. Le traitement comprend :
Centrifugation pour séparer la graisse des autres composants comme le sang et les liquides,
Digestion enzymatique en utilisant la collagénase pour décomposer la matrice extracellulaire et libérer les MSC.
Filtration et lavage pour purifier les MSC et éliminer les débris.
5. Réimplantation:
Les CSM sont préparées en cocktail avec du PRP et des exosomes et sont injectées directement dans les zones ciblées des testicules. L'ensemble de la procédure se déroule en quelques heures sous sédation. Ainsi, les procédures de liposuccion et de réimplantation sont réalisées en une seule fois sans nécessiter deux sédations distinctes.
Bien que la procédure soit généralement sûre, les risques incluent des ecchymoses mineures, une infection ou une gêne au niveau du site de liposuccion ou de réimplantation. Cette technique est largement utilisée en médecine régénérative en raison de la puissance élevée et de la polyvalence des cellules souches mésenchymateuses dérivées du tissu adipeux.
Durée de séjour requise à Chypre:
La majorité de nos patients viennent de l'étranger. En raison d'engagements professionnels ou personnels, les temps de trajet peuvent être limités. C'est pourquoi nous demandons que les tests préliminaires/biopsies soient effectués localement avant l'arrivée du patient afin de minimiser la durée du séjour à Chypre. Vous devrez rester à Chypre environ 3 jours pour la thérapie par cellules souches. Cela nous donnera suffisamment de temps pour effectuer les tests préopératoires nécessaires, obtenir votre échantillon de sang et effectuer la procédure. Vous devrez passer la nuit à notre hôpital pour observation et pourrez rentrer chez vous le lendemain.
À quoi s'attendre après l'intervention ? Taux de réussite :
Après l'injection de cellules souches, il faut attendre trois mois pour observer l'effet. La spermatogenèse (production et maturation des spermatozoïdes) prend environ 65 à 70 jours. Par conséquent, les cellules souches implantées auront besoin de ce délai avant que l'on puisse observer un quelconque effet.
Le succès de la procédure dépend en grande partie de la cellularité de base du tissu testiculaire au départ. Les patients qui ont déjà des spermatides à un stade précoce ou tardif dans leur tissu testiculaire (Jscore d'Ohnsen de 7 ou 8) sont le groupe de patients qui ont le plus de chances de succès avec la thérapie par cellules souches. Dans la plupart des cas, nous pouvons observer des spermatozoïdes matures dans l'éjaculat après la période de trois mois. Bien que le nombre de spermatozoïdes matures dans l'éjaculat ne soit pas suffisant pour une conception naturelle, nous planifions et exécutons souvent un cycle de FIV réussi avec ce groupe de patients. La chance d'obtenir avec succès des spermatozoïdes matures dans l'éjaculat chez ce groupe de patients est d'environ 75%.
Patients qui n'ont pas de spermatides dans les tubes séminifères (peut-être quelques-uns) mais qui ont des spermatocytes secondaires (Score de Johnsen de 5 à 6) sont également susceptibles de constater une amélioration de leur activité spermatogène pouvant aboutir à des spermatozoïdes matures pouvant pénétrer dans l'éjaculat. Cependant, dans ce groupe de patients, l'observation de spermatozoïdes matures dans l'éjaculat est moins fréquente. Notre espoir dans ce groupe de patients est de pouvoir trouver des spermatides en maturation dans une biopsie testiculaire à utiliser lors d'un cycle de FIV. Si l'analyse du sperme effectuée trois mois après la thérapie par cellules souches n'indique aucun spermatozoïde dans l'éjaculat, l'étape suivante sera d'organiser une procédure d'extraction de spermatozoïdes testiculaires afin d'obtenir des spermatozoïdes viables pouvant être utilisés pendant l'ICSI. La chance d'obtenir avec succès des spermatozoïdes matures dans l'éjaculat dans ce groupe de patients est d'environ 25%. La chance de trouver des spermatozoïdes viables soit dans l'éjaculat, soit via TESE est d'environ 40%.
Les patients qui n'ont que des spermatocytes primaires dans leurs tubes séminifères (Score de Johnsen de 4) ne sont pas susceptibles d'observer des spermatozoïdes matures dans l'éjaculat après une procédure de cellules souches. Dans la majorité des cas, nous observons une amélioration de l'activité spermatogénique dans le sens où le tissu devient plus peuplé de cellules germinales. Cependant, chez une grande majorité de patients, nous ne trouvons pas de spermatozoïdes suffisamment matures pour être utilisés pendant l'ICSI. Le succès avec ce groupe de patients peut être estimé à 15%, ce qui signifie que 15% des patients auront des spermatozoïdes suffisamment matures pour être utilisés dans un cycle de FIV.
D'après nos statistiques de patients à ce jour, les patients avec seulement des spermatogonies dans les tubes séminifères (Score de Johnsen de 3) ont probablement une chance de 6% d'avoir des spermatozoïdes suffisamment matures qui peuvent être utilisés pendant l'ICSI après la procédure de cellules souches.
Nous n'attendons pas de résultat positif dans le groupe de patients qui ont un score de Johnsen de 2 ou moins (syndrome des cellules de Sertoli uniquement ou aucune cellule).
Qu'est-ce qu'un score de Johnsen ?
Le Système de notation Johnsen est une méthode histologique utilisée pour évaluer les échantillons de biopsie testiculaire en évaluant la spermatogenèse (la production de spermatozoïdes) dans les tubes séminifères. Développé par SG Johnsen en 1970, le système attribue un score numérique à chaque tube séminifère en fonction de la présence et de la maturité des cellules germinales, ainsi que de l'état général de la spermatogenèse. Il est couramment utilisé dans l'évaluation de l'infertilité masculine.
Critères de notation
À chaque tube séminifère est attribué un score allant de 1 à 10 sur la base des critères suivants :
Note 10:Spermatogenèse complète avec de nombreux spermatozoïdes visibles.
Note 9:Spermatogenèse légèrement réduite mais avec de nombreuses spermatides à un stade tardif présentes.
Note 8:Quelques spermatides tardives, indiquant une spermatogenèse modérément altérée.
Note 7:Présence de nombreuses spermatides précoces mais pas de spermatides tardives ni de spermatozoïdes.
Note 6:Présence de quelques spermatides précoces mais pas de spermatides tardives ni de spermatozoïdes.
Note 5:De nombreux spermatocytes sont présents, mais pas de spermatides ni de spermatozoïdes.
Note 4:Peu de spermatocytes présents, mais pas de spermatides ni de spermatozoïdes.
Note 3:Spermatogonies (précurseurs des cellules germinales) présentes mais pas de spermatocytes, de spermatides ou de spermatozoïdes.
Note 2:Cellules de Sertoli uniquement sans cellules germinales présentes.
Note 1:Aucun tube séminifère présent dans la biopsie (lésions testiculaires extrêmes).
Interprétation des scores
UN score plus élevé indique une spermatogenèse normale ou presque normale.
UN score inférieur reflète une spermatogenèse altérée ou absente.
En calculant le score moyen de Johnsen sur tous les tubules examinés, nous pouvons quantifier le degré d’altération spermatogène et prendre des décisions éclairées sur les options de traitement, telles que le recours aux technologies de procréation assistée, l’utilisation de traitements par cellules souches ou l’examen des options de don.
Coût de la thérapie par cellules souches pour l'azoospermie non obstructive :
Le coût de la thérapie par cellules souches pour le traitement de l'azoospermie non obstructive est de 7 000 euros, comprenant le protocole PRP, la liposuccion et la purification des cellules souches, les exosomes et l'implantation dans le tissu testiculaire. Une nuitée à l'hôpital est également incluse dans ce devis.
N'hésitez pas à Contactez-nous pour plus d'informations.
Nouvelles avancées dans les technologies de FIV
Centre de FIV de Chypre du Nord
Le centre de FIV de Chypre du Nord est une clinique de fertilité axée sur le patient, située dans "Hôpital de recherche et de chirurgie d'élite» à Nicosie, Chypre. Notre clinique est l’une des cliniques de fertilité les plus avancées au monde, offrant une plus large sélection d’options de traitement à des prix abordables.
Nous Contacter
Téléphone
Anglais: +90 548 875 8000
Français: +90 548 876 8000
Turc: +90 542 869 8000
Arabe: +90 548 875 8000
Allemand: +90 548 830 1987
Russe: +90 548 828 9955
info@northcyprusivf.net
© 2020 LowCostIVF - Tous droits réservés. politique de confidentialité


