- À propos
- Blog
- Infertilité
- Traitements de FIV
- Nouvelles avancées FIV
- Thérapie de remplacement mitochondrial!
- Traitement de FIV à Chypre
- IUI
- Mini FIV
- FIV + ICSI
- FIV cytoplasmique
- Cycle de FIV en tandem
- Don d'ovules
- Don d'embryons
- Don de sperme
- Genre – Sélection du sexe
- GPA gestationnelle
- Gestation pour autrui gay de même sexe
- Récupération chirurgicale de sperme
- Diagnostic Génétique Pré Implantation PGD
- Congélation d'oeufs
- Sélection du sexe à l'aide d'ovules de donneur
- Prévention de la drépanocytose
- FAQ
- Voyage
- À propos
- Blog
- Infertilité
- Traitements de FIV
- Nouvelles avancées FIV
- Thérapie de remplacement mitochondrial!
- Traitement de FIV à Chypre
- IUI
- Mini FIV
- FIV + ICSI
- FIV cytoplasmique
- Cycle de FIV en tandem
- Don d'ovules
- Don d'embryons
- Don de sperme
- Genre – Sélection du sexe
- GPA gestationnelle
- Gestation pour autrui gay de même sexe
- Récupération chirurgicale de sperme
- Diagnostic Génétique Pré Implantation PGD
- Congélation d'oeufs
- Sélection du sexe à l'aide d'ovules de donneur
- Prévention de la drépanocytose
- FAQ
- Voyage
Infertilité féminine
Diagnostic et gestion
Le diagnostic de l'infertilité féminine est souvent plus complexe que celui de l'infertilité masculine. Si l'infertilité masculine peut parfois être évaluée à l'aide d'une seule analyse de sperme, l'évaluation de l'infertilité féminine nécessite généralement une série de tests et d'examens approfondis, qui peuvent ou non aboutir à un diagnostic définitif.
Les femmes fournissent non seulement l'ovule, mais aussi l'environnement nécessaire au développement de l'embryon jusqu'à ce qu'il devienne un être humain viable. Bien que l'infertilité féminine soit généralement liée à des problèmes de santé des ovules, diverses affections ovariennes et utérines peuvent également avoir un impact sur la capacité d'une femme à concevoir naturellement. Il existe des lignes directrices établies pour le diagnostic de l'infertilité féminine primaire ; cependant, toute évaluation de l'infertilité doit commencer par une anamnèse complète. Les questions suivantes peuvent aider à orienter le diagnostic et le traitement de l'infertilité féminine primaire :
⦁ Avez-vous déjà été enceinte ?
⦁ Avez-vous déjà fait une fausse couche ? Si oui, à quel moment de la grossesse la fausse couche s'est-elle produite ?
⦁ Avez-vous des antécédents familiaux d'infertilité?
⦁ Avez-vous des cycles menstruels réguliers ?
⦁ Avez-vous récemment subi un dépistage des maladies infectieuses, y compris les maladies sexuellement transmissibles ?
⦁ Possédez-vous des animaux de compagnie?
Les réponses à chacune de ces questions peuvent fournir des informations importantes au spécialiste de la fertilité. Par exemple, le fait de posséder des animaux de compagnie peut augmenter le risque pour une femme de contracter des infections pouvant entraîner une infertilité, comme la toxoplasmose. De même, des antécédents familiaux d'infertilité peuvent indiquer des causes génétiques d'infertilité. Lors de tout bilan d'infertilité, les patients ne doivent se contenter que d'un historique médical complet. Une copie de notre formulaire d'historique médical se trouve sur notre page « Contact ». Bien que le questionnaire ne soit que le début d'un bilan d'infertilité, ces questions peuvent aider à identifier les causes potentielles d'infertilité, mais l'étape suivante consiste à évaluer la physiologie reproductive du patient, homme et femme. En particulier, les tests hormonaux peuvent fournir des informations sur la fonction ovarienne d'une femme et aider à orienter le traitement.
Quelles sont les causes courantes de l’infertilité féminine ?
1- Problèmes d'ovulation
L'ovulation est une étape cruciale du cycle de reproduction féminin et est essentielle à la conception. Au cours de l'ovulation, un ovule mature est libéré par l'un des ovaires et devient disponible pour la fécondation par les spermatozoïdes. Pour la plupart des femmes, ce processus se produit une fois par cycle, généralement environ deux semaines avant le début de leurs règles. L'ovule passe par la trompe de Fallope, où il peut être fécondé, puis se déplace vers l'utérus pour l'implantation.
Lorsque l’ovulation ne se produit pas régulièrement ou pas du tout, on parle de dysfonctionnement ovulatoire. Le dysfonctionnement ovulatoire est l’une des principales causes d’infertilité féminine, représentant environ 25 à 301 cas d’infertilité. Les femmes qui rencontrent des problèmes d’ovulation peuvent avoir des cycles menstruels irréguliers, des règles absentes ou même une absence totale de menstruations (aménorrhée). Cependant, certaines femmes souffrant de dysfonctionnement ovulatoire peuvent néanmoins avoir des cycles menstruels réguliers, ce qui rend plus difficile l’identification du problème sous-jacent sans tests supplémentaires.
Types de troubles de l'ovulation
Les troubles de l'ovulation peuvent se manifester sous diverses formes, chacune ayant des causes sous-jacentes différentes. Les troubles ovulatoires les plus courants sont les suivants :
1. Anovulation:Il s'agit d'une absence totale d'ovulation, où les ovaires ne libèrent pas d'ovule pendant le cycle menstruel. L'anovulation est généralement associée à des déséquilibres hormonaux, au syndrome des ovaires polykystiques (SOPK) ou à une insuffisance ovarienne primaire (IOP).
2. Oligo-ovulation:Dans ce cas, l'ovulation se produit de manière irrégulière ou peu fréquente. Les femmes atteintes d'oligo-ovulation peuvent avoir des cycles imprévisibles ou de longs intervalles entre les règles, ce qui peut rendre difficile la planification des rapports sexuels pour la conception. L'oligo-ovulation est également souvent liée à des pathologies telles que le SOPK ou d'autres problèmes hormonaux.
3. Défaut de la phase lutéale (DPL): Cette pathologie survient lorsque la phase lutéale (la période qui suit l'ovulation) ne produit pas suffisamment de progestérone pour permettre la fécondation d'un ovule. De faibles niveaux de progestérone peuvent empêcher la muqueuse utérine de s'épaissir suffisamment, ce qui rend difficile l'implantation et le développement d'un embryon, ce qui peut entraîner une fausse couche précoce.
Causes des problèmes d’ovulation
Les troubles de l'ovulation sont principalement dus à des déséquilibres hormonaux et à des perturbations des signaux entre le cerveau et les organes reproducteurs. Les causes les plus courantes des troubles de l'ovulation sont les suivantes :
1. Syndrome des ovaires polykystiques (SOPK):Le SOPK est l'une des causes les plus fréquentes de dysfonctionnement ovulatoire, affectant environ 5 à 101 femmes en âge de procréer. Les femmes atteintes du SOPK ont généralement des taux élevés d'androgènes (hormones mâles), qui interfèrent avec l'ovulation. Le SOPK peut entraîner une anovulation, des règles irrégulières et d'autres problèmes métaboliques, tels que la résistance à l'insuline.
2. Dysfonctionnement hypothalamique:L'hypothalamus, situé dans le cerveau, régule de nombreuses fonctions corporelles, notamment la libération de l'hormone de libération des gonadotrophines (GnRH), qui signale à l'hypophyse de produire les hormones nécessaires à l'ovulation : l'hormone folliculo-stimulante (FSH) et l'hormone lutéinisante (LH). Le stress, une perte de poids extrême, un exercice physique excessif ou des troubles alimentaires peuvent perturber le fonctionnement de l'hypothalamus, entraînant une ovulation irrégulière ou absente.
3. Insuffisance ovarienne primaire (POI): Également connue sous le nom d'insuffisance ovarienne prématurée, l'IOP survient lorsque les ovaires perdent leur fonction normale avant l'âge de 40 ans. Cette condition est parfois due à des facteurs génétiques, à des troubles auto-immuns ou à certains traitements médicaux (par exemple, la chimiothérapie). L'IOP peut entraîner une diminution de la production d'œstrogènes, des cycles irréguliers et, éventuellement, l'arrêt de l'ovulation.
4. Hyperprolactinémie:Des niveaux élevés de prolactine, une hormone responsable de la production de lait, peuvent inhiber l'ovulation en perturbant l'équilibre des hormones reproductrices. Cette condition peut être causée par des médicaments, des tumeurs hypophysaires ou des problèmes de thyroïde.
5. Troubles de la thyroïde:L'hyperthyroïdie (thyroïde hyperactive) et l'hypothyroïdie (thyroïde sous-active) peuvent toutes deux perturber les cycles menstruels et ovulatoires normaux. Les hormones thyroïdiennes jouent un rôle crucial dans la régulation du système reproducteur du corps, et tout déséquilibre peut entraîner des problèmes d'ovulation.
Symptômes des problèmes d'ovulation
Les symptômes des troubles de l'ovulation peuvent varier considérablement en fonction du trouble spécifique. Les symptômes courants qui peuvent indiquer un dysfonctionnement ovulatoire comprennent :
• Cycles menstruels irréguliers (trop longs, trop courts ou imprévisibles)
• Absence de menstruation (aménorrhée)
• Saignements menstruels abondants ou très légers
• Absence de symptômes prémenstruels (sensibilité des seins, ballonnements)
• Difficulté à prédire l’ovulation (température basale corporelle irrégulière)
• Acné, excès de poils sur le visage ou le corps et prise de poids (en particulier chez les femmes atteintes du SOPK)
Ces symptômes ne confirment pas un problème d’ovulation, mais peuvent être des indicateurs qui justifient une évaluation plus approfondie par un professionnel de la santé.
Diagnostiquer les problèmes d’ovulation
Pour diagnostiquer les troubles de l'ovulation, une série d'évaluations et de tests peuvent être effectués. Ceux-ci comprennent :
1. Antécédents médicaux et examen physique:Une anamnèse médicale approfondie et un examen physique peuvent révéler des causes sous-jacentes potentielles, telles que des facteurs liés au mode de vie, des changements de poids ou des niveaux de stress qui pourraient influencer l’ovulation.
2. Suivi de l'ovulation:Les femmes peuvent être invitées à surveiller leurs cycles menstruels, leur température corporelle basale ou à utiliser des kits de prédiction de l'ovulation. Des analyses sanguines de progestérone effectuées pendant la phase lutéale peuvent confirmer si l'ovulation a eu lieu.
3. Tests hormonaux:Les analyses de sang peuvent évaluer les niveaux d’hormones clés, notamment la FSH, la LH, l’œstrogène, la prolactine, la testostérone et les hormones thyroïdiennes, pour déterminer tout déséquilibre qui pourrait avoir un impact sur l’ovulation.
4. Ultrason:Une échographie transvaginale peut aider à visualiser les ovaires et à détecter la présence de follicules, de kystes ou d'autres anomalies. Cette imagerie peut être particulièrement utile pour diagnostiquer le SOPK ou surveiller la réponse des ovaires au traitement hormonal si un traitement de fertilité est en cours.
5. Tests supplémentaires pour les affections sous-jacentes:Si les tests initiaux indiquent un problème tel qu’une IOP, un SOPK ou un trouble thyroïdien, des tests supplémentaires peuvent être effectués pour confirmer le diagnostic.
Les problèmes d’ovulation peuvent rendre la conception difficile, car une ovulation irrégulière ou absente réduit le nombre de chances de fécondation d’un ovule. Même lorsque l’ovulation se produit, des conditions telles qu’un défaut de phase lutéale ou des ovules de mauvaise qualité peuvent interférer avec l’implantation ou augmenter le risque de fausse couche. Heureusement, de nombreux troubles de l’ovulation sont traitables et les progrès de la médecine de la fertilité offrent diverses options aux femmes souffrant d’infertilité liée à l’ovulation.
2- Problèmes avec les trompes de Fallope
Les trompes de Fallope obstruées ou endommagées sont une cause importante d’infertilité féminine, car elles perturbent le trajet normal de rencontre entre l’ovule et le sperme, empêchant ainsi la fécondation. Les trompes de Fallope, qui relient les ovaires à l’utérus, jouent un rôle crucial dans le processus de reproduction. Chaque mois, après l’ovulation, un ovule est libéré par l’un des ovaires et se déplace dans la trompe de Fallope, où il peut rencontrer des spermatozoïdes et subir une fécondation. Une fois fécondé, l’embryon continue de se déplacer dans la trompe jusqu’à ce qu’il atteigne l’utérus pour l’implantation. Lorsque l’une ou les deux trompes de Fallope sont obstruées ou endommagées, ce trajet est entravé, ce qui rend la conception naturelle difficile, voire impossible.
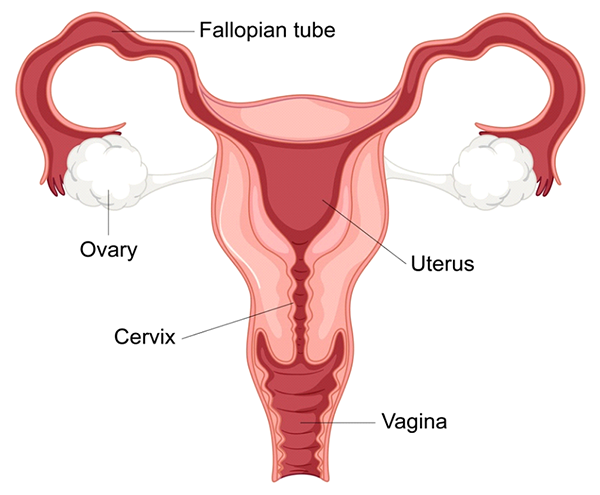
Comment les lésions des trompes de Fallope affectent la fertilité
Les lésions ou les blocages des trompes de Fallope peuvent affecter la fertilité de la manière suivante :
a) Empêcher les spermatozoïdes d'atteindre l'ovule : si les trompes de Fallope sont complètement obstruées, les spermatozoïdes ne peuvent pas atteindre l'ovule et la fécondation ne peut pas avoir lieu. Cette situation est connue sous le nom d'infertilité tubaire, qui représente environ 25 à 351 cas d'infertilité féminine.
b) Interférence avec la capture de l'ovule : les dommages aux franges (extrémités frangées des trompes de Fallope près des ovaires) peuvent empêcher la capture et l'aspiration de l'ovule dans la trompe de Fallope après l'ovulation. Sans ce processus, l'ovule ne peut pas descendre dans la trompe pour rencontrer le spermatozoïde.
c) Empêcher le transport de l'embryon : si une trompe partiellement obstruée permet la fécondation mais empêche le passage de l'ovule fécondé (embryon), cela peut entraîner une grossesse extra-utérine. Il s'agit d'une pathologie grave dans laquelle l'embryon s'implante et se développe dans la trompe de Fallope plutôt que dans l'utérus, ce qui peut entraîner des complications médicales et nécessite un traitement rapide.
d) Empêcher l'implantation dans l'utérus : même si la trompe n'est que partiellement obstruée ou endommagée, cela peut affecter le transport rapide de l'embryon vers l'utérus. Un transport embryonnaire retardé peut réduire les chances d'une implantation réussie ou augmenter le risque d'implantation dans un endroit inapproprié.
Causes des trompes de Fallope obstruées ou endommagées
1. Maladie inflammatoire pelvienne (MIP) : la MIP est une infection des organes reproducteurs féminins, souvent causée par des infections sexuellement transmissibles (IST) comme la chlamydia ou la gonorrhée. Si elles ne sont pas traitées, ces infections peuvent entraîner une inflammation et une cicatrisation des trompes de Fallope, provoquant des blocages partiels ou complets. La MIP est l'une des causes les plus courantes d'infertilité tubaire.
2. Endométriose : l'endométriose est une maladie dans laquelle des tissus semblables à la muqueuse de l'utérus se développent à l'extérieur de l'utérus, souvent sur les ovaires, les trompes de Fallope ou la muqueuse pelvienne. Les implants endométriaux situés sur ou à proximité des trompes de Fallope peuvent provoquer des adhérences, une inflammation ou des cicatrices, entraînant des blocages ou une restriction du mouvement des trompes.
3. Chirurgie des trompes : les interventions chirurgicales antérieures sur les trompes de Fallope, comme les interventions visant à réparer une grossesse tubaire, à retirer des kystes ou à traiter des infections tubaires, peuvent entraîner des cicatrices et des adhérences qui bloquent les trompes. Les femmes qui ont subi une ligature des trompes (stérilisation chirurgicale) peuvent également souffrir d'infertilité en raison d'un blocage intentionnel des trompes.
4. Adhérences dues à une chirurgie abdominale ou pelvienne : les interventions chirurgicales impliquant l'abdomen ou le bassin, comme l'appendicectomie, la césarienne ou les interventions chirurgicales pour kystes ovariens, peuvent entraîner la formation de tissu cicatriciel autour des trompes de Fallope. Ces adhérences peuvent obstruer les trompes ou restreindre leur mouvement, ce qui affecte le trajet de l'ovule vers l'utérus.
5. Hydrosalpinx : L'hydrosalpinx est une pathologie dans laquelle une ou les deux trompes de Fallope se bouchent et se remplissent de liquide. Cette pathologie est souvent le résultat d'infections, d'une salpingite pelvienne ou d'une endométriose. Le liquide contenu dans un hydrosalpinx peut être toxique pour les embryons et peut réduire le taux de réussite de la fécondation in vitro (FIV) s'il n'est pas traité.
6. Anomalies congénitales : Dans de rares cas, certaines femmes peuvent naître avec des anomalies structurelles dans leurs trompes de Fallope, ce qui peut entraîner des blocages ou des dysfonctionnements.
Diagnostic des trompes de Fallope obstruées ou endommagées
Pour diagnostiquer les blocages ou les dommages dans les trompes de Fallope, les méthodes de diagnostic suivantes sont souvent utilisées :
1. Hystérosalpingographie (HSG): L'HSG est une procédure radiographique au cours de laquelle un colorant spécial est injecté dans l'utérus et les trompes de Fallope pour évaluer leur structure. Le colorant apparaît sur les radiographies et peut révéler des blocages ou des anomalies dans les trompes.
2. Sonohystérographie:Cette procédure est similaire à l'HSG mais utilise des ultrasons au lieu des rayons X. Une solution saline est injectée dans l'utérus, ce qui permet au professionnel de la santé de visualiser les trompes de Fallope et d'évaluer d'éventuels blocages ou dommages.
3. Laparoscopie:La laparoscopie est une intervention chirurgicale mini-invasive qui consiste à insérer une petite caméra à travers une petite incision dans l'abdomen. Cette procédure permet au professionnel de la santé de visualiser directement les trompes de Fallope, d'éliminer les blocages ou les adhérences mineurs et d'évaluer l'état des organes pelviens environnants. La laparoscopie est souvent réalisée lorsque d'autres tests diagnostiques ne sont pas concluants ou lorsque des symptômes d'endométriose ou d'adhérences pelviennes sont présents.
4. Test d'anticorps contre la chlamydia:Étant donné que l'infection à chlamydia peut endommager les trompes sans symptômes évidents, ce test sanguin recherche les anticorps contre la chlamydia. Un résultat positif peut indiquer une infection antérieure qui aurait pu affecter les trompes.
La FIV est souvent recommandée aux femmes dont les trompes de Fallope sont obstruées ou gravement endommagées, car elle permet d'éviter complètement la pose de trompes. Dans le cadre de la FIV, les ovules sont prélevés dans les ovaires, fécondés avec du sperme en laboratoire et les embryons obtenus sont transférés directement dans l'utérus. La FIV est considérée comme le traitement le plus efficace de l'infertilité tubaire, en particulier dans les cas de lésions graves ou irréversibles. Les femmes dont une trompe est obstruée peuvent toujours essayer de concevoir naturellement, mais la FIV offre une alternative si les autres efforts échouent.
3- Problèmes physiques de l'utérus
Les anomalies physiques ou les problèmes structurels de l’utérus sont un autre facteur important de l’infertilité féminine. L’utérus, ou matrice, fournit l’environnement pour l’implantation de l’embryon et la croissance du fœtus en développement. Les problèmes structurels de l’utérus peuvent perturber l’implantation d’un ovule fécondé, affecter le développement de l’embryon ou augmenter le risque de fausse couche. Ces problèmes sont souvent appelés infertilité due à des facteurs utérins et peuvent avoir un impact à la fois sur la capacité de concevoir et sur la probabilité de maintenir une grossesse en bonne santé.
Types de problèmes structurels utérins et leur impact sur la fertilité
Il existe plusieurs types de problèmes physiques qui peuvent affecter l'utérus et entraîner l'infertilité. Chaque problème a des effets uniques sur la fertilité, en fonction de son emplacement, de sa gravité et de sa cause sous-jacente. Les problèmes structurels utérins les plus courants associés à l'infertilité comprennent :
1. Fibromes (léiomyomes utérins):
Les fibromes sont des tumeurs non cancéreuses constituées de tissu musculaire et fibreux qui se développent dans ou sur les parois de l'utérus. Bien que les fibromes soient assez courants, affectant jusqu'à 70 à 80 % des femmes avant l'âge de 50 ans, ils ne sont pas toujours à l'origine de la stérilité. L'impact des fibromes sur la fertilité dépend de leur taille, de leur nombre et de leur emplacement dans l'utérus. Les fibromes sous-muqueux, qui se développent dans la cavité utérine, sont plus susceptibles d'interférer avec l'implantation ou le développement de l'embryon. Les fibromes volumineux ou multiples peuvent également modifier la forme de la cavité utérine ou bloquer les trompes de Fallope, ce qui entrave encore davantage la conception. Les fibromes peuvent également augmenter le risque de fausse couche, d'accouchement prématuré et de complications pendant la grossesse, selon leur taille et leur emplacement.
2. Polypes utérins:
Les polypes utérins sont de petites tumeurs bénignes qui se forment à partir de la paroi de l'utérus (endomètre). Bien qu'ils ne soient généralement pas cancéreux, les polypes peuvent nuire à la fertilité en bloquant le passage des spermatozoïdes, en empêchant l'implantation ou en perturbant l'apport sanguin à un embryon implanté. Les polypes peuvent être particulièrement problématiques s'ils sont situés à proximité de l'endroit où un embryon s'implanterait normalement. Dans de tels cas, ils peuvent empêcher une grossesse réussie ou augmenter le risque de fausse couche précoce.
3. Anomalies utérines congénitales:
Il s'agit d'anomalies structurelles de l'utérus présentes dès la naissance, causées par des problèmes de développement dans la formation des canaux de Müller, qui donnent naissance à l'utérus, aux trompes de Fallope et à la partie supérieure du vagin. Les anomalies utérines congénitales peuvent prendre l'une des formes suivantes :
Utérus bicorne:L'utérus a une forme de cœur avec une profonde indentation au sommet, ce qui crée deux cavités. Un utérus bicorne peut augmenter le risque de fausse couche, d'accouchement prématuré et de positionnement anormal du fœtus.
Utérus cloisonné:Un septum (paroi) fibreux ou musculaire divise partiellement ou totalement la cavité utérine. Cette pathologie est associée à des taux plus élevés de fausses couches et d'échecs d'implantation, car le septum peut avoir un apport sanguin réduit, ce qui le rend moins propice à l'implantation de l'embryon.
Utérus unicorne:L'utérus n'est formé qu'à moitié, ce qui entraîne souvent une cavité utérine plus petite que d'habitude. Cela peut entraîner des difficultés à mener une grossesse à terme, avec un risque plus élevé de fausse couche et d'accouchement prématuré.
Utérus de Didelphe:Cette maladie rare, également appelée « utérus double », survient lorsque deux cavités utérines distinctes se forment. Bien que la conception soit possible, la grossesse peut être plus risquée en raison de l'espace utérin limité.
Les anomalies utérines congénitales contribuent souvent à des fausses couches récurrentes et peuvent également rendre la conception plus difficile pour les femmes, surtout si la forme de l’utérus empêche une implantation correcte.
4. Adhérences intra-utérines (syndrome d'Asherman):
Les adhérences intra-utérines sont des bandes de tissu cicatriciel qui se forment dans l'utérus, souvent à la suite d'un traumatisme de la muqueuse utérine. Elles sont généralement causées par des interventions chirurgicales utérines, telles que la dilatation et le curetage (D&C), ou par des infections. Le syndrome d'Asherman peut entraîner une obstruction partielle ou totale de la cavité utérine, ce qui peut empêcher l'implantation ou entraîner des fausses couches à répétition. Dans les cas graves, les adhérences peuvent empêcher complètement les règles (aménorrhée). Les femmes atteintes du syndrome d'Asherman peuvent avoir des règles légères ou absentes, des douleurs pelviennes et une infertilité, en particulier si les adhérences perturbent la fonction utérine normale.
5. Adénomyose:
L'adénomyose survient lorsque le tissu endométrial (la muqueuse de l'utérus) se développe dans la paroi musculaire de l'utérus. Cette affection peut provoquer un épaississement et une dilatation de l'utérus et entraîner des règles douloureuses ou abondantes, des douleurs pelviennes et une infertilité. L'adénomyose est généralement associée à des échecs d'implantation et à un risque accru de fausse couche. Bien que la cause exacte de l'infertilité dans l'adénomyose ne soit pas entièrement comprise, on pense que la croissance anormale du tissu endométrial dans la paroi musculaire perturbe le bon fonctionnement de l'utérus.
6. Problèmes endométriaux:
L'épaisseur et la qualité de la muqueuse endométriale sont essentielles à la réussite de l'implantation de l'embryon. Dans certains cas, la muqueuse endométriale des femmes peut être trop fine ou ne pas se développer correctement, souvent en raison de déséquilibres hormonaux, de certains médicaments ou d'interventions chirurgicales utérines antérieures. Un endomètre fin peut réduire la probabilité d'implantation, car il peut ne pas fournir le soutien nécessaire à l'embryon pour se fixer et se développer.
Symptômes des problèmes structurels utérins
Bien que certaines femmes souffrant de problèmes structurels utérins puissent ne présenter aucun symptôme, d’autres peuvent ressentir les symptômes suivants :
• Saignements menstruels irréguliers ou abondants (fréquents avec les fibromes, les polypes et l’adénomyose)
• Règles douloureuses ou douleurs pelviennes
• Pertes de grossesse ou fausses couches à répétition
• Difficulté à concevoir malgré une ovulation régulière et la santé du sperme
• Douleur lors des rapports sexuels
Étant donné que les symptômes peuvent être subtils ou se superposer à d’autres affections, les problèmes structurels utérins ne sont souvent diagnostiqués qu’après qu’une femme ait demandé une évaluation pour infertilité ou fausses couches à répétition.
Diagnostiquer les problèmes structurels de l'utérus
Pour diagnostiquer les problèmes structurels de l’utérus, une combinaison de tests d’imagerie et, si nécessaire, de procédures mini-invasives sont souvent utilisées.
Ultrason:L'échographie transvaginale est un outil d'imagerie de première intention pour évaluer la structure de l'utérus. Elle permet d'identifier les fibromes, les polypes, les anomalies congénitales et l'adénomyose. Dans certains cas, l'échographie 3D peut fournir une vue plus détaillée de la forme de l'utérus.
Hystérosalpingographie (HSG):Cette procédure radiographique consiste à injecter un produit de contraste dans l’utérus pour délimiter la forme de la cavité utérine et vérifier la présence de blocages ou d’adhérences dans les trompes de Fallope.
Sonohystérographie:Une solution saline est injectée dans l'utérus lors d'une échographie pour obtenir une vue plus claire de la cavité utérine. Cette technique peut aider à identifier les polypes, les fibromes et les adhérences.
Imagerie par résonance magnétique (IRM):L'IRM fournit des images haute résolution de l'utérus et est particulièrement utile pour diagnostiquer l'adénomyose, les anomalies congénitales et les fibromes utérins profonds.
Hystéroscopie:L'hystéroscopie consiste à insérer un endoscope fin et éclairé à travers le col de l'utérus pour visualiser directement l'intérieur de l'utérus. Elle permet au médecin d'inspecter visuellement la cavité utérine à la recherche de polypes, de fibromes ou d'adhérences et, si nécessaire, de les retirer ou de les traiter au cours de la même procédure.
Laparoscopie:La laparoscopie est une intervention chirurgicale mini-invasive qui permet au médecin de visualiser l'extérieur de l'utérus et les structures environnantes, telles que les trompes de Fallope et les ovaires. Elle est particulièrement utile pour identifier l'endométriose ou les adhérences pelviennes qui peuvent affecter la fertilité.
4- Problèmes au niveau du col de l'utérus
Les problèmes cervicaux peuvent avoir un impact significatif sur la fertilité d'une femme, car le col de l'utérus joue un rôle essentiel dans le trajet des spermatozoïdes vers l'ovule. Le col de l'utérus est la partie inférieure de l'utérus qui se connecte au vagin et sert de passerelle pour que les spermatozoïdes pénètrent dans l'utérus et remontent vers les trompes de Fallope, où la fécondation a généralement lieu. Les problèmes cervicaux qui interfèrent avec la fonction ou la structure du col de l'utérus peuvent empêcher les spermatozoïdes d'atteindre l'ovule, réduire la probabilité d'implantation ou augmenter le risque de fausse couche.

Types de problèmes cervicaux et leur impact sur la fertilité
Il existe plusieurs types de problèmes cervicaux qui peuvent affecter la fertilité :
1. Anomalies de la glaire cervicale:
La glaire cervicale, produite par les glandes du col de l’utérus, est essentielle pour faciliter le mouvement des spermatozoïdes. Au moment de l’ovulation, la glaire cervicale devient fine, élastique et glissante (semblable à la consistance du blanc d’œuf), ce qui facilite le passage des spermatozoïdes à travers le col de l’utérus et dans l’utérus. Lorsque la glaire cervicale est trop épaisse, peu abondante ou hostile (défavorable aux spermatozoïdes), elle peut entraver le mouvement des spermatozoïdes ou les tuer avant qu’ils n’atteignent l’ovule. Cette condition est parfois appelée « glaire cervicale hostile » et est souvent due à des déséquilibres hormonaux, à des infections, à certains médicaments ou à des problèmes de santé sous-jacents. Une glaire cervicale insuffisante ou de mauvaise qualité peut également empêcher les spermatozoïdes de survivre suffisamment longtemps pour atteindre l’ovule, réduisant ainsi la probabilité de fécondation.
2. Sténose cervicale (rétrécissement du canal cervical):
La sténose cervicale est une affection dans laquelle le canal cervical devient anormalement étroit ou fermé, ce qui rend difficile le passage des spermatozoïdes. Cette affection peut être congénitale (présente dès la naissance) ou acquise à la suite d'interventions chirurgicales, d'infections, de traumatismes ou de radiothérapie. Dans les cas graves, la sténose cervicale peut complètement obstruer le passage des spermatozoïdes, empêchant ainsi la conception naturelle. La sténose cervicale peut également entraîner des irrégularités menstruelles et des douleurs, car le sang menstruel peut avoir du mal à passer à travers le col de l'utérus rétréci. Dans les cas de sténose sévère, des techniques de procréation assistée comme l'insémination intra-utérine (IIU) ou la fécondation in vitro (FIV) peuvent être recommandées pour contourner le col de l'utérus.
3. Infections et inflammations cervicales:
Les infections du col de l’utérus, comme la cervicite (inflammation du col de l’utérus) ou les infections sexuellement transmissibles (IST) comme la chlamydia et la gonorrhée, peuvent avoir un impact sur la fertilité. L’inflammation et l’infection du col de l’utérus peuvent altérer la qualité de la glaire cervicale, la rendant moins favorable aux spermatozoïdes. Dans certains cas, les infections non traitées peuvent entraîner le développement de tissu cicatriciel, ce qui peut rétrécir le canal cervical. Les infections peuvent également se propager vers le haut, entraînant une maladie inflammatoire pelvienne (MIP), qui peut avoir un impact supplémentaire sur la fertilité en provoquant des cicatrices et des blocages dans les trompes de Fallope.
4. Insuffisance cervicale (incompétence cervicale):
L'insuffisance cervicale, également appelée incompétence cervicale, survient lorsque le col de l'utérus est trop faible pour rester fermé pendant la grossesse. Bien que cette condition n'empêche pas directement la conception, elle peut entraîner une fausse couche, en particulier au cours du deuxième trimestre, car le col de l'utérus peut commencer à se dilater prématurément. L'insuffisance cervicale peut être due à des facteurs génétiques, à des interventions chirurgicales cervicales antérieures (par exemple, une procédure LEEP ou une biopsie conique), à un traumatisme lié à l'accouchement ou à des anomalies congénitales. Les femmes atteintes de cette condition subissent souvent des fausses couches récurrentes et peuvent nécessiter des interventions médicales pour soutenir le col de l'utérus pendant la grossesse.
5. Interventions ou interventions chirurgicales cervicales antérieures:
Certaines interventions cervicales, comme la LEEP (excision électrochirurgicale à l'anse) ou la biopsie conique, sont utilisées pour retirer les cellules précancéreuses du col de l'utérus, mais peuvent parfois affecter la fertilité. Ces interventions peuvent fragiliser le col de l'utérus ou provoquer des cicatrices, ce qui peut entraîner une insuffisance cervicale ou une sténose. Si la plupart des femmes conservent leur fertilité après ces interventions, celles qui présentent des complications peuvent être confrontées à un risque plus élevé d'infertilité, de fausses couches à répétition ou d'accouchement prématuré. Dans certains cas, les cicatrices cervicales résultant de la chirurgie peuvent avoir un impact sur la production de mucus ou rendre difficile le passage des spermatozoïdes.
6. Anticorps anti-spermatozoïdes dans la glaire cervicale:
Dans de rares cas, le système immunitaire d'une femme peut produire des anticorps contre les spermatozoïdes, les considérant comme des envahisseurs étrangers. Ces anticorps peuvent être présents dans la glaire cervicale et peuvent entraver le mouvement des spermatozoïdes, les endommager ou les empêcher d'atteindre l'utérus. La présence d'anticorps anti-spermatozoïdes dans la glaire cervicale peut entraîner ce que l'on appelle une « stérilité immunologique », qui peut nécessiter des traitements spécifiques, tels que l'insémination artificielle ou la fécondation in vitro, pour contourner le col de l'utérus et améliorer les chances de fécondation.
Diagnostic des problèmes cervicaux en cas d'infertilité
Le diagnostic de l'infertilité liée au col de l'utérus implique généralement une série de tests et d'évaluations. Un examen pelvien permet au professionnel de la santé d'évaluer la taille, la forme et la position du col de l'utérus, et de vérifier toute anomalie visible ou tout signe d'inflammation. Parfois, un test post-coïtal peut être demandé si une glaire hostile est suspectée. Dans ce test, un échantillon de glaire cervicale est prélevé après un rapport sexuel pour examiner le mouvement des spermatozoïdes dans la glaire. Ce test permet d'évaluer si la glaire cervicale favorise ou inhibe le mouvement des spermatozoïdes, bien qu'il soit moins couramment utilisé aujourd'hui en raison de résultats variables.
L'HSG est une procédure radiographique qui utilise un produit de contraste pour évaluer la forme de l'utérus et la perméabilité (ouverture) du canal cervical et des trompes de Fallope. Elle permet de détecter d'éventuels blocages structurels du col de l'utérus. Des cultures cervicales peuvent être réalisées pour identifier les infections, tandis qu'une biopsie cervicale peut évaluer la présence de cellules anormales ou précancéreuses. Ces tests peuvent aider à identifier les infections ou les cicatrices qui peuvent avoir un impact sur la fertilité.
L'échographie peut être utilisée pour évaluer la structure et la longueur du col de l'utérus, en particulier dans les cas où une insuffisance cervicale est suspectée. L'échographie transvaginale est souvent utilisée pour surveiller la longueur du col de l'utérus pendant la grossesse chez les femmes ayant des antécédents d'insuffisance cervicale.
5- Âge
L'âge est l'un des facteurs les plus importants qui affectent la fertilité féminine. À mesure qu'une femme vieillit, sa fertilité diminue naturellement en raison des changements dans la quantité et la qualité de ses ovules, ainsi que des altérations de son système reproducteur qui ont un impact sur la conception et la grossesse. Le déclin de la fertilité commence généralement entre la fin de la vingtaine et le début de la trentaine et s'accélère considérablement après l'âge de 35 ans. Lorsqu'une femme atteint la quarantaine, la probabilité de concevoir naturellement diminue considérablement et le risque de complications augmente. Les changements suivants se produisent à mesure que l'âge d'une femme augmente :
1. Diminution de la quantité d'ovules (réserve ovarienne)
Les femmes naissent avec tous les ovules qu'elles auront jamais, environ 1 à 2 millions au moment de la naissance. À la puberté, ce nombre a déjà diminué pour atteindre environ 300 000 à 400 000, et à chaque cycle menstruel, davantage d'ovules sont épuisés. À la fin de la trentaine, le nombre d'ovules restants (connu sous le nom de réserve ovarienne) diminue rapidement. À l'approche de la ménopause, généralement vers le début de la cinquantaine, il reste très peu, voire aucun, d'ovules viables. La diminution de la réserve ovarienne affecte la capacité d'une femme à concevoir, car moins d'ovules signifie moins de possibilités de fécondation. La réduction de la réserve ovarienne limite également l'efficacité des traitements de fertilité comme la fécondation in vitro (FIV) car les ovaires peuvent ne pas produire suffisamment d'ovules en réponse à la stimulation.
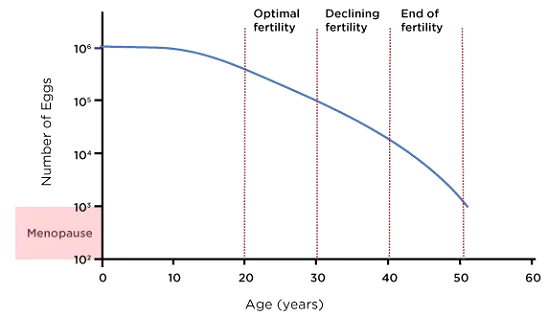
2. Baisse de la qualité des œufs
Non seulement la quantité d’ovules diminue avec l’âge, mais leur qualité aussi. La qualité des ovules fait référence à l’intégrité génétique et chromosomique d’un ovule. À mesure que les femmes vieillissent, les ovules sont plus susceptibles d’accumuler des anomalies chromosomiques, ce qui augmente la probabilité de troubles génétiques, comme le syndrome de Down, et réduit les chances de conception réussie. Les anomalies chromosomiques augmentent également le risque de fausse couche, en particulier chez les femmes de plus de 35 ans. Des études montrent que le taux de fausse couche chez les femmes au début de la vingtaine est d’environ 10-15%, mais ce taux monte à environ 35% chez les femmes au début de la quarantaine.
Non seulement les problèmes génétiques sont fréquents dans l’ovocyte chez les personnes âgées, mais les organites cytoplasmiques perdent également leur fonction avec l’âge. La fonction mitochondriale est particulièrement vitale pour la croissance et le développement cellulaires et les mitochondries vieillissantes peuvent ne pas assurer l’équilibre nécessaire entre la production d’énergie et les dommages oxydatifs à l’intérieur des ovocytes. Certains traitements de nouvelle génération tels que la « thérapie de remplacement mitochondrial » peuvent être utiles dans les cas où le vieillissement des ovocytes est une préoccupation lors des traitements de fertilité. La baisse de la qualité des ovules est une raison importante pour laquelle les taux de grossesse et de naissances vivantes diminuent avec l’âge, même avec l’utilisation de traitements de fertilité.
3. Risque accru de problèmes de santé reproductive
En vieillissant, les femmes sont plus susceptibles de développer des problèmes de santé pouvant avoir un impact sur la fertilité, notamment l’endométriose, les fibromes utérins et les complications chroniques de la maladie inflammatoire pelvienne. Ces problèmes de santé affectent non seulement les chances de conception, mais peuvent également augmenter le risque de complications liées à la grossesse et de fausse couche.
4. Réceptivité utérine réduite
Avec l’âge, l’utérus peut également subir des changements qui ont un impact sur sa capacité à soutenir une grossesse. La muqueuse endométriale, qui s’épaissit à chaque cycle pour se préparer à un éventuel embryon, peut ne pas se développer de manière aussi optimale qu’auparavant. Ce changement peut réduire les chances d’une implantation réussie, même si un embryon sain est présent. Le système vasculaire de l’utérus peut également être affecté par l’âge, réduisant le flux sanguin vers la muqueuse endométriale. Un flux sanguin adéquat est essentiel pour un utérus réceptif qui peut soutenir un embryon, donc un flux sanguin diminué peut réduire la fertilité et augmenter le risque de fausse couche précoce.
5. Risque accru de complications liées à la grossesse
Les femmes plus âgées qui conçoivent naturellement ou avec l'aide d'une assistance médicale courent un risque plus élevé de complications liées à la grossesse. Ces complications comprennent :
Diabète gestationnel : les femmes de plus de 35 ans présentent un risque accru de développer un diabète gestationnel, ce qui peut avoir un impact sur la santé maternelle et fœtale.
Hypertension et prééclampsie : l’hypertension artérielle et la prééclampsie (une complication de la grossesse potentiellement dangereuse caractérisée par une hypertension artérielle) sont plus fréquentes chez les mères plus âgées.
Placenta praevia : les femmes de plus de 35 ans présentent un risque accru de placenta praevia, une affection dans laquelle le placenta recouvre le col de l’utérus, ce qui peut entraîner des complications lors de l’accouchement.
Accouchement prématuré : les femmes de plus de 35 ans présentent un risque plus élevé d’accoucher prématurément, ce qui peut avoir un impact sur la santé du bébé.
Ces complications de grossesse, bien que n'ayant pas d'impact direct sur la capacité de concevoir, soulignent les risques sanitaires supplémentaires auxquels sont confrontées les femmes qui tentent de concevoir à un âge plus avancé. L'âge affecte non seulement la conception naturelle, mais aussi les taux de réussite des techniques de procréation assistée comme la FIV. Les femmes de moins de 35 ans ont généralement des taux de réussite plus élevés avec la FIV que les femmes de plus de 40 ans. À 43 ans, le taux de réussite de la FIV avec les propres ovules de la femme chute considérablement, en grande partie en raison de la diminution de la quantité et de la qualité des ovules. Pour augmenter leurs chances, certaines femmes plus âgées choisissent d'utiliser les ovules d'une donneuse plus jeune, ce qui améliore considérablement les taux de réussite car les ovules de la donneuse sont généralement de meilleure qualité. Cependant, le processus de don d'ovules est coûteux et nécessite une réflexion et une préparation minutieuses.
Options de préservation de la fertilité : congélation des ovules et des embryons
Avec la baisse de fertilité associée à l’âge, certaines femmes choisissent de préserver leur fertilité par la congélation d’ovules ou d’embryons (cryoconservation) lorsqu’elles sont plus jeunes, surtout si elles envisagent de retarder une grossesse.
Congélation des ovules : ce procédé consiste à stimuler les ovaires pour produire plusieurs ovules, qui sont ensuite récupérés et congelés pour une utilisation ultérieure. La congélation des ovules peut permettre aux femmes d'utiliser des ovules plus jeunes et plus sains lorsqu'elles sont prêtes à concevoir, augmentant ainsi leurs chances de réussir leur grossesse plus tard dans la vie.
Congélation d'embryons : Similaire à la congélation d'ovules, ce procédé consiste à fertiliser les ovules récupérés avec du sperme avant de les congeler. Cette option est souvent choisie par les femmes engagées dans une relation et souhaitant disposer d'embryons prêts à être implantés ultérieurement.
Ces techniques offrent des options aux femmes qui souhaitent retarder la grossesse tout en préservant la qualité de leurs ovules ou de leurs embryons. Bien que l’âge soit un facteur majeur de fertilité, les avancées médicales telles que la procréation assistée, la congélation des ovules et des embryons offrent des options pour aider les femmes à concevoir plus tard dans la vie. Comprendre les effets de l’âge sur la fertilité peut aider les femmes à faire des choix éclairés en matière de procréation et à demander de l’aide tôt si elles prévoient de concevoir à un âge plus avancé.
6- Problèmes du système immunitaire
Les problèmes immunitaires peuvent avoir un impact significatif sur la fertilité des femmes, entraînant souvent une stérilité inexpliquée, des fausses couches à répétition ou des complications pendant la grossesse. Le système immunitaire est conçu pour protéger le corps des infections et des envahisseurs étrangers, mais dans certains cas, les réponses immunitaires peuvent interférer avec la fertilité en ciblant les cellules reproductrices, les tissus ou même l'embryon. Ces problèmes de fertilité liés au système immunitaire peuvent résulter de maladies auto-immunes, de réponses immunitaires aux spermatozoïdes ou aux embryons, ou d'une activation anormale du système immunitaire.
1. Maladies auto-immunes et infertilité
Dans les maladies auto-immunes, le système immunitaire attaque par erreur les propres tissus de l'organisme comme s'il s'agissait d'envahisseurs étrangers. Plusieurs maladies auto-immunes sont associées à l'infertilité :
Lupus érythémateux disséminé (LED) : le lupus est une maladie auto-immune qui peut provoquer une inflammation dans tout le corps, y compris dans les organes reproducteurs. Les femmes atteintes de lupus peuvent souffrir d'irrégularités menstruelles, de fausses couches à répétition ou d'accouchements prématurés en raison des attaques du système immunitaire sur l'utérus ou le placenta.
Syndrome des antiphospholipides (APS) : le SAPL est une maladie auto-immune dans laquelle le système immunitaire produit des anticorps contre les phospholipides, des molécules présentes dans les membranes cellulaires, et il est souvent associé à des fausses couches à répétition. Ces anticorps antiphospholipides peuvent entraîner la formation de caillots sanguins dans le placenta, interrompant l'apport sanguin au fœtus et provoquant une fausse couche. Le SAPL est également lié à d'autres complications, telles que la prééclampsie et l'accouchement prématuré.
Thyroïdite de Hashimoto et maladie de Graves : toutes deux sont des maladies thyroïdiennes auto-immunes dans lesquelles le système immunitaire attaque la glande thyroïde, réduisant (maladie de Hashimoto) ou augmentant (maladie de Graves) la production d'hormones thyroïdiennes. Les hormones thyroïdiennes jouent un rôle essentiel dans la régulation du cycle menstruel et le soutien de la grossesse. Les femmes atteintes de troubles thyroïdiens souffrent souvent d'irrégularités menstruelles, de problèmes d'ovulation et d'un risque plus élevé de fausse couche.
Polyarthrite rhumatoïde (PR) et autres maladies auto-immunes : la PR et les maladies auto-immunes similaires peuvent créer des états inflammatoires qui interfèrent avec l'ovulation, l'implantation de l'embryon et le maintien de la grossesse. De plus, certains médicaments utilisés pour traiter les maladies auto-immunes peuvent avoir un effet négatif sur la fertilité.
2. Anticorps anti-spermatozoïdes
Dans certains cas, le système immunitaire d'une femme peut produire des anticorps qui ciblent spécifiquement les spermatozoïdes. Cette réponse peut se produire si les spermatozoïdes sont exposés au système immunitaire à la suite d'un traumatisme, d'une infection ou d'une intervention chirurgicale. Les anticorps peuvent altérer la motilité des spermatozoïdes (rendant la nage difficile pour les spermatozoïdes), se lier à la surface des spermatozoïdes ou même les détruire complètement, empêchant ainsi la fécondation. Les anticorps anti-spermatozoïdes se trouvent généralement dans la glaire cervicale, mais ils peuvent également être présents dans d'autres zones du système reproducteur. Les femmes présentant des anticorps anti-spermatozoïdes peuvent nécessiter des traitements comme l'insémination intra-utérine (IIU) ou la fécondation in vitro (FIV) pour contourner la glaire cervicale et améliorer les chances de conception.
3. Anticorps anti-ovariens
Les anticorps anti-ovariens sont des anticorps qui attaquent le tissu ovarien, ciblant des composants comme les ovules, les récepteurs de l'hormone folliculo-stimulante (FSH) ou les structures qui soutiennent le développement de l'ovule. Cette réponse immunitaire peut interférer avec la fonction ovarienne, réduire la qualité de l'ovule et entraîner un vieillissement ou une insuffisance ovarienne précoce (connue sous le nom d'insuffisance ovarienne primaire ou IOP). Les femmes ayant des anticorps anti-ovariens peuvent connaître des cycles menstruels irréguliers, une anovulation (absence d'ovulation) ou une diminution de la réserve ovarienne, qui peuvent tous réduire la fertilité et rendre la conception plus difficile. L'insuffisance ovarienne auto-immune est parfois liée à d'autres maladies auto-immunes, telles que la maladie d'Addison, le lupus ou les troubles thyroïdiens.
4. Endométriose et inflammation
L’endométriose est une maladie dans laquelle un tissu semblable à la muqueuse utérine (endomètre) se développe à l’extérieur de l’utérus, souvent sur les ovaires, les trompes de Fallope et d’autres organes pelviens. Bien que l’endométriose ne soit pas à proprement parler une maladie auto-immune, on a découvert qu’elle impliquait un dysfonctionnement du système immunitaire et une inflammation chronique. Chez les femmes atteintes d’endométriose, le système immunitaire ne parvient pas à éliminer le tissu endométrial déplacé, ce qui entraîne une inflammation persistante. Cet environnement inflammatoire peut interférer avec la qualité des ovules, perturber l’ovulation et créer des adhérences (tissu cicatriciel) qui bloquent ou endommagent les trompes de Fallope. L’inflammation et l’activité immunitaire associées à l’endométriose peuvent également créer un environnement hostile pour les spermatozoïdes, les ovules et les embryons, ce qui rend plus difficile la réussite d’une grossesse.
5. Cellules tueuses naturelles (NK) et échec d'implantation
Les cellules tueuses naturelles (NK) sont des cellules immunitaires qui jouent un rôle essentiel dans les mécanismes de défense de l'organisme, notamment dans la régulation des réponses immunitaires dans l'utérus. Lors d'une grossesse normale, les cellules NK utérines contribuent à l'implantation en favorisant le flux sanguin vers l'embryon en développement. Cependant, certaines femmes peuvent avoir des taux élevés de cellules NK ou des cellules NK anormalement activées qui ciblent et attaquent l'embryon, entraînant un échec d'implantation ou une fausse couche précoce. Une activité élevée des cellules NK est associée à des fausses couches récurrentes et peut contribuer à une stérilité inexpliquée. Le test de l'activité des cellules NK est controversé, car tous les chercheurs ne s'accordent pas sur son impact sur la fertilité, mais certains spécialistes de la fertilité peuvent proposer des traitements immunomodulateurs, tels que les stéroïdes ou l'immunoglobuline intraveineuse (IVIG), pour réduire l'activité des cellules NK et améliorer le succès de l'implantation.
6. Déséquilibre des cytokines et réponse inflammatoire
Les cytokines sont de petites protéines produites par les cellules immunitaires qui jouent un rôle dans la signalisation cellulaire et la régulation immunitaire. Au début de la grossesse, un environnement cytokinique équilibré est nécessaire pour favoriser l’implantation de l’embryon et le développement précoce du fœtus. Cependant, un déséquilibre des cytokines, en particulier une augmentation des cytokines pro-inflammatoires, peut perturber ce processus. Chez les femmes atteintes d’infertilité d’origine immunitaire, des niveaux élevés de cytokines inflammatoires peuvent créer un environnement utérin défavorable, réduisant les chances d’implantation de l’embryon ou augmentant le risque de fausse couche. Des maladies telles que les maladies auto-immunes, les infections ou l’inflammation chronique peuvent entraîner un déséquilibre des cytokines, ce qui peut contribuer à l’infertilité ou à des fausses couches à répétition.
7. Réponse immunitaire au placenta
Le placenta, qui nourrit le fœtus en développement, est essentiel au bon déroulement de la grossesse. Au cours d’une grossesse normale, le système immunitaire maternel tolère le placenta, qui contient le matériel génétique de la mère et du père. Cependant, chez certaines femmes, le système immunitaire peut considérer le placenta comme un corps étranger et déclencher une réponse immunitaire contre lui. Cette réponse immunitaire peut restreindre le flux sanguin vers le placenta, augmentant ainsi le risque de fausse couche, de prééclampsie, de retard de croissance intra-utérin et d’autres complications de la grossesse. Des pathologies comme le SAPL (syndrome des antiphospholipides) sont des exemples classiques de cas où les réponses immunitaires peuvent interférer avec la fonction placentaire, entraînant une fausse couche.
8. Dysfonctionnement de l'implantation immunologique
Certaines femmes atteintes d'une infertilité inexpliquée peuvent souffrir de ce que l'on appelle un dysfonctionnement d'implantation immunologique. Ce terme fait référence à une réponse immunitaire hyperactive ou inappropriée qui empêche un embryon de s'implanter avec succès dans l'utérus, même si l'embryon et la muqueuse utérine sont sains. Le dysfonctionnement d'implantation immunologique fait encore l'objet de recherches, mais on pense qu'il implique une activité anormale des cellules immunitaires, notamment les cellules NK, les cellules T et les macrophages, ou un déséquilibre des facteurs immunomodulateurs dans l'utérus. Les options de traitement sont encore en cours de développement, mais certains spécialistes de la fertilité peuvent utiliser des corticostéroïdes, des IgIV ou d'autres thérapies immunomodulatrices pour tenter d'améliorer le succès de l'implantation.
Tests diagnostiques pour l'infertilité d'origine immunitaire
Le dépistage de l’infertilité d’origine immunitaire peut impliquer plusieurs approches, en fonction du problème immunitaire suspecté :
Analyses sanguines : Les analyses sanguines peuvent détecter des anticorps spécifiques (par exemple, des anticorps anti-spermatozoïdes, des anticorps anti-ovariens, des anticorps antiphospholipides) et mesurer les niveaux ou l’activité des cellules immunitaires.
Dosages des cellules NK:Ces tests évaluent les niveaux et l’activité des cellules tueuses naturelles dans le sang ou l’utérus, bien que leur utilité clinique soit encore débattue.
Test du profil des cytokines:Ce test mesure les niveaux de cytokines pro-inflammatoires et anti-inflammatoires pour évaluer l’équilibre immunitaire, en particulier chez les femmes souffrant de fausses couches à répétition.
Hystéroscopie ou biopsie:Une hystéroscopie (visualisation de l’utérus avec une caméra) ou une biopsie de l’endomètre peut être réalisée pour évaluer l’inflammation ou l’activité immunitaire directement dans l’utérus.
Options de traitement pour l’infertilité d’origine immunitaire
Les traitements contre l’infertilité d’origine immunitaire visent à traiter le problème immunitaire spécifique et à améliorer les chances d’une grossesse réussie :
Médicaments immunomodulateurs :
• Corticostéroïdes:Des stéroïdes à faible dose comme la prednisone peuvent être utilisés pour réduire l’activité immunitaire et l’inflammation, en particulier dans les cas d’élévation des cellules NK ou d’échec d’implantation lié au système immunitaire.
• Immunoglobuline intraveineuse (IVIG):L'IVIG est utilisée dans certains cas pour supprimer les réponses immunitaires anormales, en particulier chez les femmes présentant des fausses couches à répétition ou une élévation des cellules NK, bien que son utilisation soit encore expérimentale.
• Héparine de bas poids moléculaire (HBPM) et aspirine:En cas de SAPL ou de troubles de la coagulation, les médicaments anticoagulants comme l’héparine et l’aspirine peuvent réduire le risque de caillots sanguins, favorisant ainsi la santé placentaire et réduisant le risque de fausse couche.
Antibiotiques contre les infections : Dans les cas de cervicite ou d’infections de faible intensité, les antibiotiques peuvent réduire l’inflammation du système reproducteur, améliorant potentiellement la fertilité.
Techniques de procréation assistée (PMA):
Dans les cas où des problèmes immunitaires ont un impact sur la conception naturelle, les options de procréation assistée telles que la FIV peuvent contourner certaines barrières immunitaires en permettant à la fécondation de se produire à l'extérieur du corps. Des techniques telles que l'injection intracytoplasmique de spermatozoïdes (ICSI) peuvent être utilisées en cas d'anticorps anti-spermatozoïdes, et le transfert d'embryons peut contourner la glaire cervicale hostile ou les réponses immunitaires anormales au niveau du col de l'utérus.
7- Défauts de thrombophilie
La thrombophilie, une maladie caractérisée par une tendance accrue à la formation de caillots sanguins, peut avoir un impact significatif sur la fertilité féminine, notamment en affectant l'implantation et en augmentant le risque de complications liées à la grossesse. La thrombophilie peut être héréditaire (génétique) ou acquise, et elle implique souvent des anomalies dans les mécanismes de coagulation du sang. Bien que la thrombophilie en elle-même n'empêche pas directement la conception, elle peut créer un environnement qui rend difficile la progression d'une grossesse, entraînant des fausses couches à répétition, des complications pendant la grossesse et, dans certains cas, des problèmes d'implantation.
Types de thrombophilie et leur impact sur la fertilité
La thrombophilie peut résulter de mutations génétiques ou de maladies acquises qui affectent la coagulation sanguine. Les types courants de thrombophilie associés à l'infertilité et à la fausse couche comprennent :
Thrombophilies héréditaires :
un) Mutation du facteur V de Leiden:Cette mutation rend le sang plus susceptible à la coagulation en altérant la fonction du facteur de coagulation V, une protéine présente dans le sang. Les femmes porteuses de cette mutation ont une
b) Mutation du gène de la prothrombine (G20210A):Cette mutation augmente les niveaux de prothrombine, une autre protéine de coagulation, entraînant un risque plus élevé de caillots sanguins et de fausses couches associées.
c) Déficits en protéine C, en protéine S et en antithrombine:Il s'agit de maladies héréditaires rares qui réduisent la capacité de l'organisme à réguler la coagulation. Les carences en ces protéines augmentent le risque de caillots sanguins anormaux et de complications pendant la grossesse.
Thrombophilie acquise :
un) Syndrome des antiphospholipides (APS):Le SAPL est une maladie auto-immune dans laquelle le système immunitaire produit des anticorps contre les phospholipides, qui sont des molécules présentes dans les membranes cellulaires. Le SAPL est fortement associé à l'infertilité et aux fausses couches à répétition, car les anticorps entraînent la formation de caillots sanguins dans le placenta, réduisant ainsi le flux sanguin vers le fœtus et entraînant une fausse couche.
b) Hyperhomocystéinémie:Des taux élevés d'homocystéine (un acide aminé) dans le sang peuvent augmenter le risque de caillots sanguins et sont associés à des fausses couches et à des problèmes placentaires. L'hyperhomocystéinémie est parfois liée à des mutations du gène MTHFR.
Comment la thrombophilie affecte l'implantation et la grossesse précoce
La coagulation sanguine joue un rôle essentiel en début de grossesse, notamment dans la formation du placenta, qui soutient l'embryon. La thrombophilie peut interférer avec ces processus de plusieurs façons.
La thrombophilie peut entraîner la formation de microcaillots dans les vaisseaux sanguins de l'utérus et du placenta. Ces caillots peuvent restreindre le flux sanguin vers l'endomètre (muqueuse utérine) et le placenta en développement, privant ainsi l'embryon de nutriments et d'oxygène essentiels. Au début de la grossesse, un flux sanguin insuffisant peut empêcher une implantation correcte et entraîner une fausse couche précoce.
L'implantation, où l'embryon se fixe à la paroi endométriale, nécessite un apport sanguin sain et des vaisseaux sanguins qui fonctionnent bien. Si la coagulation perturbe le flux sanguin vers l'utérus, elle peut créer un environnement inhospitalier pour l'embryon, réduisant ainsi les chances de réussite de l'implantation. Les femmes atteintes de thrombophilie peuvent souffrir d'une stérilité inexpliquée en raison d'échecs répétés d'implantation, même si la fécondation a lieu.
La thrombophilie est un facteur de risque bien connu de fausses couches à répétition, définies comme deux fausses couches consécutives ou plus. Les caillots sanguins qui se forment dans les vaisseaux sanguins placentaires peuvent entraîner une insuffisance placentaire, où le placenta ne peut pas soutenir correctement l'embryon ou le fœtus en développement. Cela peut entraîner :
Perte de grossesse précoce:De nombreuses femmes atteintes de thrombophilie font une fausse couche au cours du premier trimestre, car des caillots sanguins se forment dans les minuscules vaisseaux sanguins du placenta, coupant l’apport sanguin à l’embryon.
Perte de grossesse au deuxième trimestre:La thrombophilie peut également entraîner une fausse couche au cours du deuxième trimestre en raison d’un mauvais développement du placenta et d’un mauvais flux sanguin, ce qui peut entraîner un retard de croissance fœtale ou un décollement placentaire (où le placenta se détache de la paroi utérine).
Mortinatalité:Dans de rares cas, la thrombophilie peut contribuer à la mortinatalité si le flux sanguin vers le fœtus est sévèrement restreint dans les derniers stades de la grossesse.
Tests diagnostiques pour la thrombophilie en cas d'infertilité
Les femmes qui subissent des fausses couches à répétition, une stérilité inexpliquée ou des complications liées à la grossesse peuvent être soumises à des tests de thrombophilie. Les tests courants comprennent :
• Tests de coagulation sanguine:Ces tests mesurent les niveaux de facteurs de coagulation et de protéines dans le sang, tels que le facteur V Leiden, la prothrombine, la protéine C, la protéine S et l'antithrombine.
• Test d'anticorps antiphospholipides:Ce test vérifie la présence d'anticorps antiphospholipides, qui sont associés au SAPL. Les tests peuvent inclure des anticorps anticardiolipine, des anticoagulants lupiques et des anticorps anti-bêta-2 glycoprotéine I.
• Taux d'homocystéine:Des taux élevés d'homocystéine sont associés à des troubles de la coagulation et peuvent indiquer une mutation génétique sous-jacente, telle qu'une mutation MTHFR.
Avec une prise en charge adéquate, notamment un traitement anticoagulant et une surveillance étroite, de nombreuses femmes atteintes de thrombophilie peuvent concevoir et mener à terme une grossesse en bonne santé. Un diagnostic et un traitement précoces sont essentiels pour réduire les risques associés à la thrombophilie et améliorer les résultats en matière de fertilité.
8- Facteurs liés au mode de vie et expositions environnementales
Les facteurs liés au mode de vie ont un impact significatif sur la fertilité féminine en influençant l’ovulation, la qualité des ovules, les niveaux d’hormones et la santé reproductive globale. Plusieurs facteurs clés liés au mode de vie peuvent affecter la fertilité, notamment l’alimentation, le poids, l’activité physique, le niveau de stress, le tabagisme, la consommation d’alcool et l’exposition aux toxines environnementales.
1. Alimentation et nutrition
Une alimentation équilibrée qui apporte des nutriments essentiels est essentielle à la santé reproductive. Des nutriments, vitamines et minéraux spécifiques favorisent l'ovulation, la production d'hormones et la qualité des ovules. Une mauvaise alimentation ou des carences spécifiques peuvent perturber ces processus, affectant la fertilité :
Antioxydants : Les aliments riches en antioxydants (tels que les vitamines C et E, l’acide folique et le bêta-carotène) aident à protéger les œufs du stress oxydatif, qui peut nuire à la qualité des œufs.
Acide folique : cette vitamine B est essentielle à la synthèse de l’ADN et à la division cellulaire, ce qui la rend essentielle à la qualité des ovules et au développement des embryons.
Fer : Une carence en fer peut entraîner des problèmes ovulatoires, car le fer est essentiel à la production de sang et au transport de l’oxygène.
Les graisses saines : les acides gras oméga-3, présents dans le poisson, les graines de lin et les noix, aident à réduire l’inflammation et à soutenir la production d’hormones. Les gras trans, que l’on trouve couramment dans les aliments transformés, peuvent avoir un effet négatif sur l’ovulation et doivent être évités.
Teneur élevée en sucre et aliments transformés : les régimes riches en sucre et en aliments transformés peuvent entraîner une résistance à l’insuline et des déséquilibres hormonaux, ce qui peut avoir un impact sur l’ovulation.
Une alimentation saine et riche en nutriments favorise des cycles menstruels réguliers, améliore la qualité des ovules et favorise un environnement favorable à la conception.
2. Poids corporel et fertilité
Le poids corporel a un effet significatif sur la fertilité. Le surpoids ou l'insuffisance pondérale peuvent tous deux entraîner des déséquilibres hormonaux qui perturbent l'ovulation et la régularité menstruelle :
Insuffisance pondérale : les femmes ayant un indice de masse corporelle (IMC) très faible peuvent avoir des règles irrégulières ou absentes (aménorrhée) en raison de faibles niveaux d’œstrogènes. L’œstrogène est essentiel à l’ovulation et au maintien d’un cycle menstruel sain, et une insuffisance de graisse corporelle peut altérer sa production.
Surpoids/obésité : l’excès de poids, notamment au niveau de l’abdomen, est lié à des déséquilibres hormonaux et à des pathologies comme le syndrome des ovaires polykystiques (SOPK), qui peuvent entraver l’ovulation. L’obésité peut entraîner une résistance à l’insuline, des taux d’androgènes élevés et une fertilité réduite. Des études suggèrent que même une perte de poids peut améliorer l’ovulation et augmenter la probabilité de conception.
Maintenir un poids santé est l’un des moyens les plus efficaces d’optimiser la fertilité et d’améliorer les résultats de la reproduction.
3. Activité physique
L'activité physique régulière favorise la santé générale, la régulation hormonale et la gestion du poids. Cependant, l'impact de l'exercice sur la fertilité peut dépendre de son intensité :
• Exercice modéré : une activité physique modérée et régulière peut améliorer la fertilité en régulant le poids, en réduisant le stress et en améliorant le flux sanguin vers les organes reproducteurs. Elle est généralement recommandée aux femmes qui tentent de concevoir.
• Exercice excessif : L’exercice physique intensif à fort impact peut entraîner des déséquilibres hormonaux, en particulier chez les femmes ayant une faible masse grasse. L’exercice excessif peut entraîner une diminution des niveaux d’œstrogène, perturber les cycles menstruels et, dans les cas graves, entraîner une aménorrhée hypothalamique (absence de règles en raison d’une production hormonale insuffisante).
Équilibrer les niveaux d’activité physique est essentiel pour soutenir la santé reproductive, en mettant l’accent sur des routines d’exercice modérées et cohérentes.
4. Stress et bien-être émotionnel
Le stress chronique peut avoir un effet négatif sur la fertilité en perturbant l’équilibre hormonal et l’ovulation. Des niveaux élevés de stress augmentent la production de cortisol, une hormone qui peut interférer avec les hormones reproductrices comme la GnRH (hormone de libération des gonadotrophines), qui régule l’ovulation. Le stress est également associé à des comportements d’adaptation malsains, comme une mauvaise alimentation, le manque de sommeil et l’inactivité physique, qui peuvent avoir un impact supplémentaire sur la fertilité. De plus, le bilan émotionnel du stress peut rendre la conception plus difficile et peut même contribuer à un cycle de stress et d’infertilité. Les pratiques de pleine conscience, le conseil et les techniques de gestion du stress telles que le yoga, la méditation ou la thérapie peuvent être bénéfiques pour les femmes qui essaient de concevoir.
5. Fumeur
Le tabagisme est l’un des facteurs de style de vie les plus nocifs pour la fertilité. Le tabac contient des substances chimiques toxiques, telles que la nicotine, le monoxyde de carbone et le goudron, qui peuvent avoir un impact sur la santé reproductive de plusieurs façons :
• Qualité des ovules : Le tabagisme accélère la perte des ovules et nuit à leur qualité, entraînant un risque plus élevé d’anomalies chromosomiques.
• Ovulation : les fumeuses sont plus susceptibles de connaître des problèmes ovulatoires, ce qui rend la conception plus difficile.
• Santé utérine : Le tabagisme affecte le flux sanguin vers l’utérus, créant potentiellement un environnement défavorable à l’implantation de l’embryon.
• Ménopause précoce : les femmes qui fument atteignent souvent la ménopause 1 à 4 ans plus tôt que les non-fumeuses, réduisant ainsi leur période fertile.
L’exposition à la fumée secondaire peut également avoir un impact sur la fertilité. Arrêter de fumer est l’un des changements les plus bénéfiques qu’une femme puisse faire pour améliorer ses chances de concevoir.
6. Consommation d'alcool
Une consommation excessive d’alcool peut nuire à la fertilité et à l’issue de la grossesse :
• Ovulation et déséquilibres hormonaux : Une consommation excessive d’alcool peut interférer avec la production d’hormones nécessaires à l’ovulation et à la régularité menstruelle, augmentant ainsi le risque d’infertilité.
• Taux de fertilité réduits : des études suggèrent que les femmes qui consomment des niveaux élevés d’alcool peuvent connaître des taux de fertilité réduits par rapport aux buveuses modérées ou non-buveuses.
• Risques pendant la grossesse : La consommation d’alcool peut affecter le début de la grossesse, augmentant le risque de fausse couche et de problèmes de développement du fœtus.
Bien qu’une consommation modérée d’alcool puisse avoir des effets minimes, il est généralement recommandé aux femmes essayant de concevoir de s’abstenir ou de réduire leur consommation d’alcool.
7. Consommation de caféine
Bien qu'une consommation modérée de caféine (par exemple, jusqu'à 200 mg par jour, soit environ un café de 12 onces) soit généralement considérée comme sûre, une consommation élevée de caféine peut avoir un impact négatif sur la fertilité :
• Conception retardée : Certaines études ont montré qu’une consommation élevée de caféine peut être associée à un retard de conception ou à un risque accru de fausse couche.
• Absorption réduite de certains nutriments : une consommation excessive de caféine peut interférer avec l’absorption de nutriments essentiels comme le calcium et le fer, qui sont importants pour la santé reproductive.
La plupart des professionnels de la santé recommandent de limiter la consommation de caféine lorsque l’on essaie de concevoir.
8. Toxines environnementales et exposition aux produits chimiques
L’exposition aux toxines environnementales, notamment à certains produits chimiques, polluants et perturbateurs endocriniens, peut avoir un impact sur la fertilité :
• Perturbateurs endocriniens : les produits chimiques comme le bisphénol A (BPA), les phtalates et les pesticides peuvent imiter ou bloquer les hormones naturelles, entraînant des déséquilibres hormonaux qui perturbent l’ovulation, les cycles menstruels et la fonction reproductive globale.
• Métaux lourds : L’exposition aux métaux lourds comme le plomb et le mercure peut altérer la fonction ovarienne, réduire la qualité des ovules et interférer avec le cycle menstruel.
• Risques professionnels : Les femmes travaillant dans certains secteurs, comme l’agriculture, la fabrication ou les laboratoires, peuvent être exposées à des produits chimiques et à des radiations qui affectent négativement la fertilité.
Réduire l’exposition aux toxines environnementales – par exemple en évitant les contenants en plastique contenant du BPA, en choisissant des aliments biologiques lorsque cela est possible et en minimisant l’utilisation de certains cosmétiques – peut contribuer à soutenir la santé reproductive.
9. Les habitudes de sommeil et le rythme circadien
De mauvaises habitudes de sommeil et des cycles de sommeil irréguliers peuvent affecter la fertilité en perturbant les niveaux d’hormones, en particulier les hormones reproductrices qui régulent l’ovulation et les cycles menstruels :
• Mélatonine et santé reproductive : la mélatonine, une hormone associée au sommeil, agit également comme un antioxydant qui protège les ovules des dommages. Les femmes qui n’ont pas suffisamment de sommeil ou qui dorment mal peuvent voir leur taux de mélatonine diminuer, ce qui peut avoir un impact sur la santé des ovules.
• Travail posté : les femmes qui travaillent de nuit ou ont des horaires irréguliers peuvent connaître des perturbations de leur rythme circadien, ce qui peut entraîner des irrégularités menstruelles et une diminution de la fertilité.
Maintenir des habitudes de sommeil régulières et viser 7 à 8 heures de sommeil par nuit peut aider à soutenir l’équilibre hormonal et la santé reproductive.
10. Consommation de drogues à des fins récréatives
L’usage de drogues récréatives, comme la marijuana, la cocaïne et d’autres substances, peut avoir des effets nocifs sur la fertilité :
• Déséquilibres hormonaux : De nombreuses drogues récréatives interfèrent avec les signaux hormonaux nécessaires à l’ovulation et à la régularité menstruelle.
• Qualité des ovules et ovulation : certains médicaments, en particulier la marijuana, ont été associés à des perturbations de l’ovulation et à une réduction de la qualité des ovules.
• Complications de la grossesse : La consommation de drogues pendant la conception ou la grossesse peut entraîner une fausse couche, des malformations congénitales et des problèmes de développement chez le fœtus.
Éviter les drogues récréatives est essentiel pour optimiser la fertilité et réduire les risques associés à la grossesse.
Centre de FIV de Chypre du Nord
Le centre de FIV de Chypre du Nord est une clinique de fertilité axée sur le patient, située dans "Hôpital de recherche et de chirurgie d'élite» à Nicosie, Chypre. Notre clinique est l’une des cliniques de fertilité les plus avancées au monde, offrant une plus large sélection d’options de traitement à des prix abordables.
Nous Contacter
Téléphone
Anglais: +90 548 875 8000
Français: +90 548 876 8000
Turc: +90 542 869 8000
Arabe: +90 548 875 8000
Allemand: +90 548 830 1987
Russe: +90 548 828 9955
info@northcyprusivf.net
© 2020 LowCostIVF - Tous droits réservés. politique de confidentialité

