- Über Uns
- Blog
- Unfruchtbarkeit
- IVF-Behandlungen
- Neue IVF-Fortschritte
- Mitochondriale Ersatztherapie!
- IVF-Behandlung in Zypern
- IUI
- Mini-IVF
- IVF + ICSI
- Zytoplasmatische IVF
- Tandem-IVF-Zyklus
- Eizellspende
- Embryonenspende
- Samenspende
- Geschlecht – Geschlechtsauswahl
- Schwangerschafts-Leihmutterschaft
- Gleichgeschlechtliche Leihmutterschaft für Schwule
- Chirurgische Spermienentnahme
- Genetische Diagnostik vor der Implantation, PID
- Einfrieren von Eiern
- Geschlechtsauswahl mithilfe von Spendereizellen
- Prävention von Sichelzellanämie
- FAQ
- Reisen
- Über Uns
- Blog
- Unfruchtbarkeit
- IVF-Behandlungen
- Neue IVF-Fortschritte
- Mitochondriale Ersatztherapie!
- IVF-Behandlung in Zypern
- IUI
- Mini-IVF
- IVF + ICSI
- Zytoplasmatische IVF
- Tandem-IVF-Zyklus
- Eizellspende
- Embryonenspende
- Samenspende
- Geschlecht – Geschlechtsauswahl
- Schwangerschafts-Leihmutterschaft
- Gleichgeschlechtliche Leihmutterschaft für Schwule
- Chirurgische Spermienentnahme
- Genetische Diagnostik vor der Implantation, PID
- Einfrieren von Eiern
- Geschlechtsauswahl mithilfe von Spendereizellen
- Prävention von Sichelzellanämie
- FAQ
- Reisen
Weibliche Unfruchtbarkeit
Diagnose und Management
Die Diagnose weiblicher Unfruchtbarkeit ist oft komplexer als die Diagnose männlicher Unfruchtbarkeit. Während männliche Unfruchtbarkeit manchmal mit einer einzigen Spermienanalyse festgestellt werden kann, erfordert die Beurteilung weiblicher Unfruchtbarkeit normalerweise eine Reihe umfangreicher Tests und Untersuchungen, die möglicherweise zu einer endgültigen Diagnose führen, aber nicht müssen.
Frauen stellen nicht nur die Eizelle zur Verfügung, sondern auch die notwendige Umgebung, damit sich ein Embryo zu einem lebensfähigen Menschen entwickeln kann. Obwohl weibliche Unfruchtbarkeit häufig mit Problemen mit der Gesundheit der Eizelle in Verbindung gebracht wird, können auch verschiedene Erkrankungen der Eierstöcke und der Gebärmutter die Fähigkeit einer Frau, auf natürlichem Wege schwanger zu werden, beeinträchtigen. Es gibt etablierte Richtlinien zur Diagnose primärer weiblicher Unfruchtbarkeit. Jede Unfruchtbarkeitsuntersuchung sollte jedoch mit einer gründlichen Anamnese beginnen. Die folgenden Fragen können bei der Diagnose und Behandlung primärer weiblicher Unfruchtbarkeit hilfreich sein:
⦁ Waren Sie schon einmal schwanger?
⦁ Hatten Sie schon einmal eine Fehlgeburt? Wenn ja, zu welchem Zeitpunkt der Schwangerschaft kam es zu der Fehlgeburt?
⦁ Gibt es in Ihrer Familie Fälle von Unfruchtbarkeit?
⦁ Haben Sie regelmäßige Menstruationszyklen?
⦁ Wurden Sie kürzlich auf Infektionskrankheiten, einschließlich sexuell übertragbarer Krankheiten, untersucht?
⦁ Besitzen Sie Haustiere?
Die Antworten auf jede dieser Fragen können dem Fruchtbarkeitsspezialisten wichtige Informationen liefern. So kann der Besitz von Haustieren beispielsweise die Wahrscheinlichkeit einer Frau erhöhen, sich Infektionen zuzuziehen, die Unfruchtbarkeit verursachen können, wie etwa Toxoplasmose. Ebenso könnte eine Familienanamnese von Unfruchtbarkeit auf genetische Ursachen der Unfruchtbarkeit hinweisen. Bei jeder Unfruchtbarkeitsuntersuchung sollten sich Patienten mit nichts weniger als einer umfassenden Krankengeschichte zufrieden geben. Eine Kopie unseres Krankengeschichtenformulars finden Sie auf unserer Seite „Kontakt“. Obwohl der Fragebogen nur der Anfang einer Unfruchtbarkeitsuntersuchung ist, können diese Fragen helfen, mögliche Ursachen der Unfruchtbarkeit zu identifizieren, aber der nächste Schritt ist die Beurteilung der Fortpflanzungsphysiologie sowohl des männlichen als auch des weiblichen Patienten. Insbesondere Hormontests können Informationen über die Eierstockfunktion einer Frau liefern und bei der Behandlung helfen.
Was sind die häufigsten Ursachen für weibliche Unfruchtbarkeit?
1- Probleme beim Eisprung
Der Eisprung ist ein wichtiger Teil des weiblichen Fortpflanzungszyklus und für die Empfängnis unerlässlich. Während des Eisprungs wird eine reife Eizelle aus einem der Eierstöcke freigesetzt und steht der Befruchtung durch Spermien offen. Bei den meisten Frauen findet dieser Vorgang einmal pro Zyklus statt, normalerweise etwa zwei Wochen vor Beginn der Menstruationsperiode. Die Eizelle wandert durch den Eileiter, wo sie befruchtet werden kann, und wandert dann zur Einnistung in die Gebärmutter.
Wenn der Eisprung nicht regelmäßig oder überhaupt nicht erfolgt, spricht man von einer Ovulationsstörung. Eine Ovulationsstörung ist eine der Hauptursachen für weibliche Unfruchtbarkeit und macht etwa 25–30 % aller Fälle von Unfruchtbarkeit aus. Frauen mit Ovulationsproblemen können unregelmäßige Menstruationszyklen, ausbleibende Perioden oder sogar ein völliges Ausbleiben der Menstruation (Amenorrhoe) haben. Einige Frauen mit Ovulationsstörungen können jedoch dennoch regelmäßige Menstruationszyklen haben, was es schwieriger macht, das zugrunde liegende Problem ohne weitere Tests zu identifizieren.
Arten von Ovulationsstörungen
Probleme mit dem Eisprung können sich in verschiedenen Formen äußern, denen jeweils unterschiedliche Ursachen zugrunde liegen. Zu den häufigsten Ovulationsstörungen gehören:
1. Anovulation: Hierbei handelt es sich um das völlige Ausbleiben des Eisprungs, d. h. die Eierstöcke geben während des Menstruationszyklus keine Eizelle frei. Anovulation wird häufig mit hormonellen Ungleichgewichten, polyzystischem Ovarialsyndrom (PCOS) oder primärer Ovarialinsuffizienz (POI) in Verbindung gebracht.
2. Oligo-Ovulation: In diesem Fall erfolgt der Eisprung unregelmäßig oder selten. Frauen mit Oligo-Ovulation können unvorhersehbare Zyklen oder lange Pausen zwischen den Perioden haben, was es schwierig machen kann, den Geschlechtsverkehr für die Empfängnis zeitlich zu planen. Oligo-Ovulation steht auch oft mit Erkrankungen wie PCOS oder anderen hormonellen Problemen im Zusammenhang.
3. Lutealphasendefekt (LPD): Dieser Zustand tritt ein, wenn in der Lutealphase – der Zeit nach dem Eisprung – nicht genügend Progesteron produziert wird, um eine befruchtete Eizelle zu unterstützen. Niedrige Progesteronwerte können verhindern, dass sich die Gebärmutterschleimhaut ausreichend verdickt, was die Einnistung und Entwicklung eines Embryos erschwert, was zu einer Fehlgeburt führen kann.
Ursachen für Eisprungprobleme
Probleme beim Eisprung sind in erster Linie auf hormonelle Ungleichgewichte und Störungen der Signale zwischen Gehirn und Fortpflanzungsorganen zurückzuführen. Die häufigsten Ursachen für Eisprungstörungen sind:
1. Polyzystisches Ovarialsyndrom (PCOS): PCOS ist eine der häufigsten Ursachen für Ovulationsstörungen und betrifft etwa 5-10% der Frauen im gebärfähigen Alter. Frauen mit PCOS haben typischerweise erhöhte Androgenwerte (männliche Hormone), die den Eisprung beeinträchtigen. PCOS kann zu Anovulation, unregelmäßigen Perioden und anderen Stoffwechselproblemen wie Insulinresistenz führen.
2. Hypothalamische Dysfunktion: Der Hypothalamus im Gehirn reguliert viele Körperfunktionen, darunter die Freisetzung des Gonadotropin-Releasing-Hormons (GnRH), das der Hypophyse signalisiert, die für den Eisprung erforderlichen Hormone zu produzieren: das follikelstimulierende Hormon (FSH) und das luteinisierende Hormon (LH). Stress, extremer Gewichtsverlust, übermäßige körperliche Betätigung oder Essstörungen können die Funktion des Hypothalamus beeinträchtigen und zu einem unregelmäßigen oder ausbleibenden Eisprung führen.
3. Primäre Ovarialinsuffizienz (POI): POI wird auch als vorzeitiges Ovarialversagen bezeichnet und tritt auf, wenn die Eierstöcke vor dem 40. Lebensjahr ihre normale Funktion verlieren. Dieser Zustand ist manchmal auf genetische Faktoren, Autoimmunerkrankungen oder bestimmte medizinische Behandlungen (z. B. Chemotherapie) zurückzuführen. POI kann zu einer verringerten Östrogenproduktion, unregelmäßigen Zyklen und schließlich zum Ausbleiben des Eisprungs führen.
4. Hyperprolaktinämie: Erhöhte Prolaktinwerte, ein Hormon, das für die Milchproduktion verantwortlich ist, können den Eisprung unterdrücken, indem sie das Gleichgewicht der Fortpflanzungshormone stören. Dieser Zustand kann durch Medikamente, Hypophysentumore oder Schilddrüsenprobleme verursacht werden.
5. Schilddrüsenerkrankungen: Sowohl eine Hyperthyreose (Überfunktion der Schilddrüse) als auch eine Hypothyreose (Unterfunktion der Schilddrüse) können den normalen Menstruations- und Eisprungzyklus beeinträchtigen. Schilddrüsenhormone spielen eine entscheidende Rolle bei der Regulierung des Fortpflanzungssystems des Körpers, und jedes Ungleichgewicht kann zu Problemen beim Eisprung führen.
Symptome von Eisprungproblemen
Die Symptome von Ovulationsproblemen können je nach spezifischer Störung sehr unterschiedlich sein. Häufige Symptome, die auf eine Ovulationsstörung hinweisen können, sind:
• Unregelmäßiger Menstruationszyklus (zu lang, zu kurz oder unvorhersehbar)
• Ausbleiben der Menstruation (Amenorrhoe)
• Starke oder sehr leichte Menstruationsblutungen
• Keine prämenstruellen Symptome (Brustspannen, Blähungen)
• Schwierigkeiten bei der Vorhersage des Eisprungs (unregelmäßiges Muster der Basaltemperatur)
• Akne, übermäßige Gesichts- oder Körperbehaarung und Gewichtszunahme (insbesondere bei Frauen mit PCOS)
Diese Symptome bestätigen zwar nicht unbedingt ein Problem mit dem Eisprung, können aber Hinweise darauf sein, dass eine weitere Untersuchung durch einen Arzt erforderlich ist.
Diagnose von Ovulationsproblemen
Zur Diagnose von Ovulationsstörungen können eine Reihe von Untersuchungen und Tests durchgeführt werden. Dazu gehören:
1. Krankengeschichte und körperliche Untersuchung: Eine gründliche Anamnese und körperliche Untersuchung können mögliche zugrunde liegende Ursachen aufdecken, wie z. B. Lebensstilfaktoren, Gewichtsveränderungen oder Stresslevel, die den Eisprung beeinflussen könnten.
2. Eisprung-Tracking: Frauen werden möglicherweise gebeten, ihren Menstruationszyklus und ihre Basaltemperatur zu verfolgen oder Eisprungvorhersagetests zu verwenden. Progesteron-Bluttests während der Lutealphase können bestätigen, ob ein Eisprung stattgefunden hat.
3. Hormontests: Durch Bluttests können die Werte wichtiger Hormone wie FSH, LH, Östrogen, Prolaktin, Testosteron und Schilddrüsenhormone gemessen werden, um etwaige Ungleichgewichte festzustellen, die den Eisprung beeinträchtigen könnten.
4. Ultraschall: Ein transvaginaler Ultraschall kann helfen, die Eierstöcke sichtbar zu machen und das Vorhandensein von Follikeln, Zysten oder anderen Anomalien festzustellen. Diese Bildgebung kann besonders nützlich sein, um PCOS zu diagnostizieren oder die Reaktion der Eierstöcke auf eine Hormonbehandlung zu überwachen, wenn eine Fruchtbarkeitsbehandlung durchgeführt wird.
5. Zusätzliche Tests für zugrunde liegende Erkrankungen: Wenn erste Tests auf ein Problem wie POI, PCOS oder eine Schilddrüsenerkrankung hinweisen, können zusätzliche Tests durchgeführt werden, um die Diagnose zu bestätigen.
Probleme mit dem Eisprung können eine Empfängnis erschweren, da ein unregelmäßiger oder ausbleibender Eisprung die Anzahl der Möglichkeiten für eine Befruchtung einer Eizelle verringert. Selbst wenn der Eisprung stattfindet, können Erkrankungen wie Gelbkörperschwäche oder Eizellen von schlechter Qualität die Einnistung beeinträchtigen oder das Risiko einer Fehlgeburt erhöhen. Glücklicherweise sind viele Eisprungstörungen behandelbar, und Fortschritte in der Fruchtbarkeitsmedizin bieten Frauen mit eisprungbedingter Unfruchtbarkeit verschiedene Optionen.
2- Probleme mit den Eileitern
Verstopfte oder beschädigte Eileiter sind eine wesentliche Ursache für weibliche Unfruchtbarkeit, da sie den normalen Weg zwischen Eizelle und Spermium unterbrechen und so eine Befruchtung verhindern. Die Eileiter, die die Eierstöcke mit der Gebärmutter verbinden, spielen eine entscheidende Rolle im Fortpflanzungsprozess. Jeden Monat wird nach dem Eisprung eine Eizelle aus einem der Eierstöcke freigesetzt und wandert durch den Eileiter, wo sie auf Spermien treffen und befruchtet werden kann. Nach der Befruchtung wandert der Embryo weiter durch den Eileiter, bis er die Gebärmutter zur Einnistung erreicht. Wenn einer oder beide Eileiter verstopft oder beschädigt sind, wird diese Reise behindert, was eine natürliche Empfängnis erschwert oder unmöglich macht.
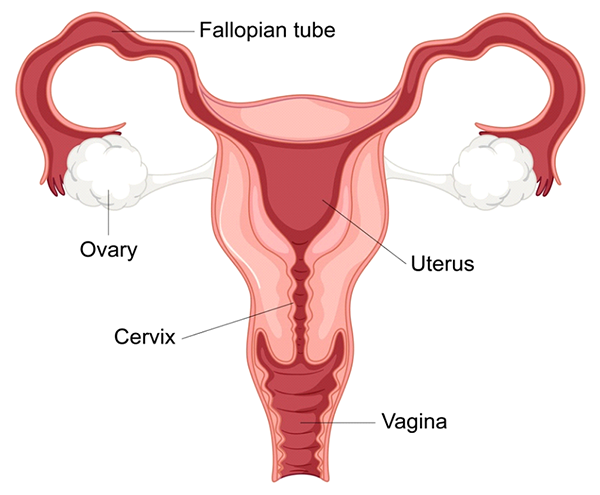
Wie sich Schäden an den Eileitern auf die Fruchtbarkeit auswirken
Schäden oder Blockaden der Eileiter können die Fruchtbarkeit wie folgt beeinträchtigen:
a) Verhinderung, dass Spermien die Eizelle erreichen: Wenn die Eileiter vollständig blockiert sind, können Spermien die Eizelle nicht erreichen und es kann keine Befruchtung stattfinden. Diese Situation wird als Tubenfaktor-Unfruchtbarkeit bezeichnet und ist für etwa 25-35% aller Fälle weiblicher Unfruchtbarkeit verantwortlich.
b) Störung der Eizellenaufnahme: Eine Beschädigung der Fimbrien (die gesäumten Enden der Eileiter in der Nähe der Eierstöcke) kann verhindern, dass die Eizelle nach dem Eisprung aufgenommen und in den Eileiter gezogen wird. Ohne diesen Prozess kann die Eizelle nicht durch den Eileiter wandern und das Spermium treffen.
c) Verhinderung des Embryotransports: Wenn ein teilweise blockierter Eileiter eine Befruchtung ermöglicht, aber den Durchgang der befruchteten Eizelle (des Embryos) behindert, kann dies zu einer Eileiterschwangerschaft führen. Dies ist ein ernster Zustand, bei dem sich der Embryo im Eileiter und nicht in der Gebärmutter einnistet und dort wächst, was zu medizinischen Komplikationen führen kann und eine sofortige Behandlung erfordert.
d) Behinderung der Einnistung in der Gebärmutter: Selbst wenn der Eileiter nur teilweise blockiert oder beschädigt ist, kann dies den rechtzeitigen Transport des Embryos in die Gebärmutter beeinträchtigen. Ein verzögerter Embryotransport kann die Wahrscheinlichkeit einer erfolgreichen Einnistung verringern oder das Risiko einer Einnistung an einer ungeeigneten Stelle erhöhen.
Ursachen für verstopfte oder beschädigte Eileiter
1. Entzündliche Beckenerkrankung (PID): PID ist eine Infektion der weiblichen Geschlechtsorgane, die häufig durch sexuell übertragbare Infektionen (STIs) wie Chlamydien oder Gonorrhoe verursacht wird. Unbehandelt können diese Infektionen zu Entzündungen und Vernarbungen der Eileiter führen, was zu teilweisen oder vollständigen Blockaden führt. PID ist eine der häufigsten Ursachen für Eileiterunfruchtbarkeit.
2. Endometriose: Endometriose ist eine Erkrankung, bei der Gewebe, das der Gebärmutterschleimhaut ähnelt, außerhalb der Gebärmutter wächst, häufig an den Eierstöcken, Eileitern oder der Beckenschleimhaut. Endometriumimplantate an oder in der Nähe der Eileiter können Verwachsungen, Entzündungen oder Vernarbungen verursachen, was zu Blockaden oder eingeschränkter Beweglichkeit der Eileiter führt.
3. Eileiteroperation: Frühere Operationen an den Eileitern, wie z. B. Eingriffe zur Korrektur einer Eileiterschwangerschaft, zur Entfernung von Zysten oder zur Behandlung von Eileiterinfektionen, können zu Narbenbildung und Verwachsungen führen, die die Eileiter verstopfen. Frauen, die sich einer Eileiterligatur (chirurgische Sterilisation) unterzogen haben, können aufgrund einer absichtlichen Blockierung der Eileiter ebenfalls unfruchtbar werden.
4. Verwachsungen durch Bauch- oder Beckenoperationen: Operationen im Bauch- oder Beckenbereich, wie Blinddarmoperationen, Kaiserschnitte oder Operationen bei Eierstockzysten, können zur Bildung von Narbengewebe um die Eileiter führen. Diese Verwachsungen können die Eileiter verstopfen oder ihre Bewegung einschränken und so den Weg der Eizelle zur Gebärmutter beeinträchtigen.
5. Hydrosalpinx: Hydrosalpinx ist eine Erkrankung, bei der einer oder beide Eileiter blockiert und mit Flüssigkeit gefüllt sind. Diese Erkrankung ist häufig eine Folge von Infektionen, PID oder Endometriose. Die Flüssigkeit in einem Hydrosalpinx kann für Embryonen toxisch sein und die Erfolgsrate der In-vitro-Fertilisation (IVF) verringern, wenn sie unbehandelt bleibt.
6. Angeborene Anomalien: In seltenen Fällen können einige Frauen mit strukturellen Anomalien in den Eileitern geboren werden, die zu Verstopfungen oder Funktionsstörungen führen können.
Diagnose blockierter oder beschädigter Eileiter
Zur Diagnose von Verstopfungen oder Schädigungen der Eileiter werden häufig folgende Diagnoseverfahren eingesetzt:
1. Hysterosalpingographie (HSG): HSG ist ein Röntgenverfahren, bei dem ein spezieller Farbstoff in die Gebärmutter und die Eileiter gespritzt wird, um deren Struktur zu untersuchen. Der Farbstoff ist auf Röntgenbildern sichtbar und kann Blockaden oder Anomalien in den Eileitern aufdecken.
2. Sonohysterographie: Dieses Verfahren ähnelt der HSG, verwendet jedoch Ultraschall statt Röntgenstrahlen. Eine Kochsalzlösung wird in die Gebärmutter injiziert, sodass der Arzt die Eileiter untersuchen und auf Blockaden oder Schäden prüfen kann.
3. Laparoskopie: Bei der Laparoskopie handelt es sich um einen minimalinvasiven chirurgischen Eingriff, bei dem eine kleine Kamera durch einen winzigen Einschnitt im Bauch eingeführt wird. Bei diesem Verfahren kann der Arzt die Eileiter direkt betrachten, kleinere Blockaden oder Verwachsungen entfernen und den Zustand der umliegenden Beckenorgane beurteilen. Eine Laparoskopie wird häufig durchgeführt, wenn andere Diagnosetests keine eindeutigen Ergebnisse geliefert haben oder wenn Symptome einer Endometriose oder von Beckenverwachsungen vorliegen.
4. Chlamydien-Antikörpertest: Da eine Chlamydieninfektion zu Eileiterschäden ohne offensichtliche Symptome führen kann, wird bei diesem Bluttest nach Antikörpern gegen Chlamydien gesucht. Ein positives Ergebnis kann auf eine frühere Infektion hinweisen, die die Eileiter beeinträchtigt haben könnte.
Eine IVF wird häufig Frauen mit verstopften oder stark beschädigten Eileitern empfohlen, da sie die Eileiter vollständig überflüssig macht. Bei der IVF werden Eizellen aus den Eierstöcken entnommen, im Labor mit Sperma befruchtet und die daraus entstehenden Embryonen direkt in die Gebärmutter übertragen. Die IVF gilt als die wirksamste Behandlung bei Eileiterunfruchtbarkeit, insbesondere bei schweren oder irreversiblen Schäden. Frauen mit einem verstopften Eileiter können zwar immer noch versuchen, auf natürlichem Wege schwanger zu werden, aber die IVF bietet eine Alternative, wenn andere Versuche erfolglos bleiben.
3- Körperliche Probleme mit der Gebärmutter
Körperliche Anomalien oder strukturelle Probleme in der Gebärmutter sind ein weiterer wichtiger Faktor für weibliche Unfruchtbarkeit. Die Gebärmutter bietet die Umgebung für die Einnistung des Embryos und das Wachstum eines sich entwickelnden Fötus. Strukturelle Probleme mit der Gebärmutter können die Einnistung einer befruchteten Eizelle stören, die Embryonalentwicklung beeinträchtigen oder das Risiko einer Fehlgeburt erhöhen. Diese Probleme werden oft als uterine Unfruchtbarkeit bezeichnet und können sowohl die Fähigkeit zur Empfängnis als auch die Wahrscheinlichkeit einer gesunden Schwangerschaft beeinträchtigen.
Arten von Gebärmutterstrukturproblemen und ihre Auswirkungen auf die Fruchtbarkeit
Es gibt verschiedene Arten von körperlichen Problemen, die die Gebärmutter beeinträchtigen und zu Unfruchtbarkeit führen können. Jede Erkrankung hat je nach Ort, Schweregrad und zugrunde liegender Ursache unterschiedliche Auswirkungen auf die Fruchtbarkeit. Zu den häufigsten strukturellen Problemen der Gebärmutter, die mit Unfruchtbarkeit in Verbindung stehen, gehören:
1. Myome (Uterusleiomyome):
Myome sind gutartige Wucherungen aus Muskel- und Bindegewebe, die sich in oder an den Wänden der Gebärmutter entwickeln. Obwohl Myome recht häufig sind und bis zum Alter von 50 Jahren bis zu 70–80 % der Frauen davon betroffen sind, führen sie nicht immer zu Unfruchtbarkeit. Die Auswirkungen von Myomen auf die Fruchtbarkeit hängen von ihrer Größe, Anzahl und Lage in der Gebärmutter ab. Submuköse Myome, die in der Gebärmutterhöhle wachsen, beeinträchtigen eher die Einnistung oder die Embryonalentwicklung. Große oder mehrere Myome können auch die Form der Gebärmutterhöhle verändern oder die Eileiter blockieren, was die Empfängnis weiter erschwert. Myome können je nach Größe und Lage auch das Risiko einer Fehlgeburt, Frühgeburt und von Komplikationen während der Schwangerschaft erhöhen.
2. Gebärmutterpolypen:
Uteruspolypen sind kleine, gutartige Wucherungen, die aus der Gebärmutterschleimhaut (Endometrium) entstehen. Obwohl sie im Allgemeinen nicht krebsartig sind, können Polypen die Fruchtbarkeit beeinträchtigen, indem sie den Durchgang von Spermien blockieren, die Einnistung verhindern oder die Blutversorgung eines implantierten Embryos unterbrechen. Polypen können besonders problematisch sein, wenn sie sich in der Nähe der Stelle befinden, an der sich ein Embryo normalerweise einnisten würde. In solchen Fällen können sie eine erfolgreiche Schwangerschaft verhindern oder das Risiko einer frühen Fehlgeburt erhöhen.
3. Angeborene Gebärmutteranomalien:
Dabei handelt es sich um strukturelle Anomalien in der Gebärmutter, die von Geburt an vorhanden sind und durch Entwicklungsprobleme bei der Bildung der Müllerschen Gänge verursacht werden, aus denen die Gebärmutter, die Eileiter und der obere Teil der Vagina hervorgehen. Angeborene Gebärmutteranomalien können eine der folgenden Formen annehmen:
Zweihörniger Uterus: Die Gebärmutter hat eine herzförmige Form mit einer tiefen Einbuchtung am oberen Ende, die zwei Hohlräume bildet. Eine zweihörnige Gebärmutter kann das Risiko einer Fehlgeburt, Frühgeburt und einer abnormalen Lage des Fötus erhöhen.
Septierter Uterus: Ein faseriges oder muskuläres Septum (Wand) teilt die Gebärmutterhöhle teilweise oder vollständig. Dieser Zustand ist mit einer höheren Rate an Fehlgeburten und Implantationsfehlern verbunden, da das Septum möglicherweise eine verminderte Blutversorgung aufweist und dadurch die Embryoimplantation weniger begünstigt.
Einhorn-Uterus: Es ist nur die Hälfte der Gebärmutter ausgebildet, was häufig zu einer kleineren Gebärmutterhöhle als üblich führt. Dies kann zu Schwierigkeiten bei der Aufrechterhaltung einer Schwangerschaft führen und es besteht ein höheres Risiko für Fehlgeburten und Frühgeburten.
Didelphyse Uterus: Diese seltene Erkrankung, auch „Doppeluterus“ genannt, tritt auf, wenn sich zwei getrennte Gebärmutterhöhlen bilden. Obwohl eine Empfängnis möglich ist, kann eine Schwangerschaft aufgrund des begrenzten Platzes in der Gebärmutter mit einem höheren Risiko verbunden sein.
Angeborene Gebärmutteranomalien tragen häufig zu wiederholten Fehlgeburten bei und können auch die Empfängnis der Frau erschweren, insbesondere wenn die Gebärmutterform eine ordnungsgemäße Einnistung verhindert.
4. Intrauterine Verwachsungen (Asherman-Syndrom):
Intrauterine Verwachsungen sind Narbengewebebänder, die sich in der Gebärmutter bilden, oft als Folge einer Verletzung der Gebärmutterschleimhaut. Sie werden häufig durch Gebärmutteroperationen wie Dilatation und Kürettage (D&C) oder Infektionen verursacht. Das Asherman-Syndrom kann zu einer teilweisen oder vollständigen Verstopfung der Gebärmutterhöhle führen, was die Einnistung verhindern oder zu wiederholten Fehlgeburten führen kann. In schweren Fällen können die Verwachsungen die Menstruation vollständig verhindern (Amenorrhoe). Frauen mit Asherman-Syndrom können leichte oder ausbleibende Perioden, Beckenschmerzen und Unfruchtbarkeit erleben, insbesondere wenn die Verwachsungen die normale Gebärmutterfunktion stören.
5. Adenomyose:
Adenomyose tritt auf, wenn Endometriumgewebe (die Gebärmutterschleimhaut) in die Muskelwand der Gebärmutter hineinwächst. Dieser Zustand kann eine verdickte, vergrößerte Gebärmutter verursachen und zu schmerzhaften oder starken Perioden, Beckenschmerzen und Unfruchtbarkeit führen. Adenomyose ist normalerweise mit Implantationsfehlern und einem erhöhten Risiko einer Fehlgeburt verbunden. Obwohl die genaue Ursache der Unfruchtbarkeit bei Adenomyose nicht vollständig verstanden ist, wird angenommen, dass das abnormale Wachstum von Endometriumgewebe in der Muskelwand die ordnungsgemäße Funktion der Gebärmutter stört.
6. Endometriumprobleme:
Die Dicke und Qualität der Gebärmutterschleimhaut sind entscheidend für die erfolgreiche Einnistung des Embryos. In manchen Fällen ist die Gebärmutterschleimhaut zu dünn oder entwickelt sich nicht ausreichend, was häufig auf hormonelle Ungleichgewichte, bestimmte Medikamente oder frühere Gebärmutteroperationen zurückzuführen ist. Eine dünne Gebärmutterschleimhaut kann die Wahrscheinlichkeit einer Einnistung verringern, da sie möglicherweise nicht den notwendigen Halt für die Anheftung und das Gedeihen eines Embryos bietet.
Symptome von strukturellen Problemen der Gebärmutter
Während manche Frauen mit Gebärmutterstrukturproblemen möglicherweise keine Symptome aufweisen, können bei anderen die folgenden Symptome auftreten:
• Unregelmäßige oder starke Menstruationsblutungen (häufig bei Myomen, Polypen und Adenomyose)
• Schmerzhafte Perioden oder Beckenschmerzen
• Wiederholte Fehlgeburten oder Schwangerschaftsverluste
• Schwierigkeiten, trotz regelmäßigem Eisprung und gesunder Spermien schwanger zu werden
• Schmerzen beim Geschlechtsverkehr
Da die Symptome subtil sein oder sich mit anderen Erkrankungen überschneiden können, werden Probleme in der Gebärmutterstruktur oft erst diagnostiziert, wenn die Frau sich wegen Unfruchtbarkeit oder wiederholter Fehlgeburten untersuchen lässt.
Diagnose struktureller Probleme der Gebärmutter
Zur Diagnose struktureller Probleme in der Gebärmutter werden häufig bildgebende Verfahren und, falls erforderlich, minimalinvasive Verfahren eingesetzt.
Ultraschall: Der transvaginale Ultraschall ist ein bildgebendes Verfahren erster Wahl zur Beurteilung der Gebärmutterstruktur. Damit können Myome, Polypen, angeborene Anomalien und Adenomyose identifiziert werden. In einigen Fällen kann 3D-Ultraschall eine detailliertere Ansicht der Gebärmutterform liefern.
Hysterosalpingographie (HSG): Bei dieser Röntgenuntersuchung wird ein Kontrastmittel in die Gebärmutter gespritzt, um die Form der Gebärmutterhöhle abzubilden und die Eileiter auf Blockaden oder Verwachsungen zu prüfen.
Sonohysterographie: Während einer Ultraschalluntersuchung wird eine Kochsalzlösung in die Gebärmutter gespritzt, um eine klarere Sicht auf die Gebärmutterhöhle zu ermöglichen. Mit dieser Technik können Polypen, Myome und Verwachsungen identifiziert werden.
Magnetresonanztomographie (MRT): Die MRT liefert hochauflösende Bilder der Gebärmutter und ist besonders nützlich für die Diagnose von Adenomyose, angeborenen Anomalien und tiefen Uterusmyomen.
Hysteroskopie: Bei einer Hysteroskopie wird ein dünnes, beleuchtetes Endoskop durch den Gebärmutterhals eingeführt, um das Innere der Gebärmutter direkt zu betrachten. So kann der Arzt die Gebärmutterhöhle visuell auf Polypen, Myome oder Verwachsungen untersuchen und diese bei Bedarf im selben Eingriff entfernen oder behandeln.
Laparoskopie: Bei der Laparoskopie handelt es sich um einen minimalinvasiven chirurgischen Eingriff, der es dem Arzt ermöglicht, die Außenseite der Gebärmutter und die umgebenden Strukturen wie Eileiter und Eierstöcke zu betrachten. Sie ist besonders hilfreich bei der Erkennung von Endometriose oder Beckenverwachsungen, die die Fruchtbarkeit beeinträchtigen können.
4- Probleme mit dem Gebärmutterhals
Gebärmutterhalsprobleme können die Fruchtbarkeit einer Frau erheblich beeinträchtigen, da der Gebärmutterhals eine entscheidende Rolle auf dem Weg der Spermien zur Eizelle spielt. Der Gebärmutterhals ist der untere Teil der Gebärmutter, der mit der Vagina verbunden ist, und dient den Spermien als Tor in die Gebärmutter und von dort nach oben zu den Eileitern, wo normalerweise die Befruchtung stattfindet. Gebärmutterhalsprobleme, die die Funktion oder Struktur des Gebärmutterhalses beeinträchtigen, können verhindern, dass die Spermien die Eizelle erreichen, die Wahrscheinlichkeit einer Einnistung verringern oder das Risiko einer Fehlgeburt erhöhen.

Arten von Gebärmutterhalsproblemen und ihre Auswirkungen auf die Fruchtbarkeit
Es gibt verschiedene Arten von Gebärmutterhalsproblemen, die die Fruchtbarkeit beeinträchtigen können:
1. Anomalien des Zervixschleims:
Zervixschleim, der von Drüsen im Gebärmutterhals produziert wird, ist für die Bewegung der Spermien von entscheidender Bedeutung. Um den Zeitpunkt des Eisprungs herum wird der Zervixschleim dünn, dehnbar und glitschig (ähnlich der Konsistenz von Eiweiß), sodass die Spermien leichter durch den Gebärmutterhals und in die Gebärmutter gelangen können. Wenn der Zervixschleim zu dick, spärlich oder feindlich (für Spermien ungünstig) ist, kann er die Bewegung der Spermien behindern oder sie töten, bevor sie die Eizelle erreichen. Dieser Zustand wird manchmal als „feindlicher Zervixschleim“ bezeichnet und ist häufig auf hormonelle Ungleichgewichte, Infektionen, bestimmte Medikamente oder zugrunde liegende Gesundheitszustände zurückzuführen. Unzureichender oder minderwertiger Zervixschleim kann auch verhindern, dass Spermien lange genug überleben, um die Eizelle zu erreichen, wodurch die Wahrscheinlichkeit einer Befruchtung verringert wird.
2. Zervikale Stenose (Verengung des Gebärmutterhalskanals):
Bei einer Zervixstenose handelt es sich um eine Erkrankung, bei der der Gebärmutterhalskanal ungewöhnlich eng oder geschlossen wird, sodass Spermien nur schwer hindurch gelangen können. Diese Erkrankung kann angeboren (von Geburt an vorhanden) oder durch Operationen, Infektionen, Traumata oder Strahlentherapie erworben sein. In schweren Fällen kann eine Zervixstenose den Durchgang von Spermien vollständig blockieren und so eine natürliche Empfängnis verhindern. Eine Zervixstenose kann auch zu Menstruationsunregelmäßigkeiten und Schmerzen führen, da das Menstruationsblut den verengten Gebärmutterhals nur schwer passieren kann. In Fällen einer schweren Stenose können assistierte Reproduktionstechniken wie eine intrauterine Insemination (IUI) oder eine In-vitro-Fertilisation (IVF) empfohlen werden, um den Gebärmutterhals zu umgehen.
3. Gebärmutterhalsinfektionen und -entzündungen:
Infektionen des Gebärmutterhalses, wie Zervizitis (Entzündung des Gebärmutterhalses) oder sexuell übertragbare Infektionen (STIs) wie Chlamydien und Gonorrhoe, können die Fruchtbarkeit beeinträchtigen. Entzündungen und Infektionen im Gebärmutterhals können die Qualität des Gebärmutterhalsschleims verändern und ihn für Spermien weniger günstig machen. In einigen Fällen können unbehandelte Infektionen zur Bildung von Narbengewebe führen, das den Gebärmutterhalskanal verengen kann. Infektionen können sich auch nach oben ausbreiten und zu einer entzündlichen Beckenerkrankung (PID) führen, die die Fruchtbarkeit weiter beeinträchtigen kann, indem sie Vernarbungen und Blockaden in den Eileitern verursacht.
4. Zervixinsuffizienz (Zervixinsuffizienz):
Eine Zervixinsuffizienz, auch Zervixinsuffizienz genannt, liegt vor, wenn der Gebärmutterhals zu schwach ist, um während der Schwangerschaft geschlossen zu bleiben. Obwohl dieser Zustand eine Empfängnis nicht direkt verhindert, kann er zu einer Fehlgeburt führen, insbesondere im zweiten Trimester, da sich der Gebärmutterhals vorzeitig öffnen kann. Eine Zervixinsuffizienz kann auf genetische Faktoren, frühere Gebärmutterhalsoperationen (z. B. LEEP-Verfahren oder Konusbiopsie), ein Trauma bei der Geburt oder angeborene Anomalien zurückzuführen sein. Frauen mit dieser Erkrankung erleiden häufig wiederholt Fehlgeburten und benötigen möglicherweise medizinische Eingriffe, um den Gebärmutterhals während der Schwangerschaft zu stützen.
5. Vorherige Operationen oder Eingriffe an der Gebärmutterhalswirbelsäule:
Bestimmte Verfahren am Gebärmutterhals, wie z. B. ein LEEP (Loop Electrosurgical Excision Procedure) oder eine Konusbiopsie, werden verwendet, um Krebsvorstufen aus dem Gebärmutterhals zu entfernen, können aber manchmal die Fruchtbarkeit beeinträchtigen. Diese Verfahren können den Gebärmutterhals schwächen oder Narben verursachen, die zu einer Zervixinsuffizienz oder Stenose führen können. Während die meisten Frauen nach diesen Verfahren fruchtbar bleiben, besteht bei Frauen, bei denen Komplikationen auftreten, ein höheres Risiko für Unfruchtbarkeit, wiederholte Fehlgeburten oder Frühgeburten. In einigen Fällen können Narben am Gebärmutterhals durch die Operation die Schleimproduktion beeinträchtigen oder den Durchgang von Spermien erschweren.
6. Antisperma-Antikörper im Zervixschleim:
In seltenen Fällen kann das Immunsystem einer Frau Antikörper gegen Spermien produzieren, da es diese als fremde Eindringlinge wahrnimmt. Diese Antikörper können im Zervixschleim vorhanden sein und die Spermienbewegung beeinträchtigen, Spermien schädigen oder verhindern, dass Spermien die Gebärmutter erreichen. Das Vorhandensein von Antikörpern gegen Spermien im Zervixschleim kann zu einer sogenannten „immunologischen Unfruchtbarkeit“ führen, die spezielle Behandlungen wie IUI oder IVF erfordern kann, um den Gebärmutterhals zu umgehen und die Chancen auf eine Befruchtung zu verbessern.
Diagnose von Gebärmutterhalsproblemen bei Unfruchtbarkeit
Die Diagnose einer zervikal bedingten Unfruchtbarkeit umfasst in der Regel eine Reihe von Tests und Untersuchungen. Eine Beckenuntersuchung ermöglicht es dem Arzt, Größe, Form und Position des Gebärmutterhalses zu beurteilen und nach sichtbaren Anomalien oder Anzeichen einer Entzündung zu suchen. Manchmal kann ein Postkoitaltest angeordnet werden, wenn feindseliger Schleim vermutet wird. Bei diesem Test wird nach dem Geschlechtsverkehr eine Probe des Zervixschleims entnommen, um die Spermienbewegung im Schleim zu untersuchen. Dieser Test hilft festzustellen, ob der Zervixschleim die Spermienbewegung unterstützt oder hemmt, obwohl er heutzutage aufgrund unterschiedlicher Ergebnisse seltener verwendet wird.
Bei der HSG handelt es sich um ein Röntgenverfahren, bei dem Kontrastmittel verwendet werden, um die Form der Gebärmutter und die Durchgängigkeit (Offenheit) des Gebärmutterhalskanals und der Eileiter zu beurteilen. Es hilft, strukturelle Blockaden im Gebärmutterhals zu erkennen. Zur Erkennung von Infektionen können Gebärmutterhalskulturen angelegt werden, während eine Gebärmutterhalsbiopsie das Vorhandensein von abnormalen oder präkanzerösen Zellen feststellen kann. Diese Tests können helfen, Infektionen oder Narbenbildung zu erkennen, die die Fruchtbarkeit beeinträchtigen können.
Mithilfe von Ultraschallbildern können die Struktur und Länge des Gebärmutterhalses beurteilt werden, insbesondere in Fällen, in denen eine Zervixinsuffizienz vermutet wird. Bei Frauen mit einer Vorgeschichte einer Zervixinsuffizienz wird während der Schwangerschaft häufig transvaginaler Ultraschall eingesetzt, um die Länge des Gebärmutterhalses zu überwachen.
5- Alter
Das Alter ist einer der wichtigsten Faktoren, die die Fruchtbarkeit einer Frau beeinflussen. Mit zunehmendem Alter nimmt die Fruchtbarkeit einer Frau auf natürliche Weise ab, da sich sowohl die Menge als auch die Qualität ihrer Eizellen ändert, sowie Veränderungen in ihrem Fortpflanzungssystem, die sich auf Empfängnis und Schwangerschaft auswirken. Der Rückgang der Fruchtbarkeit beginnt bei einer Frau typischerweise zwischen Ende 20 und Anfang 30 und beschleunigt sich nach dem 35. Lebensjahr deutlich. Wenn eine Frau die 40 erreicht, sinkt die Wahrscheinlichkeit, auf natürliche Weise schwanger zu werden, erheblich und das Risiko von Komplikationen steigt. Mit zunehmendem Alter einer Frau treten die folgenden Veränderungen auf:
1. Rückgang der Eizellenanzahl (ovarielle Reserve)
Frauen werden mit allen Eizellen geboren, die sie jemals haben werden, etwa 1-2 Millionen zum Zeitpunkt der Geburt. In der Pubertät ist diese Zahl bereits auf etwa 300.000 bis 400.000 gesunken, und mit jedem Menstruationszyklus werden weitere Eizellen aufgebraucht. Gegen Ende 30 nimmt die Anzahl der verbleibenden Eizellen (die sogenannte ovarielle Reserve) rapide ab. Wenn sich eine Frau der Menopause nähert, typischerweise etwa Anfang 50, sind nur noch sehr wenige, wenn überhaupt, lebensfähige Eizellen übrig. Die Abnahme der ovariellen Reserve beeinträchtigt die Empfängnisfähigkeit einer Frau, da weniger Eizellen weniger Befruchtungsmöglichkeiten bedeuten. Eine verringerte Eizellenversorgung begrenzt auch die Wirksamkeit von Fruchtbarkeitsbehandlungen wie In-vitro-Fertilisation (IVF), da die Eierstöcke möglicherweise nicht genügend Eizellen als Reaktion auf die Stimulation produzieren.
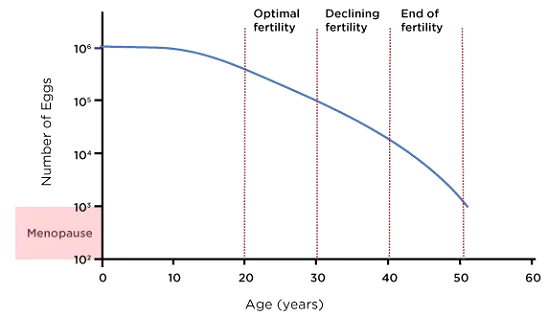
2. Rückgang der Eiqualität
Mit zunehmendem Alter nimmt nicht nur die Anzahl der Eizellen ab, sondern auch ihre Qualität. Die Eizellenqualität bezieht sich auf die genetische und chromosomale Integrität einer Eizelle. Mit zunehmendem Alter der Frau ist es wahrscheinlicher, dass sich in den Eizellen Chromosomenanomalien ansammeln, was die Wahrscheinlichkeit genetischer Störungen wie des Down-Syndroms erhöht und die Chancen auf eine erfolgreiche Empfängnis verringert. Chromosomenanomalien erhöhen auch das Risiko einer Fehlgeburt, insbesondere bei Frauen über 35 Jahren. Studien zeigen, dass die Fehlgeburtsrate bei Frauen in ihren frühen 20ern etwa 10-15% beträgt, bei Frauen in ihren frühen 40ern steigt diese Rate jedoch auf etwa 35%.
In älteren Altersgruppen treten nicht nur genetische Probleme in der Eizelle auf, sondern auch die zytoplasmatischen Organellen verlieren mit zunehmendem Alter ihre Funktion. Insbesondere die Funktion der Mitochondrien ist für das Zellwachstum und die Zellentwicklung von entscheidender Bedeutung, und alternde Mitochondrien können möglicherweise nicht mehr das notwendige Gleichgewicht zwischen Energieproduktion und oxidativem Schaden in den Eizellen herstellen. Einige Behandlungen der neuen Generation wie die „Mitochondrienersatztherapie“ können in Fällen hilfreich sein, in denen die Alterung der Eizelle während Fruchtbarkeitsbehandlungen ein Problem darstellt. Die nachlassende Qualität der Eizellen ist ein wesentlicher Grund dafür, dass die Schwangerschafts- und Lebendgeburtenraten mit zunehmendem Alter sinken, selbst bei Anwendung von Fruchtbarkeitsbehandlungen.
3. Erhöhtes Risiko für reproduktive Gesundheitsprobleme
Mit zunehmendem Alter entwickeln Frauen häufiger gesundheitliche Probleme, die ihre Fruchtbarkeit beeinträchtigen können, darunter Endometriose, Uterusmyome und chronische Komplikationen einer entzündlichen Beckenerkrankung. Diese gesundheitlichen Probleme beeinträchtigen nicht nur die Chancen auf eine Empfängnis, sondern können auch das Risiko von Schwangerschaftskomplikationen und Fehlgeburten erhöhen.
4. Reduzierte Uterusrezeptivität
Mit zunehmendem Alter kann sich die Gebärmutter auch verändern, was ihre Fähigkeit, eine Schwangerschaft zu unterstützen, beeinträchtigt. Die Gebärmutterschleimhaut, die sich in jedem Zyklus verdickt, um sich auf einen möglichen Embryo vorzubereiten, entwickelt sich möglicherweise nicht mehr so optimal wie früher. Diese Veränderung kann die Wahrscheinlichkeit einer erfolgreichen Einnistung verringern, selbst wenn ein gesunder Embryo vorhanden ist. Das Gefäßsystem in der Gebärmutter kann ebenfalls altersbedingt beeinträchtigt werden, wodurch die Durchblutung der Gebärmutterschleimhaut abnimmt. Eine ausreichende Durchblutung ist für eine empfängliche Gebärmutter, die einen Embryo unterstützen kann, unerlässlich. Eine verminderte Durchblutung kann daher die Fruchtbarkeit verringern und das Risiko einer frühen Fehlgeburt erhöhen.
5. Höheres Risiko von Schwangerschaftskomplikationen
Ältere Frauen, die auf natürlichem Wege oder mit Hilfe schwanger werden, haben ein höheres Risiko für Schwangerschaftskomplikationen. Zu diesen Komplikationen gehören:
Schwangerschaftsdiabetes: Bei Frauen über 35 besteht ein erhöhtes Risiko, an Schwangerschaftsdiabetes zu erkranken, der sowohl die Gesundheit der Mutter als auch des Fötus beeinträchtigen kann.
Bluthochdruck und Präeklampsie: Bluthochdruck und Präeklampsie (eine potenziell gefährliche Schwangerschaftskomplikation, die durch hohen Blutdruck gekennzeichnet ist) treten bei älteren Müttern häufiger auf.
Placenta praevia: Bei Frauen über 35 besteht ein erhöhtes Risiko einer Placenta praevia. Dabei bedeckt die Plazenta den Gebärmutterhals, was zu Komplikationen bei der Entbindung führen kann.
Frühgeburt: Bei Frauen über 35 besteht ein höheres Risiko einer Frühgeburt, die die Gesundheit des Babys beeinträchtigen kann.
Diese Schwangerschaftskomplikationen haben zwar keinen direkten Einfluss auf die Fähigkeit, schwanger zu werden, unterstreichen jedoch die zusätzlichen Gesundheitsrisiken, denen Frauen ausgesetzt sind, die in einem höheren Alter versuchen, schwanger zu werden. Das Alter beeinflusst nicht nur die natürliche Empfängnis, sondern auch die Erfolgsraten assistierter Reproduktionstechniken wie IVF. Frauen unter 35 haben im Allgemeinen höhere Erfolgsraten mit IVF als Frauen über 40. Mit 43 Jahren sinkt die Erfolgsrate von IVF mit den eigenen Eizellen einer Frau erheblich, hauptsächlich aufgrund der geringeren Menge und Qualität der Eizellen. Um ihre Chancen zu erhöhen, entscheiden sich einige ältere Frauen für die Verwendung von Spendereizellen einer jüngeren Frau, was die Erfolgsraten erheblich verbessert, da Spendereizellen normalerweise von höherer Qualität sind. Der Prozess der Eizellspende ist jedoch teuer und erfordert sorgfältige Überlegung und Vorbereitung.
Möglichkeiten zur Fruchtbarkeitserhaltung: Einfrieren von Eizellen und Embryonen
Da die Fruchtbarkeit mit dem Alter abnimmt, entscheiden sich manche Frauen dafür, ihre Fruchtbarkeit durch das Einfrieren von Eizellen oder Embryonen (Kryokonservierung) in jungen Jahren zu bewahren, insbesondere dann, wenn sie eine Schwangerschaft hinauszögern möchten.
Einfrieren von Eizellen: Bei diesem Verfahren werden die Eierstöcke zur Produktion mehrerer Eizellen angeregt, die dann entnommen und für die spätere Verwendung eingefroren werden. Durch das Einfrieren von Eizellen können Frauen jüngere, gesündere Eizellen verwenden, wenn sie schwanger werden möchten, was ihre Chancen auf eine erfolgreiche Schwangerschaft im späteren Leben erhöht.
Embryo-Einfrieren: Ähnlich wie beim Einfrieren von Eizellen werden bei diesem Verfahren die entnommenen Eizellen vor dem Einfrieren mit Sperma befruchtet. Diese Option wird häufig von Frauen gewählt, die in einer festen Beziehung leben und Embryonen für eine spätere Implantation bereithalten möchten.
Diese Techniken bieten Optionen für Frauen, die eine Schwangerschaft hinauszögern und dabei die Qualität ihrer Eizellen oder Embryonen bewahren möchten. Obwohl das Alter ein wichtiger Faktor für die Fruchtbarkeit ist, bieten medizinische Fortschritte wie ART, das Einfrieren von Eizellen und Embryonen Möglichkeiten, Frauen zu helfen, später im Leben schwanger zu werden. Das Verständnis der Auswirkungen des Alters auf die Fruchtbarkeit kann Frauen dabei helfen, fundierte Entscheidungen hinsichtlich der Fortpflanzung zu treffen und frühzeitig Hilfe zu suchen, wenn sie planen, in einem höheren Alter schwanger zu werden.
6- Probleme mit dem Immunsystem
Immunprobleme können die Fruchtbarkeit von Frauen erheblich beeinträchtigen und häufig zu unerklärlicher Unfruchtbarkeit, wiederholten Fehlgeburten oder Schwangerschaftskomplikationen führen. Das Immunsystem soll den Körper vor Infektionen und Fremdkörpern schützen, aber in manchen Fällen können Immunreaktionen die Fruchtbarkeit beeinträchtigen, indem sie sich gegen Fortpflanzungszellen, -gewebe oder sogar den Embryo richten. Diese immunbedingten Fruchtbarkeitsprobleme können durch Autoimmunerkrankungen, Immunreaktionen auf Spermien oder Embryonen oder eine abnormale Aktivierung des Immunsystems verursacht werden.
1. Autoimmunerkrankungen und Unfruchtbarkeit
Bei Autoimmunerkrankungen greift das Immunsystem fälschlicherweise körpereigenes Gewebe an, als ob es sich um Fremdkörper handeln würde. Mehrere Autoimmunerkrankungen stehen mit Unfruchtbarkeit in Zusammenhang:
Systemischer Lupus erythematodes (SLE): Lupus ist eine Autoimmunerkrankung, die Entzündungen im gesamten Körper, einschließlich der Geschlechtsorgane, verursachen kann. Frauen mit Lupus können aufgrund von Angriffen des Immunsystems auf die Gebärmutter oder die Plazenta Menstruationsunregelmäßigkeiten, wiederholte Fehlgeburten oder Frühgeburten erleben.
Antiphospholipid-Syndrom (APS): APS ist eine Autoimmunerkrankung, bei der das Immunsystem Antikörper gegen Phospholipide, Moleküle in Zellmembranen, produziert. Sie ist häufig mit wiederholten Fehlgeburten verbunden. Diese Antiphospholipid-Antikörper können zur Bildung von Blutgerinnseln in der Plazenta führen, wodurch die Blutzufuhr zum Fötus unterbrochen wird und es zu einer Fehlgeburt kommt. APS ist auch mit anderen Komplikationen verbunden, wie Präeklampsie und Frühgeburten.
Hashimoto-Thyreoiditis und Morbus Basedow: Beides sind Autoimmunerkrankungen der Schilddrüse, bei denen das Immunsystem die Schilddrüse angreift und die Produktion von Schilddrüsenhormonen entweder verringert (Hashimoto-Thyreoiditis) oder erhöht (Morbus Basedow). Schilddrüsenhormone spielen eine entscheidende Rolle bei der Regulierung des Menstruationszyklus und der Schwangerschaftsförderung. Frauen mit Schilddrüsenerkrankungen leiden häufig unter Menstruationsunregelmäßigkeiten, Problemen mit dem Eisprung und einem höheren Risiko einer Fehlgeburt.
Rheumatoide Arthritis (RA) und andere Autoimmunerkrankungen: RA und ähnliche Autoimmunerkrankungen können entzündliche Zustände hervorrufen, die den Eisprung, die Embryoimplantation und den Erhalt der Schwangerschaft beeinträchtigen. Darüber hinaus können einige Medikamente zur Behandlung von Autoimmunerkrankungen die Fruchtbarkeit beeinträchtigen.
2. Anti-Spermien-Antikörper
In manchen Fällen kann das Immunsystem einer Frau Antikörper produzieren, die sich speziell gegen Spermien richten. Diese Reaktion kann auftreten, wenn Spermien durch ein Trauma, eine Infektion oder eine Operation dem Immunsystem ausgesetzt werden. Die Antikörper können die Spermienmotilität beeinträchtigen (was das Schwimmen erschwert), sich an die Oberfläche der Spermien binden oder diese sogar vollständig zerstören und so eine Befruchtung verhindern. Anti-Spermien-Antikörper finden sich normalerweise im Zervixschleim, sie können aber auch in anderen Bereichen des Fortpflanzungssystems vorhanden sein. Frauen mit Anti-Spermien-Antikörpern benötigen möglicherweise Behandlungen wie eine intrauterine Insemination (IUI) oder eine In-vitro-Fertilisation (IVF), um den Zervixschleim zu umgehen und die Chancen auf eine Empfängnis zu verbessern.
3. Anti-Ovarial-Antikörper
Anti-Ovarial-Antikörper sind Antikörper, die das Eierstockgewebe angreifen und sich gegen Bestandteile wie Eizellen, Rezeptoren für das follikelstimulierende Hormon (FSH) oder die Strukturen richten, die die Eizellenentwicklung unterstützen. Diese Immunreaktion kann die Funktion der Eierstöcke beeinträchtigen, die Qualität der Eizellen mindern und zu vorzeitiger Alterung oder Versagen der Eierstöcke führen (bekannt als primäre Ovarialinsuffizienz oder POI). Frauen mit Anti-Ovarial-Antikörpern können unregelmäßige Menstruationszyklen, Anovulation (Ausbleiben des Eisprungs) oder verminderte ovarielle Reserve aufweisen, was alles die Fruchtbarkeit verringern und eine Empfängnis erschweren kann. Autoimmunbedingtes Ovarialversagen wird manchmal mit anderen Autoimmunerkrankungen wie Morbus Addison, Lupus oder Schilddrüsenerkrankungen in Verbindung gebracht.
4. Endometriose und Entzündungen
Endometriose ist eine Erkrankung, bei der Gewebe, das der Gebärmutterschleimhaut (Endometrium) ähnelt, außerhalb der Gebärmutter wächst, häufig an den Eierstöcken, Eileitern und anderen Beckenorganen. Obwohl Endometriose strenggenommen keine Autoimmunerkrankung ist, wurde festgestellt, dass sie mit einer Funktionsstörung des Immunsystems und chronischen Entzündungen einhergeht. Bei Frauen mit Endometriose kann das Immunsystem das fehlplatzierte Endometriumgewebe nicht beseitigen, was zu einer anhaltenden Entzündung führt. Diese entzündliche Umgebung kann die Eizellenqualität beeinträchtigen, den Eisprung stören und Verwachsungen (Narbengewebe) bilden, die die Eileiter blockieren oder schädigen. Die mit Endometriose verbundenen Entzündungen und Immunaktivitäten können auch eine feindliche Umgebung für Spermien, Eizellen und Embryonen schaffen, was eine erfolgreiche Schwangerschaft erschwert.
5. Natürliche Killerzellen (NK-Zellen) und Implantationsversagen
Natürliche Killerzellen (NK-Zellen) sind Immunzellen, die eine wichtige Rolle in den Abwehrmechanismen des Körpers spielen, einschließlich der Regulierung von Immunreaktionen in der Gebärmutter. In einer typischen Schwangerschaft unterstützen NK-Zellen in der Gebärmutter die Einnistung, indem sie den Blutfluss zum sich entwickelnden Embryo fördern. Einige Frauen können jedoch erhöhte NK-Zellwerte oder abnormal aktivierte NK-Zellen aufweisen, die den Embryo angreifen, was zu Implantationsfehlern oder einem frühen Schwangerschaftsverlust führen kann. Eine erhöhte NK-Zellaktivität wird mit wiederholten Fehlgeburten in Verbindung gebracht und kann zu unerklärlicher Unfruchtbarkeit beitragen. Die Prüfung auf NK-Zellaktivität ist umstritten, da sich nicht alle Forscher über ihre Auswirkungen auf die Fruchtbarkeit einig sind, aber einige Fruchtbarkeitsspezialisten bieten möglicherweise immunmodulierende Behandlungen wie Steroide oder intravenöse Immunglobuline (IVIG) an, um die NK-Zellaktivität zu verringern und den Implantationserfolg zu verbessern.
6. Zytokin-Ungleichgewicht und Entzündungsreaktion
Zytokine sind kleine Proteine, die von Immunzellen produziert werden und eine Rolle bei der Zellsignalisierung und Immunregulierung spielen. Während der frühen Schwangerschaft ist eine ausgeglichene Zytokinumgebung notwendig, um die Embryoimplantation und die frühe fetale Entwicklung zu unterstützen. Ein Ungleichgewicht der Zytokine – insbesondere ein Anstieg entzündungsfördernder Zytokine – kann diesen Prozess jedoch stören. Bei Frauen mit immunbedingter Unfruchtbarkeit können erhöhte Konzentrationen entzündungsfördernder Zytokine ein ungünstiges Uterusmilieu schaffen, was die Chancen der Embryoimplantation verringert oder das Risiko einer Fehlgeburt erhöht. Erkrankungen wie Autoimmunerkrankungen, Infektionen oder chronische Entzündungen können zu einem Zytokinungleichgewicht führen, das zu Unfruchtbarkeit oder wiederholten Fehlgeburten beitragen kann.
7. Immunantwort auf die Plazenta
Die Plazenta, die den sich entwickelnden Fötus ernährt, ist für eine erfolgreiche Schwangerschaft von entscheidender Bedeutung. Während einer normalen Schwangerschaft toleriert das mütterliche Immunsystem die Plazenta, die genetisches Material sowohl der Mutter als auch des Vaters enthält. Bei manchen Frauen kann das Immunsystem die Plazenta jedoch als fremd betrachten und eine Immunreaktion dagegen auslösen. Diese Immunreaktion kann den Blutfluss zur Plazenta einschränken und das Risiko einer Fehlgeburt, Präeklampsie, intrauteriner Wachstumsverzögerung und anderer Schwangerschaftskomplikationen erhöhen. Erkrankungen wie APS (Antiphospholipid-Syndrom) sind klassische Beispiele, bei denen Immunreaktionen die Funktion der Plazenta beeinträchtigen und zu einem Schwangerschaftsverlust führen können.
8. Immunologische Implantationsstörung
Bei manchen Frauen mit unerklärlicher Unfruchtbarkeit kann es zu einer sogenannten immunologischen Implantationsstörung kommen. Dieser Begriff bezeichnet eine überaktive oder unangemessene Immunreaktion, die die erfolgreiche Einnistung eines Embryos in die Gebärmutter verhindert, selbst wenn sowohl der Embryo als auch die Gebärmutterschleimhaut gesund sind. Die immunologische Implantationsstörung ist noch immer ein Forschungsgebiet, aber man geht davon aus, dass sie mit einer abnormalen Aktivität von Immunzellen, einschließlich NK-Zellen, T-Zellen und Makrophagen, oder einem Ungleichgewicht der immunmodulierenden Faktoren in der Gebärmutter einhergeht. Behandlungsmöglichkeiten werden noch entwickelt, aber einige Fruchtbarkeitsspezialisten verwenden möglicherweise Kortikosteroide, IVIG oder andere immunmodulierende Therapien, um den Implantationserfolg zu verbessern.
Diagnostische Tests für immunbedingte Unfruchtbarkeit
Die Untersuchung auf immunbedingte Unfruchtbarkeit kann je nach vermutetem Immunproblem auf verschiedene Weise erfolgen:
Blutuntersuchungen: Blutuntersuchungen können bestimmte Antikörper (z. B. Antikörper gegen Spermien, Antikörper gegen Eierstöcke, Antiphospholipid-Antikörper) nachweisen und den Spiegel oder die Aktivität von Immunzellen messen.
NK-Zell-Assays: Diese Tests messen die Konzentration und Aktivität von natürlichen Killerzellen im Blut oder in der Gebärmutter, ihr klinischer Nutzen ist jedoch noch immer umstritten.
Zytokinprofil-Test: Dieser Test misst die Werte entzündungsfördernder und entzündungshemmender Zytokine, um das Immungleichgewicht zu beurteilen, insbesondere bei Frauen mit wiederholten Fehlgeburten.
Hysteroskopie oder Biopsie: Eine Hysteroskopie (Betrachtung der Gebärmutter mit einer Kamera) oder eine Endometriumbiopsie kann durchgeführt werden, um Entzündungen oder Immunaktivität direkt in der Gebärmutter zu beurteilen.
Behandlungsmöglichkeiten für immunbedingte Unfruchtbarkeit
Behandlungen bei immunbedingter Unfruchtbarkeit zielen darauf ab, das spezifische Immunproblem anzugehen und die Chancen auf eine erfolgreiche Schwangerschaft zu verbessern:
Immunmodulatorische Medikamente:
• Kortikosteroide: Niedrig dosierte Steroide wie Prednison können verwendet werden, um die Immunaktivität und Entzündung zu reduzieren, insbesondere in Fällen einer Erhöhung der NK-Zellen oder eines immunbedingten Implantationsversagens.
• Intravenöses Immunglobulin (IVIG): IVIG wird in einigen Fällen verwendet, um abnormale Immunreaktionen zu unterdrücken, insbesondere bei Frauen mit wiederholten Fehlgeburten oder erhöhter NK-Zellzahl, obwohl seine Verwendung immer noch experimentell ist.
• Niedermolekulares Heparin (LMWH) und Aspirin: Bei APS oder Gerinnungsstörungen können blutverdünnende Medikamente wie Heparin und Aspirin das Risiko von Blutgerinnseln verringern, die Gesundheit der Plazenta unterstützen und das Risiko einer Fehlgeburt verringern.
Antibiotika gegen Infektionen: Bei Gebärmutterhalsentzündungen oder leichten Infektionen können Antibiotika die Entzündungen im Fortpflanzungssystem lindern und so möglicherweise die Fruchtbarkeit verbessern.
Techniken der assistierten Reproduktion (ART):
In Fällen, in denen Immunprobleme eine natürliche Empfängnis beeinträchtigen, können ART-Optionen wie IVF einige Immunbarrieren umgehen, indem sie eine Befruchtung außerhalb des Körpers ermöglichen. Techniken wie die intrazytoplasmatische Spermieninjektion (ICSI) können bei Anti-Spermien-Antikörpern eingesetzt werden, und ein Embryotransfer kann feindseligen Zervixschleim oder abnormale Immunreaktionen am Gebärmutterhals umgehen.
7- Thrombophilie-Defekte
Thrombophilie, eine Erkrankung, die durch eine erhöhte Neigung zur Bildung von Blutgerinnseln gekennzeichnet ist, kann die Fruchtbarkeit von Frauen erheblich beeinträchtigen, insbesondere durch Beeinträchtigung der Einnistung und Erhöhung des Risikos von Schwangerschaftskomplikationen. Thrombophilie kann entweder vererbt (genetisch) oder erworben sein und geht häufig mit Anomalien der Blutgerinnungsmechanismen einher. Obwohl Thrombophilie selbst nicht direkt eine Empfängnis verhindert, kann sie eine Umgebung schaffen, die den Verlauf einer Schwangerschaft erschwert, was zu wiederholten Fehlgeburten, Komplikationen während der Schwangerschaft und in einigen Fällen zu Problemen mit der Einnistung führen kann.
Arten von Thrombophilie und ihre Auswirkungen auf die Fruchtbarkeit
Thrombophilie kann durch genetische Mutationen oder erworbene Erkrankungen verursacht werden, die die Blutgerinnung beeinträchtigen. Zu den häufigsten Arten von Thrombophilie, die mit Unfruchtbarkeit und Schwangerschaftsverlust in Verbindung gebracht werden, gehören:
Vererbte Thrombophilien:
A) Faktor V Leiden Mutation: Diese Mutation macht das Blut anfälliger für die Blutgerinnung, indem sie die Funktion des Gerinnungsfaktors V, eines Proteins im Blut, verändert. Frauen mit dieser Mutation haben eine
B) Prothrombin-Genmutation (G20210A): Diese Mutation erhöht den Spiegel von Prothrombin, einem anderen Gerinnungsprotein, was zu einem höheren Risiko für Blutgerinnsel und damit verbundene Schwangerschaftsverluste führt.
C) Protein C-, Protein S- und Antithrombinmangel: Dies sind seltene Erbkrankheiten, die die Fähigkeit des Körpers zur Regulierung der Blutgerinnung verringern. Ein Mangel an diesen Proteinen erhöht das Risiko abnormaler Blutgerinnsel und Komplikationen während der Schwangerschaft.
Erworbene Thrombophilie:
A) Antiphospholipid-Syndrom (APS): APS ist eine Autoimmunerkrankung, bei der das Immunsystem Antikörper gegen Phospholipide produziert, Moleküle in Zellmembranen. APS wird eng mit Unfruchtbarkeit und wiederholten Fehlgeburten in Verbindung gebracht, da die Antikörper zu Blutgerinnseln in der Plazenta führen, was den Blutfluss zum Fötus verringert und zu einer Fehlgeburt führt.
B) Hyperhomocysteinämie: Erhöhte Homocysteinwerte (eine Aminosäure) im Blut können das Risiko von Blutgerinnseln erhöhen und stehen im Zusammenhang mit Fehlgeburten und Plazentaproblemen. Hyperhomocysteinämie wird manchmal mit MTHFR-Genmutationen in Verbindung gebracht.
Wie sich Thrombophilie auf die Implantation und die frühe Schwangerschaft auswirkt
Die Blutgerinnung spielt in der Frühschwangerschaft eine entscheidende Rolle, insbesondere bei der Bildung der Plazenta, die den Embryo trägt. Thrombophilie kann diese Prozesse auf verschiedene Weise beeinträchtigen.
Thrombophilie kann zur Bildung von Mikrogerinnseln in den Blutgefäßen der Gebärmutter und der Plazenta führen. Diese Gerinnsel können den Blutfluss zum Endometrium (Gebärmutterschleimhaut) und zur sich entwickelnden Plazenta einschränken, wodurch dem Embryo wichtige Nährstoffe und Sauerstoff entzogen werden. In den frühen Stadien der Schwangerschaft kann eine unzureichende Durchblutung eine ordnungsgemäße Einnistung verhindern und zu einer Fehlgeburt führen.
Die Einnistung, bei der sich der Embryo in der Gebärmutterschleimhaut festsetzt, erfordert eine gesunde Blutversorgung und gut funktionierende Blutgefäße. Wenn Blutgerinnsel den Blutfluss zur Gebärmutter unterbrechen, kann dies eine unwirtliche Umgebung für den Embryo schaffen und die Wahrscheinlichkeit einer erfolgreichen Einnistung verringern. Frauen mit Thrombophilie können aufgrund wiederholter Implantationsfehler unter unerklärlicher Unfruchtbarkeit leiden, selbst wenn eine Befruchtung erfolgt.
Thrombophilie ist ein bekannter Risikofaktor für wiederholte Fehlgeburten, definiert als zwei oder mehr aufeinanderfolgende Schwangerschaftsverluste. Blutgerinnsel, die sich in den Blutgefäßen der Plazenta bilden, können zu einer Plazentainsuffizienz führen, bei der die Plazenta den sich entwickelnden Embryo oder Fötus nicht ausreichend versorgen kann. Dies kann zu Folgendem führen:
Frühe Fehlgeburt: Viele Frauen mit Thrombophilie erleiden innerhalb des ersten Trimesters eine Fehlgeburt, da sich in den winzigen Blutgefäßen der Plazenta Blutgerinnsel bilden und die Blutversorgung des Embryos unterbrechen.
Verlust im zweiten Trimester: Thrombophilie kann aufgrund der schlechten Entwicklung der Plazenta und Durchblutung auch zu einem Schwangerschaftsverlust im zweiten Trimester führen, was zu einer Einschränkung des fetalen Wachstums oder einer Plazentaablösung (bei der sich die Plazenta von der Gebärmutterwand löst) führen kann.
Totgeburt: In seltenen Fällen kann Thrombophilie zu einer Totgeburt beitragen, wenn die Blutzufuhr zum Fötus im späteren Stadium der Schwangerschaft stark eingeschränkt ist.
Diagnostische Tests auf Thrombophilie bei Unfruchtbarkeit
Frauen, die wiederholt Fehlgeburten, unerklärliche Unfruchtbarkeit oder Schwangerschaftskomplikationen erleiden, können auf Thrombophilie getestet werden. Zu den üblichen Tests gehören:
• Blutgerinnungstests: Diese Tests messen die Werte von Gerinnungsfaktoren und Proteinen im Blut, wie etwa Faktor V Leiden, Prothrombin, Protein C, Protein S und Antithrombin.
• Antiphospholipid-Antikörpertest: Dieser Test prüft auf das Vorhandensein von Antiphospholipid-Antikörpern, die mit APS in Zusammenhang stehen. Der Test kann Anticardiolipin-Antikörper, Lupus-Antikoagulans und Beta-2-Glykoprotein-I-Antikörper umfassen.
• Homocysteinspiegel: Erhöhte Homocysteinwerte stehen im Zusammenhang mit Gerinnungsstörungen und können auf eine zugrunde liegende genetische Mutation, wie beispielsweise eine MTHFR-Mutation, hinweisen.
Bei richtiger Behandlung, einschließlich Antikoagulanzientherapie und engmaschiger Überwachung, können viele Frauen mit Thrombophilie erfolgreich schwanger werden und eine gesunde Schwangerschaft austragen. Eine frühe Diagnose und Behandlung sind der Schlüssel zur Reduzierung der mit Thrombophilie verbundenen Risiken und zur Verbesserung der Fruchtbarkeitsergebnisse.
8- Lebensstilfaktoren und Umweltbelastungen
Lebensstilfaktoren haben einen erheblichen Einfluss auf die weibliche Fruchtbarkeit, da sie den Eisprung, die Eiqualität, den Hormonspiegel und die allgemeine reproduktive Gesundheit beeinflussen. Zu den wichtigsten Lebensstilfaktoren, die die Fruchtbarkeit beeinträchtigen können, gehören Ernährung, Gewicht, körperliche Aktivität, Stress, Rauchen, Alkoholkonsum und die Belastung durch Umweltgifte.
1. Diät und Ernährung
Eine ausgewogene Ernährung, die wichtige Nährstoffe liefert, ist für die reproduktive Gesundheit von entscheidender Bedeutung. Bestimmte Nährstoffe, Vitamine und Mineralien unterstützen den Eisprung, die Hormonproduktion und die Eizellenqualität. Eine schlechte Ernährung oder bestimmte Mängel können diese Prozesse stören und die Fruchtbarkeit beeinträchtigen:
Antioxidantien: Lebensmittel, die reich an Antioxidantien sind (wie etwa Vitamin C und E, Folsäure und Beta-Carotin), helfen, Eier vor oxidativem Stress zu schützen, der die Eierqualität beeinträchtigen kann.
Folsäure: Dieses B-Vitamin ist entscheidend für die DNA-Synthese und Zellteilung und damit wesentlich für die Eiqualität und Embryonalentwicklung.
Eisen: Eisenmangel kann zu Eisprungproblemen führen, da Eisen für die Blutproduktion und den Sauerstofftransport wichtig ist.
Gesunde Fette: Omega-3-Fettsäuren, die in Fisch, Leinsamen und Walnüssen enthalten sind, helfen, Entzündungen zu reduzieren und die Hormonproduktion zu unterstützen. Transfette, die häufig in verarbeiteten Lebensmitteln enthalten sind, können den Eisprung negativ beeinflussen und sollten vermieden werden.
Hoher Zucker- und verarbeiteter Lebensmittelanteil: Eine Ernährung mit hohem Zucker- und verarbeitetem Lebensmittelanteil kann zu Insulinresistenz und hormonellen Ungleichgewichten führen, welche den Eisprung beeinträchtigen können.
Eine gesunde, nährstoffreiche Ernährung unterstützt einen regelmäßigen Menstruationszyklus, verbessert die Eizellenqualität und schafft ein günstiges Umfeld für die Empfängnis.
2. Körpergewicht und Fruchtbarkeit
Das Körpergewicht hat erhebliche Auswirkungen auf die Fruchtbarkeit. Sowohl Unter- als auch Übergewicht können zu hormonellen Ungleichgewichten führen, die den Eisprung und die Regelmäßigkeit der Menstruation stören:
Untergewicht: Bei Frauen mit einem sehr niedrigen Body-Mass-Index (BMI) kann es aufgrund eines niedrigen Östrogenspiegels zu unregelmäßigen oder ausbleibenden Perioden (Amenorrhoe) kommen. Östrogen ist für den Eisprung und einen gesunden Menstruationszyklus unerlässlich, und ein Mangel an Körperfett kann seine Produktion beeinträchtigen.
Übergewicht/Adipositas: Übergewicht, insbesondere im Bauchbereich, steht im Zusammenhang mit hormonellen Ungleichgewichten und Erkrankungen wie dem polyzystischen Ovarialsyndrom (PCOS), die den Eisprung behindern können. Fettleibigkeit kann zu Insulinresistenz, erhöhten Androgenspiegeln und verminderter Fruchtbarkeit führen. Studien deuten darauf hin, dass sogar eine Gewichtsreduktion von 5-10% den Eisprung verbessern und die Wahrscheinlichkeit einer Empfängnis erhöhen kann.
Die Aufrechterhaltung eines gesunden Körpergewichts ist eine der wirksamsten Möglichkeiten zur Optimierung der Fruchtbarkeit und Verbesserung der Fortpflanzungsergebnisse.
3. Körperliche Aktivität
Regelmäßige körperliche Betätigung fördert die allgemeine Gesundheit, die Hormonregulierung und die Gewichtskontrolle. Die Auswirkungen von Bewegung auf die Fruchtbarkeit können jedoch von der Intensität abhängen:
• Mäßige körperliche Betätigung: Mäßige, regelmäßige körperliche Betätigung kann die Fruchtbarkeit verbessern, indem sie das Gewicht reguliert, Stress reduziert und die Durchblutung der Fortpflanzungsorgane verbessert. Sie wird im Allgemeinen für Frauen empfohlen, die schwanger werden möchten.
• Übermäßiges Training: Intensives, belastungsintensives Training kann zu hormonellen Ungleichgewichten führen, insbesondere bei Frauen mit geringem Körperfettanteil. Übermäßiges Training kann zu einem Rückgang des Östrogenspiegels führen, den Menstruationszyklus stören und in schweren Fällen zu hypothalamischer Amenorrhoe (Ausbleiben der Periode aufgrund unzureichender Hormonproduktion) führen.
Ein ausgewogenes körperliches Aktivitätsniveau ist der Schlüssel zur Unterstützung der reproduktiven Gesundheit. Der Schwerpunkt liegt dabei auf moderaten und regelmäßigen Trainingsroutinen.
4. Stress und emotionales Wohlbefinden
Chronischer Stress kann sich negativ auf die Fruchtbarkeit auswirken, indem er den Hormonhaushalt und den Eisprung stört. Hohe Stresslevel erhöhen die Produktion von Cortisol, einem Hormon, das mit Fortpflanzungshormonen wie GnRH (Gonadotropin-Releasing-Hormon), das den Eisprung reguliert, in Konflikt geraten kann. Stress wird auch mit ungesunden Bewältigungsverhalten wie schlechter Ernährung, Schlafmangel und körperlicher Inaktivität in Verbindung gebracht, was die Fruchtbarkeit weiter beeinträchtigen kann. Darüber hinaus kann die emotionale Belastung durch Stress die Empfängnis erschweren und sogar zu einem Kreislauf aus Stress und Unfruchtbarkeit beitragen. Achtsamkeitsübungen, Beratung und Stressbewältigungstechniken wie Yoga, Meditation oder Therapie können für Frauen mit Kinderwunsch von Vorteil sein.
5. Rauchen
Rauchen ist einer der schädlichsten Lebensstilfaktoren, die die Fruchtbarkeit beeinträchtigen. Tabak enthält giftige Chemikalien wie Nikotin, Kohlenmonoxid und Teer, die die reproduktive Gesundheit auf vielfältige Weise beeinträchtigen können:
• Eizellenqualität: Rauchen beschleunigt den Verlust der Eizellen und schädigt ihre Qualität, was zu einem höheren Risiko von Chromosomenanomalien führt.
• Eisprung: Bei Rauchern ist die Wahrscheinlichkeit höher, dass sie Probleme mit dem Eisprung haben, was eine Schwangerschaft erschwert.
• Gesundheit der Gebärmutter: Rauchen beeinträchtigt die Durchblutung der Gebärmutter und schafft möglicherweise ein ungünstiges Umfeld für die Einnistung des Embryos.
• Frühe Menopause: Frauen, die rauchen, erreichen die Menopause oft 1–4 Jahre früher als Nichtraucherinnen, wodurch ihre fruchtbare Phase verkürzt wird.
Auch Passivrauchen kann die Fruchtbarkeit beeinträchtigen. Mit dem Rauchen aufzuhören ist eine der besten Veränderungen, die eine Frau vornehmen kann, um ihre Chancen auf eine Schwangerschaft zu verbessern.
6. Alkoholkonsum
Übermäßiger Alkoholkonsum kann die Fruchtbarkeit und den Schwangerschaftsverlauf beeinträchtigen:
• Eisprung und hormonelles Ungleichgewicht: Hoher Alkoholkonsum kann die Produktion der für den Eisprung und die Regelmäßigkeit der Menstruation notwendigen Hormone beeinträchtigen und so das Risiko von Unfruchtbarkeit erhöhen.
• Geringere Fruchtbarkeitsraten: Studien legen nahe, dass bei Frauen mit hohem Alkoholkonsum die Fruchtbarkeitsraten im Vergleich zu Frauen mit mäßigem Alkoholkonsum oder Nichttrinkern möglicherweise geringer sind.
• Risiken während der Schwangerschaft: Alkoholkonsum kann die frühe Schwangerschaft beeinträchtigen und das Risiko einer Fehlgeburt und von Entwicklungsstörungen des Fötus erhöhen.
Obwohl ein mäßiger Alkoholkonsum nur geringe Auswirkungen haben kann, wird Frauen mit Kinderwunsch generell empfohlen, auf den Alkoholkonsum zu verzichten oder diesen zu reduzieren.
7. Koffeinaufnahme
Während eine moderate Koffeinaufnahme (z. B. bis zu 200 mg pro Tag oder etwa eine 12-Unzen-Kaffee) im Allgemeinen als unbedenklich gilt, kann ein hoher Koffeinkonsum die Fruchtbarkeit negativ beeinflussen:
• Verzögerte Empfängnis: Einige Studien haben gezeigt, dass eine hohe Koffeinaufnahme mit einer Verzögerung der Empfängnis oder einem erhöhten Risiko einer Fehlgeburt verbunden sein kann.
• Verringerte Aufnahme bestimmter Nährstoffe: Übermäßiger Koffeinkonsum kann die Aufnahme wichtiger Nährstoffe wie Kalzium und Eisen beeinträchtigen, die für die reproduktive Gesundheit wichtig sind.
Die meisten Gesundheitsexperten empfehlen, den Koffeinkonsum bei Kinderwunsch einzuschränken.
8. Umweltgifte und chemische Belastung
Die Belastung durch Umweltgifte, darunter bestimmte Chemikalien, Schadstoffe und Chemikalien mit endokriner Wirkung, kann die Fruchtbarkeit beeinträchtigen:
• Endokrine Disruptoren: Chemikalien wie Bisphenol A (BPA), Phthalate und Pestizide können natürliche Hormone nachahmen oder blockieren, was zu hormonellen Ungleichgewichten führt, die den Eisprung, den Menstruationszyklus und die allgemeine Fortpflanzungsfunktion stören.
• Schwermetalle: Der Kontakt mit Schwermetallen wie Blei und Quecksilber kann die Funktion der Eierstöcke beeinträchtigen, die Qualität der Eizellen vermindern und den Menstruationszyklus stören.
• Berufsbedingte Gefahren: Frauen, die in bestimmten Branchen wie der Landwirtschaft, der Fertigung oder in Laboren arbeiten, können Chemikalien und Strahlung ausgesetzt sein, die sich negativ auf die Fruchtbarkeit auswirken.
Die Verringerung der Belastung durch Umweltgifte – etwa durch die Vermeidung von Plastikbehältern mit BPA, die Wahl von Bio-Lebensmitteln, wenn möglich, und die Minimierung der Verwendung bestimmter Kosmetika – kann zur Unterstützung der reproduktiven Gesundheit beitragen.
9. Schlafmuster und zirkadianer Rhythmus
Schlechte Schlafgewohnheiten und unregelmäßige Schlafmuster können die Fruchtbarkeit beeinträchtigen, indem sie den Hormonspiegel stören, insbesondere den der Fortpflanzungshormone, die den Eisprung und den Menstruationszyklus regulieren:
• Melatonin und reproduktive Gesundheit: Melatonin, ein mit dem Schlaf verbundenes Hormon, wirkt auch als Antioxidans, das die Eizellen vor Schäden schützt. Bei Frauen mit unzureichendem oder schlechtem Schlaf kann es zu einem reduzierten Melatoninspiegel kommen, was sich möglicherweise auf die Gesundheit der Eizellen auswirkt.
• Schichtarbeit: Bei Frauen, die Nachtschichten arbeiten oder unregelmäßige Arbeitszeiten haben, kann es zu Störungen des zirkadianen Rhythmus kommen, was zu Menstruationsunregelmäßigkeiten und verminderter Fruchtbarkeit führen kann.
Das Einhalten gleichbleibender Schlafmuster und das Anstreben von 7–8 Stunden Schlaf pro Nacht können das hormonelle Gleichgewicht und die reproduktive Gesundheit unterstützen.
10. Freizeitdrogenkonsum
Der Konsum von Freizeitdrogen wie Marihuana, Kokain und anderen Substanzen kann schädliche Auswirkungen auf die Fruchtbarkeit haben:
• Hormonelles Ungleichgewicht: Viele Freizeitdrogen stören die hormonellen Signale, die für den Eisprung und die Regelmäßigkeit der Menstruation notwendig sind.
• Eizellenqualität und Eisprung: Bestimmte Medikamente, insbesondere Marihuana, werden mit Störungen des Eisprungs und einer verringerten Eizellenqualität in Verbindung gebracht.
• Schwangerschaftskomplikationen: Drogenkonsum während der Empfängnis oder Schwangerschaft kann zu Fehlgeburten, Geburtsfehlern und Entwicklungsstörungen beim Fötus führen.
Um die Fruchtbarkeit zu optimieren und die mit einer Schwangerschaft verbundenen Risiken zu verringern, ist es wichtig, Freizeitdrogen zu vermeiden.
IVF-Zentrum Nordzypern
Das IVF-Zentrum Nordzypern ist eine patientenorientierte Fruchtbarkeitsklinik mit Sitz in „Elite-Forschungs- und Chirurgiekrankenhaus“ in Nikosia, Zypern. Unsere Klinik ist eine der fortschrittlichsten Fruchtbarkeitskliniken der Welt und bietet eine größere Auswahl an Behandlungsmöglichkeiten zu erschwinglichen Preisen.
Kontakt
Telefon
Englisch: +90 548 875 8000
Französisch: +90 548 876 8000
Türkisch: +90 542 869 8000
Arabisch: +90 548 875 8000
Deutsch: +90 548 830 1987
Russisch: +90 548 828 9955
info@northcyprusivf.net
© 2020 LowCostIVF – Alle Rechte vorbehalten. Datenschutz-Bestimmungen

