- Di
- Blog
- Infertilità
- Trattamenti di fecondazione in vitro
- Nuovi progressi della fecondazione in vitro
- Terapia sostitutiva mitocondriale!
- Trattamento di fecondazione in vitro a Cipro
- IUI
- Mini fecondazione in vitro
- FIVET + ICSI
- FIV citoplasmatica
- Ciclo tandem di fecondazione in vitro
- Donazione di ovuli
- Donazione di embrioni
- Donazione di sperma
- Genere – Selezione del sesso
- Maternità gestazionale
- Surrogazione gay dello stesso sesso
- Recupero chirurgico dello sperma
- Diagnosi genetica preimpianto PGD
- Congelamento delle uova
- Selezione di genere utilizzando ovociti donati
- Prevenzione dell'anemia falciforme
- FAQ
- Viaggio
- Di
- Blog
- Infertilità
- Trattamenti di fecondazione in vitro
- Nuovi progressi della fecondazione in vitro
- Terapia sostitutiva mitocondriale!
- Trattamento di fecondazione in vitro a Cipro
- IUI
- Mini fecondazione in vitro
- FIVET + ICSI
- FIV citoplasmatica
- Ciclo tandem di fecondazione in vitro
- Donazione di ovuli
- Donazione di embrioni
- Donazione di sperma
- Genere – Selezione del sesso
- Maternità gestazionale
- Surrogazione gay dello stesso sesso
- Recupero chirurgico dello sperma
- Diagnosi genetica preimpianto PGD
- Congelamento delle uova
- Selezione di genere utilizzando ovociti donati
- Prevenzione dell'anemia falciforme
- FAQ
- Viaggio
Infertilità femminile
Diagnosi e gestione
La diagnosi di infertilità femminile è spesso più complessa della diagnosi di infertilità maschile. Mentre l'infertilità maschile può talvolta essere valutata con una singola analisi del liquido seminale, la valutazione dell'infertilità femminile richiede in genere una serie di test e screening approfonditi, che possono o meno produrre una diagnosi definitiva.
Le donne contribuiscono non solo all'ovulo, ma anche all'ambiente necessario affinché un embrione si sviluppi in un essere umano vitale. Sebbene l'infertilità femminile sia comunemente collegata a problemi di salute dell'ovulo, anche varie condizioni ovariche e uterine possono avere un impatto sulla capacità di una donna di concepire naturalmente. Esistono linee guida stabilite per la diagnosi dell'infertilità femminile primaria; tuttavia, qualsiasi valutazione dell'infertilità dovrebbe iniziare con un'anamnesi medica completa. Le seguenti domande possono aiutare a guidare la diagnosi e il trattamento dell'infertilità femminile primaria:
⦁ Sei mai stata incinta?
⦁ Hai mai avuto un aborto spontaneo? In caso affermativo, in quale momento della gravidanza si è verificato l'aborto spontaneo?
⦁ Hai una storia familiare di infertilità?
⦁ Hai cicli mestruali regolari?
⦁ Sei stato recentemente sottoposto a screening per malattie infettive, comprese le malattie sessualmente trasmissibili?
⦁ Possiedi animali domestici?
Le risposte a ciascuna di queste domande possono fornire informazioni importanti allo specialista della fertilità. Ad esempio, possedere animali domestici può aumentare la probabilità che una donna contragga infezioni che possono causare infertilità, come la toxoplasmosi. Allo stesso modo, una storia familiare di infertilità potrebbe indicare cause genetiche di infertilità. Durante qualsiasi esame di infertilità, i pazienti non dovrebbero accontentarsi di niente di meno che una storia medica completa. Una copia del nostro modulo di storia medica è disponibile sulla nostra pagina "Contatti". Sebbene il questionario sia solo l'inizio di un esame di infertilità, queste domande possono aiutare a identificare potenziali cause di infertilità, ma il passo successivo è valutare la fisiologia riproduttiva sia del paziente maschio che di quello femmina. In particolare, i test ormonali possono fornire informazioni sulla funzione ovarica di una donna e aiutare a guidare il trattamento.
Quali sono le cause più comuni dell'infertilità femminile?
1- Problemi di ovulazione
L'ovulazione è una parte critica del ciclo riproduttivo femminile ed è essenziale per il concepimento. Durante l'ovulazione, un ovulo maturo viene rilasciato da una delle ovaie e diventa disponibile per la fecondazione da parte dello sperma. Per la maggior parte delle donne, questo processo avviene una volta per ciclo, in genere circa due settimane prima dell'inizio del ciclo mestruale. L'ovulo viaggia attraverso la tuba di Falloppio, dove può essere fecondato, e poi si sposta nell'utero per l'impianto.
Quando l'ovulazione non avviene regolarmente o non avviene affatto, si parla di disfunzione ovulatoria. La disfunzione ovulatoria è una delle principali cause di infertilità femminile, responsabile di circa il 25-30% dei casi di infertilità. Le donne che hanno problemi di ovulazione possono avere cicli mestruali irregolari, mestruazioni saltate o persino una completa assenza di mestruazioni (amenorrea). Tuttavia, alcune donne con disfunzione ovulatoria possono comunque avere cicli mestruali regolari, rendendo più difficile identificare il problema sottostante senza ulteriori test.
Tipi di disturbi dell'ovulazione
I problemi di ovulazione possono manifestarsi in varie forme, ciascuna con diverse cause sottostanti. I disturbi ovulatori più comuni includono:
1. Anovulazione: Si tratta della completa assenza di ovulazione, in cui le ovaie non rilasciano un ovulo durante il ciclo mestruale. L'anovulazione è comunemente associata a squilibri ormonali, sindrome dell'ovaio policistico (PCOS) o insufficienza ovarica primaria (POI).
2. Oligo-ovulazione: In questo caso, l'ovulazione avviene in modo irregolare o poco frequente. Le donne con oligo-ovulazione possono avere cicli imprevedibili o lunghi intervalli tra i periodi, il che può rendere difficile programmare il rapporto per il concepimento. L'oligo-ovulazione è spesso correlata anche a condizioni come la PCOS o altri problemi ormonali.
3. Difetto della fase luteale (LPD): Questa condizione si verifica quando la fase luteale, il periodo successivo all'ovulazione, non produce livelli adeguati di progesterone per supportare un ovulo fecondato. Bassi livelli di progesterone possono impedire al rivestimento uterino di ispessirsi a sufficienza, rendendo difficile l'impianto e lo sviluppo di un embrione, il che può portare a una perdita precoce della gravidanza.
Cause dei problemi di ovulazione
I problemi di ovulazione sono principalmente radicati negli squilibri ormonali e nelle interruzioni dei segnali tra il cervello e gli organi riproduttivi. Le cause più comuni dei disturbi dell'ovulazione includono:
1. Sindrome dell'ovaio policistico (PCOS): La PCOS è una delle cause più diffuse di disfunzione ovulatoria, che colpisce circa il 5-10% delle donne in età riproduttiva. Le donne con PCOS hanno in genere livelli elevati di androgeni (ormoni maschili), che interferiscono con l'ovulazione. La PCOS può portare ad anovulazione, cicli irregolari e altri problemi metabolici, come la resistenza all'insulina.
2. Disfunzione ipotalamica: L'ipotalamo nel cervello regola molte funzioni corporee, tra cui il rilascio dell'ormone di rilascio delle gonadotropine (GnRH), che segnala alla ghiandola pituitaria di produrre gli ormoni necessari per l'ovulazione: l'ormone follicolo-stimolante (FSH) e l'ormone luteinizzante (LH). Stress, perdita di peso estrema, esercizio fisico eccessivo o disturbi alimentari possono interrompere la funzione dell'ipotalamo, portando a un'ovulazione irregolare o assente.
3. Insufficienza ovarica primaria (POI): Noto anche come insufficienza ovarica prematura, il POI si verifica quando le ovaie perdono la normale funzionalità prima dei 40 anni. Questa condizione è talvolta dovuta a fattori genetici, disturbi autoimmuni o determinati trattamenti medici (ad esempio, chemioterapia). Il POI può portare a una ridotta produzione di estrogeni, cicli irregolari e, infine, alla cessazione dell'ovulazione.
4. Iperprolattinemia: Livelli elevati di prolattina, un ormone responsabile della produzione di latte, possono sopprimere l'ovulazione interrompendo l'equilibrio degli ormoni riproduttivi. Questa condizione può essere causata da farmaci, tumori pituitari o problemi alla tiroide.
5. Disturbi della tiroide: Sia l'ipertiroidismo (tiroide iperattiva) che l'ipotiroidismo (tiroide ipoattiva) possono interferire con i normali cicli mestruali e ovulatori. Gli ormoni tiroidei svolgono un ruolo cruciale nella regolazione del sistema riproduttivo del corpo e qualsiasi squilibrio può portare a problemi di ovulazione.
Sintomi di problemi di ovulazione
I sintomi dei problemi di ovulazione possono variare ampiamente a seconda del disturbo specifico. I sintomi comuni che possono indicare una disfunzione ovulatoria includono:
• Cicli mestruali irregolari (troppo lunghi, troppo corti o imprevedibili)
• Assenza delle mestruazioni (amenorrea)
• Mestruazioni abbondanti o molto leggere
• Assenza di sintomi premestruali (dolore al seno, gonfiore)
• Difficoltà a predire l'ovulazione (modelli irregolari della temperatura corporea basale)
• Acne, eccesso di peli sul viso o sul corpo e aumento di peso (in particolare nelle donne con PCOS)
Questi sintomi non confermano un problema di ovulazione, ma possono essere indicatori che giustificano un'ulteriore valutazione da parte di un professionista sanitario.
Diagnosi dei problemi di ovulazione
Per diagnosticare i disturbi dell'ovulazione, è possibile eseguire una serie di valutazioni e test. Questi includono:
1. Anamnesi medica ed esame fisico:Un'anamnesi medica completa e un esame fisico possono rivelare potenziali cause sottostanti, come fattori legati allo stile di vita, cambiamenti di peso o livelli di stress che potrebbero influenzare l'ovulazione.
2. Monitoraggio dell'ovulazione: Alle donne potrebbe essere chiesto di monitorare i loro cicli mestruali, la temperatura corporea basale o di usare kit predittivi dell'ovulazione. Gli esami del sangue del progesterone effettuati durante la fase luteale possono confermare se l'ovulazione è avvenuta.
3. Test ormonali:Gli esami del sangue possono valutare i livelli di ormoni chiave, tra cui FSH, LH, estrogeni, prolattina, testosterone e ormoni tiroidei, per determinare eventuali squilibri che potrebbero influire sull'ovulazione.
4. Ultrasuoni: Un'ecografia transvaginale può aiutare a visualizzare le ovaie e rilevare la presenza di follicoli, cisti o altre anomalie. Questa diagnostica per immagini può essere particolarmente utile nella diagnosi della PCOS o nel monitoraggio della risposta delle ovaie al trattamento ormonale se si sta eseguendo un trattamento per la fertilità.
5. Test aggiuntivi per le condizioni sottostanti: Se i test iniziali evidenziano un problema come POI, PCOS o un disturbo della tiroide, potrebbero essere eseguiti ulteriori test per confermare la diagnosi.
I problemi di ovulazione possono rendere difficile il concepimento, poiché un'ovulazione irregolare o assente riduce il numero di opportunità per un ovulo di essere fecondato. Anche quando si verifica l'ovulazione, condizioni come il difetto di fase luteale o ovuli di bassa qualità possono interferire con l'impianto o aumentare il rischio di aborto spontaneo. Fortunatamente, molti disturbi dell'ovulazione sono curabili e i progressi nella medicina della fertilità offrono varie opzioni per le donne che soffrono di infertilità correlata all'ovulazione.
2- Problemi alle tube di Falloppio
Le tube di Falloppio bloccate o danneggiate sono una causa significativa di infertilità femminile, poiché interrompono il normale percorso di incontro tra ovulo e spermatozoi, impedendo così la fecondazione. Le tube di Falloppio, che collegano le ovaie all'utero, svolgono un ruolo cruciale nel processo riproduttivo. Ogni mese, dopo l'ovulazione, un ovulo viene rilasciato da una delle ovaie e viaggia attraverso la tuba di Falloppio, dove può incontrare lo sperma e subire la fecondazione. Una volta fecondato, l'embrione continua a muoversi attraverso la tuba fino a raggiungere l'utero per l'impianto. Quando una o entrambe le tube di Falloppio sono bloccate o danneggiate, questo viaggio viene impedito, rendendo difficile o impossibile il concepimento naturale.
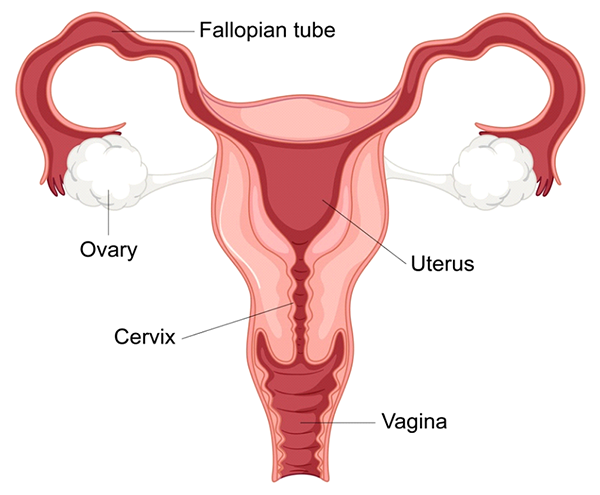
Come il danno alle tube di Falloppio influisce sulla fertilità
I danni o i blocchi alle tube di Falloppio possono influenzare la fertilità:
a) Impedire allo sperma di raggiungere l'ovulo: se le tube di Falloppio sono completamente bloccate, lo sperma non può raggiungere l'ovulo e la fecondazione non può avvenire. Questa situazione è nota come infertilità da fattore tubarico, che rappresenta circa il 25-35% dei casi di infertilità femminile.
b) Interferenza con il prelievo dell'ovulo: danni alle fimbrie (le estremità frangiate delle tube di Falloppio vicino alle ovaie) possono impedire che l'ovulo venga catturato e trascinato nella tuba di Falloppio dopo l'ovulazione. Senza questo processo, l'ovulo non può percorrere la tuba per incontrare lo sperma.
c) Prevenzione del trasporto dell'embrione: se una tuba parzialmente bloccata consente la fecondazione ma impedisce il passaggio dell'ovulo fecondato (embrione), potrebbe verificarsi una gravidanza ectopica. Questa è una condizione grave in cui l'embrione si impianta e cresce all'interno della tuba di Falloppio anziché nell'utero, il che può portare a complicazioni mediche e richiede un trattamento tempestivo.
d) Inibizione dell'impianto nell'utero: anche se la tuba è solo parzialmente bloccata o danneggiata, può influire sul trasporto tempestivo dell'embrione nell'utero. Il trasporto ritardato dell'embrione può ridurre la probabilità di un impianto riuscito o aumentare il rischio di impianto in una posizione inappropriata.
Cause delle tube di Falloppio bloccate o danneggiate
1. Malattia infiammatoria pelvica (PID): la PID è un'infezione degli organi riproduttivi femminili, spesso causata da infezioni sessualmente trasmissibili (IST) come la clamidia o la gonorrea. Se non curate, queste infezioni possono portare a infiammazione e cicatrici delle tube di Falloppio, causando ostruzioni parziali o complete. La PID è una delle cause più comuni di infertilità tubarica.
2. Endometriosi: l'endometriosi è una condizione in cui tessuto simile al rivestimento dell'utero cresce all'esterno dell'utero, spesso sulle ovaie, sulle tube di Falloppio o sul rivestimento pelvico. Gli impianti endometriali sulle o vicino alle tube di Falloppio possono causare aderenze, infiammazioni o cicatrici, portando a blocchi o movimento limitato delle tube.
3. Chirurgia tubarica: precedenti interventi chirurgici alle tube di Falloppio, come procedure per riparare una gravidanza tubarica, rimuovere cisti o curare infezioni tubariche, possono causare cicatrici e aderenze che bloccano le tube. Anche le donne che hanno subito una legatura tubarica (sterilizzazione chirurgica) possono avere infertilità a causa del blocco intenzionale delle tube.
4. Aderenze da chirurgia addominale o pelvica: gli interventi chirurgici che coinvolgono l'addome o la pelvi, come appendicectomia, taglio cesareo o interventi per cisti ovariche, possono causare la formazione di tessuto cicatriziale attorno alle tube di Falloppio. Queste aderenze possono ostruire le tube o limitarne il movimento, influenzando il percorso dell'ovulo verso l'utero.
5. Idrosalpinge: l'idrosalpinge è una condizione in cui una o entrambe le tube di Falloppio si bloccano e si riempiono di liquido. Questa condizione è spesso il risultato di infezioni, PID o endometriosi. Il liquido all'interno di un'idrosalpinge può essere tossico per gli embrioni e può ridurre il tasso di successo della fecondazione in vitro (FIV) se non trattato.
6. Anomalie congenite: in rari casi, alcune donne possono nascere con anomalie strutturali nelle tube di Falloppio, che possono causare ostruzioni o disfunzioni.
Diagnosi delle tube di Falloppio bloccate o danneggiate
Per diagnosticare ostruzioni o danni alle tube di Falloppio, spesso vengono utilizzati i seguenti metodi diagnostici:
1. Isterosalpingografia (HSG): L'HSG è una procedura radiografica in cui un colorante speciale viene iniettato nell'utero e nelle tube di Falloppio per valutarne la struttura. Il colorante si vede nelle radiografie e può rivelare ostruzioni o anomalie nelle tube.
2. Sonoisterografia: Questa procedura è simile all'HSG ma utilizza ultrasuoni invece dei raggi X. Una soluzione salina viene iniettata nell'utero, consentendo all'operatore sanitario di visualizzare le tube di Falloppio e valutare eventuali blocchi o danni.
3. Laparoscopia: La laparoscopia è una procedura chirurgica minimamente invasiva che prevede l'inserimento di una piccola telecamera attraverso una minuscola incisione nell'addome. Questa procedura consente all'operatore sanitario di visualizzare direttamente le tube di Falloppio, rimuovere piccoli blocchi o aderenze e valutare le condizioni degli organi pelvici circostanti. La laparoscopia viene spesso eseguita quando altri test diagnostici sono stati inconcludenti o quando sono presenti sintomi di endometriosi o aderenze pelviche.
4. Test degli anticorpi della clamidia: Poiché l'infezione da clamidia può causare danni alle tube senza sintomi evidenti, questo esame del sangue verifica la presenza di anticorpi contro la clamidia. Un risultato positivo può indicare un'infezione passata che potrebbe aver interessato le tube.
La fecondazione in vitro è spesso raccomandata per le donne con tube di Falloppio bloccate o gravemente danneggiate, poiché aggira completamente la necessità delle tube. Nella fecondazione in vitro, gli ovuli vengono recuperati dalle ovaie, fecondati con lo sperma in laboratorio e gli embrioni risultanti vengono trasferiti direttamente nell'utero. La fecondazione in vitro è considerata il trattamento più efficace per l'infertilità tubarica, in particolare nei casi di danno grave o irreversibile. Le donne con una tuba bloccata possono comunque provare a concepire naturalmente, ma la fecondazione in vitro fornisce un'alternativa se altri tentativi non hanno successo.
3- Problemi fisici con l'utero
Anomalie fisiche o problemi strutturali nell'utero sono un altro fattore significativo nell'infertilità femminile. L'utero, o grembo, fornisce l'ambiente per l'impianto dell'embrione e la crescita di un feto in via di sviluppo. Problemi strutturali con l'utero possono interrompere l'impianto di un ovulo fecondato, influenzare lo sviluppo dell'embrione o aumentare il rischio di aborto spontaneo. Questi problemi sono spesso indicati come infertilità da fattore uterino e possono avere un impatto sia sulla capacità di concepire sia sulla probabilità di mantenere una gravidanza sana.
Tipi di problemi strutturali uterini e il loro impatto sulla fertilità
Esistono diversi tipi di problemi fisici che possono colpire l'utero e portare all'infertilità. Ogni condizione ha effetti unici sulla fertilità, a seconda della sua posizione, gravità e causa sottostante. I problemi strutturali uterini più comuni associati all'infertilità includono:
1. Fibromi (Leiomiomi Uterini):
I fibromi sono escrescenze non cancerose composte da tessuto muscolare e fibroso che si sviluppano nelle o sulle pareti dell'utero. Sebbene i fibromi siano piuttosto comuni, colpendo fino al 70-80% delle donne entro i 50 anni, non sempre causano infertilità. L'impatto dei fibromi sulla fertilità dipende dalle loro dimensioni, dal loro numero e dalla loro posizione all'interno dell'utero. I fibromi sottomucosi, che crescono all'interno della cavità uterina, hanno maggiori probabilità di interferire con l'impianto o lo sviluppo dell'embrione. I fibromi di grandi dimensioni o i fibromi multipli possono anche alterare la forma della cavità uterina o bloccare le tube di Falloppio, ostacolando ulteriormente il concepimento. I fibromi possono anche aumentare il rischio di aborto spontaneo, parto pretermine e complicazioni durante la gravidanza, a seconda delle loro dimensioni e posizione.
2. Polipi uterini:
I polipi uterini sono piccole escrescenze benigne che si formano dal rivestimento dell'utero (endometrio). Sebbene generalmente non siano cancerosi, i polipi possono interferire con la fertilità bloccando il passaggio dello sperma, impedendo l'impianto o interrompendo l'afflusso di sangue a un embrione impiantato. I polipi possono essere particolarmente problematici se si trovano in prossimità del punto in cui un embrione si impianterebbe normalmente. In tali casi, possono impedire una gravidanza di successo o aumentare il rischio di aborto spontaneo precoce.
3. Anomalie uterine congenite:
Si tratta di anomalie strutturali nell'utero presenti dalla nascita, causate da problemi di sviluppo nella formazione dei dotti di Müller, che danno origine all'utero, alle tube di Falloppio e alla parte superiore della vagina. Le anomalie uterine congenite possono assumere una delle seguenti forme:
Utero bicorne: L'utero ha una forma simile a un cuore con una profonda rientranza nella parte superiore, che crea due cavità. Un utero bicorne può aumentare il rischio di aborto spontaneo, parto prematuro e posizionamento fetale anomalo.
Utero setto: Un setto (parete) fibroso o muscolare divide la cavità uterina, parzialmente o completamente. Questa condizione è associata a tassi più elevati di aborto spontaneo e fallimento dell'impianto, poiché il setto può avere un ridotto apporto di sangue, rendendolo meno favorevole all'impianto dell'embrione.
Utero unicorne: Si forma solo metà dell'utero, spesso con conseguente cavità uterina più piccola del normale. Ciò può portare a difficoltà nel sostenere una gravidanza, con un rischio più elevato di aborto spontaneo e parto prematuro.
Utero di Didelfo: Questa rara condizione, nota anche come "doppio utero", si verifica quando si formano due cavità uterine separate. Sebbene il concepimento sia possibile, la gravidanza può essere ad alto rischio a causa dello spazio uterino limitato.
Le anomalie uterine congenite spesso contribuiscono ad aborti spontanei ricorrenti e possono anche rendere più difficile il concepimento per le donne, soprattutto se la forma dell'utero impedisce il corretto impianto.
4. Aderenze intrauterine (sindrome di Asherman):
Le aderenze intrauterine sono bande di tessuto cicatriziale che si formano all'interno dell'utero, spesso a seguito di traumi al rivestimento uterino. Sono comunemente causate da interventi chirurgici uterini, come dilatazione e raschiamento (D&C), o infezioni. La sindrome di Asherman può portare a un'ostruzione parziale o totale della cavità uterina, che può impedire l'impianto o portare ad aborti spontanei ricorrenti. Nei casi gravi, le aderenze possono impedire del tutto le mestruazioni (amenorrea). Le donne con sindrome di Asherman possono avere mestruazioni scarse o assenti, dolore pelvico e infertilità, soprattutto se le aderenze interrompono la normale funzione uterina.
5. Adenomiosi:
L'adenomiosi si verifica quando il tessuto endometriale (il rivestimento dell'utero) cresce nella parete muscolare dell'utero. Questa condizione può causare un utero ispessito e ingrossato e portare a mestruazioni dolorose o abbondanti, dolore pelvico e infertilità. L'adenomiosi è solitamente associata a fallimenti di impianto e a un rischio aumentato di aborto spontaneo. Mentre la causa esatta dell'infertilità nell'adenomiosi non è completamente compresa, si ritiene che la crescita anomala del tessuto endometriale nella parete muscolare interrompa il corretto funzionamento dell'utero.
6. Problemi endometriali:
Lo spessore e la qualità del rivestimento endometriale sono cruciali per un impianto embrionale di successo. In alcuni casi, le donne possono avere un rivestimento endometriale troppo sottile o che non si sviluppa adeguatamente, spesso a causa di squilibri ormonali, alcuni farmaci o precedenti interventi chirurgici uterini. Un endometrio sottile può ridurre la probabilità di impianto, poiché potrebbe non fornire il supporto necessario all'embrione per attaccarsi e prosperare.
Sintomi di problemi strutturali uterini
Mentre alcune donne con problemi strutturali uterini potrebbero non presentare sintomi, altre potrebbero manifestare quanto segue:
• Sanguinamento mestruale irregolare o abbondante (comune con fibromi, polipi e adenomiosi)
• Mestruazioni dolorose o dolore pelvico
• Perdita ricorrente della gravidanza o aborto spontaneo
• Difficoltà di concepimento nonostante l'ovulazione regolare e la salute dello sperma
• Dolore durante il rapporto sessuale
Poiché i sintomi possono essere lievi o sovrapporsi ad altre condizioni, i problemi strutturali uterini vengono spesso diagnosticati solo dopo che la donna si è rivolta a un medico per una valutazione dell'infertilità o di aborti spontanei ricorrenti.
Diagnosi dei problemi strutturali uterini
Per diagnosticare problemi strutturali nell'utero, spesso si ricorre a una combinazione di esami di diagnostica per immagini e, se necessario, a procedure minimamente invasive.
Ultrasuoni: L'ecografia transvaginale è uno strumento di imaging di prima linea per valutare la struttura uterina. Può identificare fibromi, polipi, anomalie congenite e adenomiosi. In alcuni casi, l'ecografia 3D può fornire una visione più dettagliata della forma uterina.
Isterosalpingografia (HSG):Questa procedura radiografica prevede l'iniezione di un mezzo di contrasto nell'utero per delineare la forma della cavità uterina e verificare la presenza di ostruzioni o aderenze nelle tube di Falloppio.
Sonoisterografia: Una soluzione salina viene iniettata nell'utero durante un'ecografia per dare una visione più chiara della cavità uterina. Questa tecnica può aiutare a identificare polipi, fibromi e aderenze.
Risonanza magnetica per immagini (RMI): La risonanza magnetica fornisce immagini ad alta risoluzione dell'utero ed è particolarmente utile per diagnosticare adenomiosi, anomalie congenite e fibromi uterini profondi.
Isteroscopia: L'isteroscopia consiste nell'inserimento di un sottile endoscopio illuminato attraverso la cervice per visualizzare direttamente l'interno dell'utero. Consente al medico di ispezionare visivamente la cavità uterina per individuare polipi, fibromi o aderenze e, se necessario, rimuoverli o trattarli durante la stessa procedura.
Laparoscopia: La laparoscopia è una procedura chirurgica minimamente invasiva che consente al medico di visualizzare l'esterno dell'utero e le strutture circostanti, come le tube di Falloppio e le ovaie. È particolarmente utile per identificare l'endometriosi o le aderenze pelviche che possono influire sulla fertilità.
4- Problemi alla cervice
I problemi cervicali possono avere un impatto significativo sulla fertilità di una donna, poiché la cervice svolge un ruolo fondamentale nel percorso dello sperma verso l'ovulo. La cervice è la parte inferiore dell'utero che si collega alla vagina e funge da porta d'ingresso per lo sperma per entrare nell'utero e risalire verso le tube di Falloppio, dove solitamente avviene la fecondazione. I problemi cervicali che interferiscono con la funzione o la struttura della cervice possono impedire allo sperma di raggiungere l'ovulo, ridurre la probabilità di impianto o aumentare il rischio di perdita di gravidanza.

Tipi di problemi cervicali e il loro impatto sulla fertilità
Esistono diversi tipi di problemi cervicali che possono influire sulla fertilità:
1. Anomalie del muco cervicale:
Il muco cervicale, prodotto dalle ghiandole presenti nella cervice, è fondamentale per facilitare il movimento degli spermatozoi. Intorno al momento dell'ovulazione, il muco cervicale diventa sottile, elastico e scivoloso (simile alla consistenza degli albumi d'uovo), facilitando il passaggio degli spermatozoi attraverso la cervice e nell'utero. Quando il muco cervicale è troppo spesso, scarso o ostile (sfavorevole agli spermatozoi), può ostacolare il movimento degli spermatozoi o ucciderli prima che raggiungano l'ovulo. Questa condizione è talvolta chiamata "muco cervicale ostile" ed è spesso dovuta a squilibri ormonali, infezioni, determinati farmaci o condizioni di salute sottostanti. Un muco cervicale insufficiente o di scarsa qualità può anche impedire agli spermatozoi di sopravvivere abbastanza a lungo da raggiungere l'ovulo, riducendo la probabilità di fecondazione.
2. Stenosi cervicale (restringimento del canale cervicale):
La stenosi cervicale è una condizione in cui il canale cervicale diventa anormalmente stretto o chiuso, rendendo difficile il passaggio degli spermatozoi. Questa condizione può essere congenita (presente dalla nascita) o acquisita a causa di interventi chirurgici, infezioni, traumi o radioterapia. Nei casi gravi, la stenosi cervicale può ostruire completamente il passaggio degli spermatozoi, impedendo di fatto il concepimento naturale. La stenosi cervicale può anche causare irregolarità mestruali e dolore, poiché il sangue mestruale può avere difficoltà a passare attraverso la cervice ristretta. Nei casi di stenosi grave, possono essere raccomandate tecniche di riproduzione assistita come l'inseminazione intrauterina (IUI) o la fecondazione in vitro (FIV) per bypassare la cervice.
3. Infezioni e infiammazioni cervicali:
Le infezioni della cervice, come la cervicite (infiammazione della cervice) o le infezioni sessualmente trasmissibili (IST) come la clamidia e la gonorrea, possono avere un impatto sulla fertilità. L'infiammazione e l'infezione della cervice possono alterare la qualità del muco cervicale, rendendolo meno favorevole allo sperma. In alcuni casi, le infezioni non trattate possono portare allo sviluppo di tessuto cicatriziale, che può restringere il canale cervicale. Le infezioni possono anche diffondersi verso l'alto, portando alla malattia infiammatoria pelvica (PID), che può avere un ulteriore impatto sulla fertilità causando cicatrici e ostruzioni nelle tube di Falloppio.
4. Insufficienza cervicale (cervice incompetente):
L'insufficienza cervicale, nota anche come cervice incompetente, si verifica quando la cervice è troppo debole per rimanere chiusa durante la gravidanza. Sebbene questa condizione non impedisca direttamente il concepimento, può portare ad aborto spontaneo, soprattutto nel secondo trimestre, poiché la cervice può iniziare a dilatarsi prematuramente. L'insufficienza cervicale può essere dovuta a fattori genetici, precedenti interventi chirurgici cervicali (ad esempio, procedura LEEP o biopsia conica), traumi da parto o anomalie congenite. Le donne con questa condizione spesso sperimentano perdite di gravidanza ricorrenti e possono richiedere interventi medici per sostenere la cervice durante la gravidanza.
5. Interventi o procedure cervicali precedenti:
Alcune procedure cervicali, come la LEEP (procedura di escissione elettrochirurgica ad ansa) o la biopsia conica, vengono utilizzate per rimuovere le cellule precancerose dalla cervice, ma a volte possono influire sulla fertilità. Queste procedure possono indebolire la cervice o causare cicatrici, che possono portare a insufficienza cervicale o stenosi. Mentre la maggior parte delle donne mantiene la fertilità dopo queste procedure, quelle che hanno complicazioni possono affrontare un rischio maggiore di infertilità, aborti ricorrenti o parto pretermine. In alcuni casi, le cicatrici cervicali dovute all'intervento chirurgico possono influire sulla produzione di muco o rendere difficile il passaggio degli spermatozoi.
6. Anticorpi antisperma nel muco cervicale:
In rari casi, il sistema immunitario di una donna può produrre anticorpi contro gli spermatozoi, percependoli come invasori estranei. Questi anticorpi possono essere presenti nel muco cervicale e possono compromettere il movimento degli spermatozoi, danneggiarli o impedirgli di raggiungere l'utero. La presenza di anticorpi antisperma nel muco cervicale può portare a quella che è nota come "infertilità immunologica", che può richiedere trattamenti specifici, come IUI o IVF, per aiutare a bypassare la cervice e migliorare le possibilità di fecondazione.
Diagnosi dei problemi cervicali nell'infertilità
La diagnosi di infertilità cervicale di solito comporta una serie di test e valutazioni. Un esame pelvico consente al medico di valutare le dimensioni, la forma e la posizione della cervice e di verificare eventuali anomalie visibili o segni di infiammazione. A volte, può essere ordinato un test postcoitale se si sospetta muco ostile. In questo test, un campione di muco cervicale viene raccolto dopo il rapporto per esaminare il movimento degli spermatozoi all'interno del muco. Questo test aiuta a valutare se il muco cervicale supporta o inibisce il movimento degli spermatozoi, sebbene sia meno comunemente utilizzato oggi a causa di risultati variabili.
L'HSG è una procedura radiografica che utilizza un mezzo di contrasto per valutare la forma dell'utero e la pervietà (apertura) del canale cervicale e delle tube di Falloppio. Aiuta a rilevare eventuali blocchi strutturali nella cervice. Le colture cervicali possono essere eseguite per identificare le infezioni, mentre una biopsia cervicale può valutare la presenza di eventuali cellule anomale o precancerose. Questi test possono aiutare a identificare infezioni o cicatrici che potrebbero avere un impatto sulla fertilità.
L'imaging ecografico può essere utilizzato per valutare la struttura e la lunghezza della cervice, specialmente nei casi in cui si sospetta un'insufficienza cervicale. L'ecografia transvaginale è spesso utilizzata per monitorare la lunghezza della cervice durante la gravidanza nelle donne con una storia di insufficienza cervicale.
5- Età
L'età è uno dei fattori più significativi che influenzano la fertilità femminile. Con l'avanzare dell'età, la fertilità di una donna diminuisce naturalmente a causa di cambiamenti sia nella quantità che nella qualità dei suoi ovuli, così come di alterazioni nel suo apparato riproduttivo che influenzano il concepimento e la gravidanza. Il declino della fertilità inizia in genere tra i 20 e i 30 anni e accelera significativamente dopo i 35 anni. Quando una donna raggiunge i 40 anni, la probabilità di concepire naturalmente diminuisce notevolmente e il rischio di complicazioni aumenta. I seguenti cambiamenti si verificano con l'aumentare dell'età di una donna:
1. Diminuzione della quantità di ovuli (riserva ovarica)
Le donne nascono con tutti gli ovuli che avranno mai, circa 1-2 milioni al momento della nascita. Entro la pubertà, questo numero è già sceso a circa 300.000-400.000 e con ogni ciclo mestruale, vengono esauriti altri ovuli. Verso la fine dei 30 anni, il numero di ovuli rimanenti (noto come riserva ovarica) diminuisce rapidamente. Quando una donna si avvicina alla menopausa, in genere intorno ai 50 anni, rimangono pochissimi ovuli vitali, se non nessuno. La diminuzione della riserva ovarica influisce sulla capacità di una donna di concepire, poiché meno ovuli significano meno opportunità di fecondazione. Una ridotta produzione di ovuli limita anche l'efficacia dei trattamenti per la fertilità come la fecondazione in vitro (FIV) perché le ovaie potrebbero non produrre abbastanza ovuli in risposta alla stimolazione.
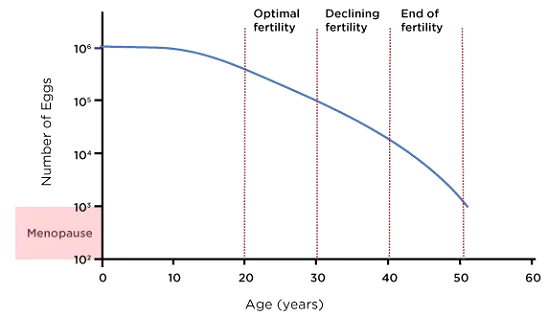
2. Declino della qualità delle uova
Non solo la quantità di ovuli diminuisce con l'età, ma anche la loro qualità. La qualità degli ovuli si riferisce all'integrità genetica e cromosomica di un ovulo. Con l'avanzare dell'età, le donne hanno maggiori probabilità di accumulare anomalie cromosomiche, aumentando la probabilità di disturbi genetici, come la sindrome di Down, e riducendo le possibilità di concepimento di successo. Le anomalie cromosomiche aumentano anche il rischio di aborto spontaneo, in particolare nelle donne di età superiore ai 35 anni. Gli studi dimostrano che il tasso di aborto spontaneo per le donne all'inizio dei loro 20 anni è di circa 10-15%, ma questo tasso sale a circa 35% per le donne all'inizio dei loro 40 anni.
Non solo i problemi genetici sono prevalenti nell'ovocita nelle fasce di età più avanzate, ma anche gli organelli citoplasmatici perdono la loro funzione con l'avanzare dell'età. In particolare, la funzione mitocondriale è vitale per la crescita e lo sviluppo cellulare e i mitocondri invecchiati possono non riuscire a fornire il necessario equilibrio tra produzione di energia e danno ossidativo all'interno degli ovociti. Alcuni trattamenti di nuova generazione come la "terapia sostitutiva mitocondriale" possono essere utili nei casi in cui l'invecchiamento dell'ovocita è un problema durante i trattamenti per la fertilità. Il declino della qualità degli ovociti è una ragione significativa per cui i tassi di gravidanza e di nati vivi diminuiscono con l'età, anche con l'uso di trattamenti per la fertilità.
3. Aumento del rischio di problemi di salute riproduttiva
Con l'avanzare dell'età, le donne hanno maggiori probabilità di sviluppare condizioni di salute che possono avere un impatto sulla fertilità, tra cui endometriosi, fibromi uterini e complicazioni croniche della malattia infiammatoria pelvica. Questi problemi di salute non solo influenzano le possibilità di concepimento, ma possono anche aumentare il rischio di complicazioni della gravidanza e aborto spontaneo.
4. Ridotta ricettività uterina
Con l'età, l'utero può anche subire cambiamenti che incidono sulla sua capacità di sostenere una gravidanza. Il rivestimento endometriale, che si ispessisce a ogni ciclo per preparare un potenziale embrione, potrebbe non svilupparsi in modo ottimale come una volta. Questo cambiamento può ridurre la probabilità di un impianto riuscito, anche se è presente un embrione sano. Anche il sistema vascolare nell'utero può essere influenzato dall'età, riducendo il flusso sanguigno al rivestimento endometriale. Un flusso sanguigno adeguato è essenziale per un utero ricettivo che può sostenere un embrione, quindi un flusso sanguigno ridotto può ridurre la fertilità e aumentare il rischio di perdita precoce della gravidanza.
5. Rischio più elevato di complicazioni durante la gravidanza
Le donne anziane che concepiscono naturalmente o con assistenza affrontano un rischio maggiore di complicazioni della gravidanza. Queste complicazioni includono:
Diabete gestazionale: le donne con più di 35 anni corrono un rischio maggiore di sviluppare il diabete gestazionale, che può avere ripercussioni sia sulla salute materna che su quella fetale.
Ipertensione e preeclampsia: l'ipertensione e la preeclampsia (una complicanza della gravidanza potenzialmente pericolosa caratterizzata da pressione alta) sono più comuni nelle madri più anziane.
Placenta previa: le donne con più di 35 anni corrono un rischio maggiore di placenta previa, una condizione in cui la placenta ricopre la cervice, che può portare a complicazioni durante il parto.
Parto pretermine: le donne con più di 35 anni corrono un rischio maggiore di partorire prematuramente, il che può avere ripercussioni sulla salute del bambino.
Queste complicazioni della gravidanza, pur non avendo un impatto diretto sulla capacità di concepire, sottolineano i rischi aggiuntivi per la salute a cui vanno incontro le donne che tentano di concepire in età avanzata. L'età influisce non solo sul concepimento naturale, ma anche sui tassi di successo delle tecnologie di riproduzione assistita come la fecondazione in vitro. Le donne sotto i 35 anni hanno generalmente tassi di successo più elevati con la fecondazione in vitro rispetto alle donne sopra i 40. Entro i 43 anni, il tasso di successo della fecondazione in vitro con ovuli della donna stessa diminuisce in modo significativo, in gran parte a causa della quantità e della qualità ridotte degli ovuli. Per aumentare le loro possibilità, alcune donne più anziane scelgono di utilizzare ovuli di una donatrice di una donna più giovane, il che migliora notevolmente i tassi di successo perché gli ovuli di una donatrice sono in genere di qualità superiore. Tuttavia, il processo di donazione di ovuli è costoso e richiede un'attenta considerazione e preparazione.
Opzioni di preservazione della fertilità: congelamento degli ovuli e congelamento degli embrioni
Dato il calo della fertilità associato all'età, alcune donne scelgono di preservare la propria fertilità attraverso il congelamento degli ovuli o degli embrioni (crioconservazione) quando sono più giovani, soprattutto se hanno intenzione di ritardare la gravidanza.
Congelamento degli ovuli: questo processo comporta la stimolazione delle ovaie per produrre più ovuli, che vengono poi recuperati e congelati per un uso futuro. Il congelamento degli ovuli può consentire alle donne di utilizzare ovuli più giovani e sani quando sono pronte a concepire, aumentando le loro possibilità di una gravidanza di successo più avanti nella vita.
Congelamento degli embrioni: simile al congelamento degli ovuli, questo processo prevede la fecondazione degli ovuli recuperati con lo sperma prima del congelamento. Questa opzione è spesso scelta dalle donne che hanno una relazione impegnata e vogliono avere embrioni pronti per l'impianto in futuro.
Queste tecniche offrono opzioni per le donne che desiderano ritardare la gravidanza preservando la qualità dei loro ovuli o embrioni. Mentre l'età è un fattore importante per la fertilità, i progressi della medicina come l'ART, il congelamento degli ovuli e il congelamento degli embrioni offrono opzioni per aiutare le donne a concepire più avanti nella vita. Comprendere gli effetti dell'età sulla fertilità può aiutare le donne a fare scelte riproduttive informate e a cercare assistenza in anticipo se hanno intenzione di concepire in età avanzata.
6- Problemi del sistema immunitario
I problemi immunitari possono avere un impatto significativo sulla fertilità nelle donne, spesso portando a infertilità inspiegata, aborti ricorrenti o complicazioni in gravidanza. Il sistema immunitario è progettato per proteggere il corpo da infezioni e invasori estranei, ma in alcuni casi le risposte immunitarie possono interferire con la fertilità prendendo di mira le cellule riproduttive, i tessuti o persino l'embrione. Questi problemi di fertilità correlati al sistema immunitario possono derivare da malattie autoimmuni, risposte immunitarie allo sperma o agli embrioni o attivazione anomala del sistema immunitario.
1. Malattie autoimmuni e infertilità
Nei disturbi autoimmuni, il sistema immunitario attacca erroneamente i tessuti del corpo come se fossero invasori estranei. Diverse condizioni autoimmuni sono associate all'infertilità:
Lupus eritematoso sistemico (LES): il lupus è una malattia autoimmune che può causare infiammazione in tutto il corpo, compresi gli organi riproduttivi. Le donne con lupus possono avere irregolarità mestruali, aborti spontanei ricorrenti o parto prematuro a causa di attacchi del sistema immunitario all'utero o alla placenta.
Sindrome da anticorpi antifosfolipidi (APS): l'APS è una malattia autoimmune in cui il sistema immunitario produce anticorpi contro i fosfolipidi, molecole presenti nelle membrane cellulari, ed è spesso associata a perdite di gravidanza ricorrenti. Questi anticorpi antifosfolipidi possono portare alla formazione di coaguli di sangue nella placenta, interrompendo l'afflusso di sangue al feto e causando aborto spontaneo. L'APS è anche collegata ad altre complicazioni, come la preeclampsia e il parto pretermine.
Tiroidite di Hashimoto e morbo di Graves: entrambi sono disturbi tiroidei autoimmuni in cui il sistema immunitario attacca la tiroide, riducendo (Hashimoto) o aumentando (Graves) la produzione di ormoni tiroidei. Gli ormoni tiroidei svolgono un ruolo fondamentale nella regolazione del ciclo mestruale e nel supporto della gravidanza. Le donne con disturbi tiroidei spesso sperimentano irregolarità mestruali, problemi di ovulazione e un rischio più elevato di aborto spontaneo.
Artrite reumatoide (RA) e altre malattie autoimmuni: la RA e malattie autoimmuni simili possono creare condizioni infiammatorie che interferiscono con l'ovulazione, l'impianto dell'embrione e il mantenimento della gravidanza. Inoltre, alcuni farmaci usati per curare le malattie autoimmuni possono influire negativamente sulla fertilità.
2. Anticorpi anti-sperma
In alcuni casi, il sistema immunitario di una donna può produrre anticorpi che prendono di mira specificamente lo sperma. Questa risposta può verificarsi se lo sperma è esposto al sistema immunitario tramite trauma, infezione o intervento chirurgico. Gli anticorpi possono compromettere la motilità dello sperma (rendendo difficile per lo sperma nuotare), legarsi alla superficie dello sperma o persino distruggerlo del tutto, impedendo così la fecondazione. Gli anticorpi anti-sperma si trovano solitamente nel muco cervicale, ma possono essere presenti anche in altre aree dell'apparato riproduttivo. Le donne con anticorpi anti-sperma possono richiedere trattamenti come l'inseminazione intrauterina (IUI) o la fecondazione in vitro (FIV) per bypassare il muco cervicale e migliorare le possibilità di concepimento.
3. Anticorpi anti-ovarici
Gli anticorpi anti-ovarici sono anticorpi che attaccano il tessuto ovarico, prendendo di mira componenti come le cellule uovo, i recettori dell'ormone follicolo-stimolante (FSH) o le strutture che supportano lo sviluppo dell'uovo. Questa risposta immunitaria può interferire con la funzione ovarica, ridurre la qualità dell'uovo e portare a un invecchiamento o a un'insufficienza ovarica precoce (nota come insufficienza ovarica primaria o POI). Le donne con anticorpi anti-ovarici possono avere cicli mestruali irregolari, anovulazione (assenza di ovulazione) o una ridotta riserva ovarica, tutti fattori che possono ridurre la fertilità e rendere il concepimento più difficile. L'insufficienza ovarica autoimmune è talvolta collegata ad altre condizioni autoimmuni, come la malattia di Addison, il lupus o i disturbi della tiroide.
4. Endometriosi e infiammazione
L'endometriosi è una condizione in cui il tessuto simile al rivestimento uterino (endometrio) cresce all'esterno dell'utero, spesso sulle ovaie, sulle tube di Falloppio e su altri organi pelvici. Sebbene l'endometriosi non sia propriamente una malattia autoimmune, è stato scoperto che comporta disfunzione del sistema immunitario e infiammazione cronica. Nelle donne con endometriosi, il sistema immunitario non riesce a eliminare il tessuto endometriale fuori posto, portando a un'infiammazione persistente. Questo ambiente infiammatorio può interferire con la qualità degli ovuli, interrompere l'ovulazione e creare aderenze (tessuto cicatriziale) che bloccano o danneggiano le tube di Falloppio. L'infiammazione e l'attività immunitaria associate all'endometriosi possono anche creare un ambiente ostile per sperma, ovuli ed embrioni, rendendo più difficile ottenere una gravidanza di successo.
5. Cellule Natural Killer (NK) e fallimento dell'impianto
Le cellule Natural Killer (NK) sono cellule immunitarie che svolgono un ruolo essenziale nei meccanismi di difesa dell'organismo, tra cui la regolazione delle risposte immunitarie nell'utero. In una gravidanza tipica, le cellule NK uterine aiutano a supportare l'impianto promuovendo il flusso sanguigno all'embrione in via di sviluppo. Tuttavia, alcune donne possono avere livelli elevati di cellule NK o cellule NK attivate in modo anomalo che prendono di mira e attaccano l'embrione, portando al fallimento dell'impianto o alla perdita precoce della gravidanza. Un'attività elevata delle cellule NK è associata ad aborti spontanei ricorrenti e può contribuire a un'infertilità inspiegata. Il test per l'attività delle cellule NK è controverso, poiché non tutti i ricercatori concordano sul suo impatto sulla fertilità, ma alcuni specialisti della fertilità possono offrire trattamenti immunomodulanti, come steroidi o immunoglobuline per via endovenosa (IVIG), per ridurre l'attività delle cellule NK e migliorare il successo dell'impianto.
6. Squilibrio delle citochine e risposta infiammatoria
Le citochine sono piccole proteine prodotte dalle cellule immunitarie che svolgono un ruolo nella segnalazione cellulare e nella regolazione immunitaria. Durante la gravidanza precoce, un ambiente citochinico bilanciato è necessario per supportare l'impianto dell'embrione e lo sviluppo fetale precoce. Tuttavia, uno squilibrio nelle citochine, in particolare un aumento delle citochine pro-infiammatorie, può interrompere questo processo. Nelle donne con infertilità correlata al sistema immunitario, livelli elevati di citochine infiammatorie possono creare un ambiente uterino sfavorevole, riducendo le possibilità di impianto dell'embrione o aumentando il rischio di aborto spontaneo. Condizioni come malattie autoimmuni, infezioni o infiammazioni croniche possono portare a uno squilibrio delle citochine, che può contribuire all'infertilità o alla perdita ricorrente della gravidanza.
7. Risposta immunitaria alla placenta
La placenta, che nutre il feto in via di sviluppo, è fondamentale per una gravidanza di successo. Durante una gravidanza normale, il sistema immunitario materno tollera la placenta, che ha materiale genetico sia della madre che del padre. Tuttavia, in alcune donne, il sistema immunitario può vedere la placenta come estranea e avviare una risposta immunitaria contro di essa. Questa risposta immunitaria può limitare il flusso sanguigno alla placenta, aumentando il rischio di aborto spontaneo, preeclampsia, restrizione della crescita intrauterina e altre complicazioni della gravidanza. Condizioni come la APS (sindrome da antifosfolipidi) sono esempi classici in cui le risposte immunitarie possono interferire con la funzione placentare, portando alla perdita della gravidanza.
8. Disfunzione dell'impianto immunologico
Alcune donne con infertilità inspiegata potrebbero avere quella che viene definita disfunzione immunologica dell'impianto. Questo termine si riferisce a una risposta immunitaria iperattiva o inappropriata che impedisce a un embrione di impiantarsi con successo nell'utero, anche se sia l'embrione che il rivestimento uterino sono sani. La disfunzione immunologica dell'impianto è ancora un'area di ricerca, ma si ritiene che implichi un'attività anomala delle cellule immunitarie, tra cui cellule NK, cellule T e macrofagi, o uno squilibrio nei fattori immunomodulatori all'interno dell'utero. Le opzioni di trattamento sono ancora in fase di sviluppo, ma alcuni specialisti della fertilità potrebbero utilizzare corticosteroidi, IVIG o altre terapie immunomodulanti per tentare di migliorare il successo dell'impianto.
Test diagnostici per l'infertilità immuno-correlata
I test per l'infertilità correlata al sistema immunitario possono comportare diversi approcci, a seconda del problema immunitario sospettato:
Esami del sangue: Gli esami del sangue possono rilevare anticorpi specifici (ad esempio anticorpi anti-sperma, anticorpi anti-ovaio, anticorpi antifosfolipidi) e misurare i livelli o l'attività delle cellule immunitarie.
Analisi delle cellule NK: Questi test valutano i livelli e l'attività delle cellule natural killer nel sangue o nell'utero, anche se la loro utilità clinica è ancora dibattuta.
Test del profilo citochinico:Questo test misura i livelli di citochine pro-infiammatorie e antinfiammatorie per valutare l'equilibrio immunitario, in particolare nelle donne con aborti ricorrenti.
Isteroscopia o biopsia: È possibile eseguire un'isteroscopia (visualizzazione dell'utero tramite una telecamera) o una biopsia endometriale per valutare l'infiammazione o l'attività immunitaria direttamente nell'utero.
Opzioni di trattamento per l'infertilità immuno-correlata
I trattamenti per l'infertilità correlata al sistema immunitario mirano ad affrontare il problema immunitario specifico e a migliorare le possibilità di una gravidanza di successo:
Farmaci immunomodulatori:
• Corticosteroidi: Gli steroidi a basso dosaggio, come il prednisone, possono essere utilizzati per ridurre l'attività immunitaria e l'infiammazione, in particolare nei casi di aumento delle cellule NK o di fallimento dell'impianto correlato al sistema immunitario.
• Immunoglobulina endovenosa (IVIG): Le IVIG vengono utilizzate in alcuni casi per sopprimere risposte immunitarie anomale, soprattutto nelle donne con aborti spontanei ricorrenti o aumento delle cellule NK, sebbene il loro utilizzo sia ancora sperimentale.
• Eparina a basso peso molecolare (LMWH) e aspirina:In caso di APS o disturbi della coagulazione, i farmaci anticoagulanti come l'eparina e l'aspirina possono ridurre il rischio di coaguli di sangue, favorendo la salute della placenta e riducendo il rischio di aborto spontaneo.
Antibiotici per le infezioni: in caso di cervicite o infezioni di basso grado, gli antibiotici possono ridurre l'infiammazione nell'apparato riproduttivo, migliorando potenzialmente la fertilità.
Tecniche di riproduzione assistita (ART):
Nei casi in cui i problemi immunitari influiscono sul concepimento naturale, le opzioni ART come la fecondazione in vitro possono aggirare alcune barriere immunitarie consentendo alla fecondazione di avvenire all'esterno del corpo. Tecniche come l'iniezione intracitoplasmatica di spermatozoi (ICSI) possono essere utilizzate in caso di anticorpi anti-sperma e il trasferimento di embrioni può aggirare il muco cervicale ostile o le risposte immunitarie anomale alla cervice.
7- Difetti della trombofilia
La trombofilia, una condizione caratterizzata da una maggiore tendenza alla formazione di coaguli di sangue, può avere un impatto significativo sulla fertilità femminile, in particolare influenzando l'impianto e aumentando il rischio di complicazioni durante la gravidanza. La trombofilia può essere ereditaria (genetica) o acquisita e spesso comporta anomalie nei meccanismi di coagulazione del sangue. Sebbene la trombofilia di per sé non impedisca direttamente il concepimento, può creare un ambiente che rende difficile il progredire di una gravidanza, portando ad aborti spontanei ricorrenti, complicazioni durante la gravidanza e, in alcuni casi, problemi con l'impianto.
Tipi di trombofilia e il loro impatto sulla fertilità
La trombofilia può derivare da mutazioni genetiche o condizioni acquisite che influenzano la coagulazione del sangue. I tipi comuni di trombofilia associati a infertilità e perdita di gravidanza includono:
Trombofilie ereditarie:
UN) Mutazione del fattore V di Leiden: Questa mutazione rende il sangue più incline alla coagulazione alterando la funzione del fattore di coagulazione V, una proteina presente nel sangue. Le donne con questa mutazione hanno un
B) Mutazione del gene della protrombina (G20210A):Questa mutazione aumenta i livelli di protrombina, un'altra proteina della coagulazione, portando a un rischio più elevato di coaguli di sangue e alla conseguente interruzione di gravidanza.
C) Carenze di proteina C, proteina S e antitrombina: Si tratta di rare condizioni ereditarie che riducono la capacità del corpo di regolare la coagulazione. Le carenze di queste proteine aumentano il rischio di coaguli di sangue anomali e complicazioni in gravidanza.
Trombofilia acquisita:
UN) Sindrome da anticorpi antifosfolipidi (APS): L'APS è una malattia autoimmune in cui il sistema immunitario produce anticorpi contro i fosfolipidi, molecole presenti nelle membrane cellulari. L'APS è fortemente associata all'infertilità e all'aborto spontaneo ricorrente, poiché gli anticorpi causano coaguli di sangue nella placenta, riducendo il flusso sanguigno al feto e portando alla perdita della gravidanza.
B) Iperomocisteinemia: Livelli elevati di omocisteina (un aminoacido) nel sangue possono aumentare il rischio di coaguli di sangue e sono associati a perdita di gravidanza e problemi alla placenta. L'iperomocisteinemia è talvolta collegata a mutazioni del gene MTHFR.
Come la trombofilia influenza l'impianto e la gravidanza precoce
La coagulazione del sangue svolge un ruolo critico nella gravidanza precoce, in particolare nella formazione della placenta, che sostiene l'embrione. La trombofilia può interferire con questi processi in diversi modi.
La trombofilia può causare la formazione di microcoaguli nei vasi sanguigni dell'utero e della placenta. Questi coaguli possono limitare il flusso sanguigno all'endometrio (rivestimento uterino) e alla placenta in via di sviluppo, privando l'embrione di nutrienti essenziali e ossigeno. Nelle prime fasi della gravidanza, un flusso sanguigno insufficiente può impedire un corretto impianto e portare a una perdita precoce della gravidanza.
L'impianto, in cui l'embrione si attacca al rivestimento endometriale, richiede un apporto di sangue sano e vasi sanguigni ben funzionanti. Se la coagulazione interrompe il flusso di sangue all'utero, può creare un ambiente inospitale per l'embrione, riducendo la probabilità di un impianto riuscito. Le donne con trombofilia possono sperimentare un'infertilità inspiegata a causa di ripetuti fallimenti di impianto, anche se si verifica la fecondazione.
La trombofilia è un noto fattore di rischio per l'aborto spontaneo ricorrente, definito come due o più perdite di gravidanza consecutive. I coaguli di sangue che si formano nei vasi sanguigni della placenta possono portare a insufficienza placentare, in cui la placenta non riesce a supportare adeguatamente l'embrione o il feto in via di sviluppo. Ciò può causare:
Perdita precoce della gravidanza: Molte donne affette da trombofilia subiscono un aborto spontaneo nel primo trimestre, poiché si formano coaguli di sangue nei piccoli vasi sanguigni della placenta, interrompendo l'afflusso di sangue all'embrione.
Perdita del secondo trimestre: La trombofilia può anche portare all'interruzione della gravidanza nel secondo trimestre a causa dello scarso sviluppo della placenta e del flusso sanguigno, che può provocare una restrizione della crescita fetale o il distacco della placenta (quando la placenta si stacca dalla parete uterina).
Morte in utero: In rari casi, la trombofilia può contribuire alla morte del feto se il flusso sanguigno al feto è gravemente limitato nelle fasi avanzate della gravidanza.
Test diagnostici per la trombofilia nell'infertilità
Le donne che soffrono di aborti ricorrenti, infertilità inspiegata o complicazioni della gravidanza possono essere sottoposte a test per la trombofilia. I test più comuni includono:
• Test di coagulazione del sangue: Questi test misurano i livelli dei fattori della coagulazione e delle proteine nel sangue, come il fattore V di Leiden, la protrombina, la proteina C, la proteina S e l'antitrombina.
• Test degli anticorpi antifosfolipidi: Questo test verifica la presenza di anticorpi antifosfolipidi, associati all'APS. I test possono includere anticorpi anticardiolipina, anticoagulante lupico e anticorpi beta-2 glicoproteina I.
• Livelli di omocisteina: Livelli elevati di omocisteina sono associati a disturbi della coagulazione e possono indicare una mutazione genetica sottostante, come una mutazione MTHFR.
Con una gestione adeguata, che include la terapia anticoagulante e un attento monitoraggio, molte donne con trombofilia possono concepire con successo e portare a termine una gravidanza sana. La diagnosi e il trattamento precoci sono fondamentali per ridurre i rischi associati alla trombofilia e migliorare i risultati in termini di fertilità.
8- Fattori legati allo stile di vita ed esposizioni ambientali
I fattori legati allo stile di vita hanno un impatto significativo sulla fertilità femminile, influenzando l'ovulazione, la qualità degli ovociti, i livelli ormonali e la salute riproduttiva generale. Diversi fattori chiave legati allo stile di vita che possono influenzare la fertilità includono dieta, peso, attività fisica, livelli di stress, fumo, consumo di alcol ed esposizione a tossine ambientali.
1. Dieta e nutrizione
Una dieta ben bilanciata che fornisca nutrienti essenziali è fondamentale per la salute riproduttiva. Nutrienti, vitamine e minerali specifici supportano l'ovulazione, la produzione di ormoni e la qualità degli ovociti. Una cattiva alimentazione o carenze specifiche possono interrompere questi processi, influenzando la fertilità:
Antiossidanti: gli alimenti ricchi di antiossidanti (come le vitamine C ed E, l'acido folico e il beta-carotene) aiutano a proteggere le uova dallo stress ossidativo, che può comprometterne la qualità.
Acido folico: questa vitamina del gruppo B è fondamentale per la sintesi del DNA e la divisione cellulare, rendendola essenziale per la qualità degli ovociti e lo sviluppo dell'embrione.
Ferro: la carenza di ferro può causare problemi ovulatori, poiché il ferro è essenziale per la produzione di sangue e il trasporto di ossigeno.
Grassi sani: gli acidi grassi Omega-3, presenti nel pesce, nei semi di lino e nelle noci, aiutano a ridurre l'infiammazione e a supportare la produzione di ormoni. I grassi trans, comunemente presenti negli alimenti trasformati, possono influire negativamente sull'ovulazione e dovrebbero essere evitati.
Alto contenuto di zuccheri e cibi lavorati: le diete ricche di zuccheri e cibi lavorati possono portare a resistenza all'insulina e squilibri ormonali, che possono influire sull'ovulazione.
Una dieta sana e ricca di nutrienti favorisce cicli mestruali regolari, migliora la qualità degli ovociti e crea un ambiente favorevole al concepimento.
2. Peso corporeo e fertilità
Il peso corporeo ha un effetto significativo sulla fertilità. Sia essere sottopeso che sovrappeso può portare a squilibri ormonali che interrompono l'ovulazione e la regolarità mestruale:
Sottopeso: le donne con un indice di massa corporea (BMI) molto basso possono avere cicli irregolari o assenti (amenorrea) a causa di bassi livelli di estrogeni. Gli estrogeni sono essenziali per l'ovulazione e per sostenere un ciclo mestruale sano, e un grasso corporeo insufficiente può comprometterne la produzione.
Sovrappeso/Obesità: il peso in eccesso, soprattutto nella zona addominale, è legato a squilibri ormonali e condizioni come la sindrome dell'ovaio policistico (PCOS), che può ostacolare l'ovulazione. L'obesità può portare a resistenza all'insulina, livelli elevati di androgeni e riduzione della fertilità. Gli studi suggeriscono che anche una riduzione del peso di 5-10% può migliorare l'ovulazione e aumentare la probabilità di concepimento.
Mantenere un peso sano è uno dei modi più efficaci per ottimizzare la fertilità e migliorare i risultati riproduttivi.
3. Attività fisica
L'attività fisica regolare supporta la salute generale, la regolazione ormonale e la gestione del peso. Tuttavia, l'impatto dell'esercizio sulla fertilità può dipendere dalla sua intensità:
• Esercizio moderato: un'attività fisica moderata e regolare può migliorare la fertilità regolando il peso, riducendo lo stress e migliorando il flusso sanguigno verso gli organi riproduttivi. È generalmente consigliato alle donne che cercano di concepire.
• Esercizio eccessivo: l'esercizio intenso e ad alto impatto può portare a squilibri ormonali, specialmente nelle donne con basso grasso corporeo. L'esercizio eccessivo può causare una diminuzione dei livelli di estrogeni, interrompere i cicli mestruali e, nei casi gravi, portare ad amenorrea ipotalamica (assenza di mestruazioni dovuta a produzione insufficiente di ormoni).
Per sostenere la salute riproduttiva è fondamentale bilanciare i livelli di attività fisica, concentrandosi su routine di esercizi moderate e costanti.
4. Stress e benessere emotivo
Lo stress cronico può influire negativamente sulla fertilità interrompendo l'equilibrio ormonale e l'ovulazione. Livelli elevati di stress aumentano la produzione di cortisolo, un ormone che può interferire con gli ormoni riproduttivi come il GnRH (ormone di rilascio delle gonadotropine), che regola l'ovulazione. Lo stress è anche associato a comportamenti di adattamento malsani, come una dieta povera, la mancanza di sonno e l'inattività fisica, che possono avere un ulteriore impatto sulla fertilità. Inoltre, il peso emotivo dello stress può rendere il concepimento più difficile e può persino contribuire a un ciclo di stress e infertilità. Le pratiche di consapevolezza, la consulenza e le tecniche di gestione dello stress come yoga, meditazione o terapia possono essere utili per le donne che cercano di concepire.
5. Fumo
Il fumo è uno dei fattori di stile di vita più dannosi che influiscono sulla fertilità. Il tabacco contiene sostanze chimiche tossiche, come nicotina, monossido di carbonio e catrame, che possono avere un impatto sulla salute riproduttiva in diversi modi:
• Qualità degli ovuli: il fumo accelera la perdita degli ovuli e ne danneggia la qualità, portando a un rischio maggiore di anomalie cromosomiche.
• Ovulazione: le fumatrici hanno maggiori probabilità di avere problemi ovulatori, rendendo più difficile il concepimento.
• Salute uterina: il fumo influisce sul flusso sanguigno verso l'utero, creando potenzialmente un ambiente sfavorevole all'impianto dell'embrione.
• Menopausa precoce: le donne che fumano spesso raggiungono la menopausa 1-4 anni prima rispetto alle non fumatrici, riducendo il loro periodo fertile.
Anche l'esposizione al fumo passivo può avere un impatto sulla fertilità. Smettere di fumare è uno dei cambiamenti più benefici che una donna possa fare per migliorare le sue possibilità di concepimento.
6. Consumo di alcol
Il consumo eccessivo di alcol può danneggiare la fertilità e i risultati della gravidanza:
• Ovulazione e squilibri ormonali: un consumo eccessivo di alcol può interferire con la produzione di ormoni necessari per l'ovulazione e la regolarità mestruale, aumentando il rischio di infertilità.
• Tassi di fertilità ridotti: gli studi suggeriscono che le donne che consumano alti livelli di alcol potrebbero avere tassi di fertilità ridotti rispetto alle donne che bevono moderatamente o non bevono.
• Rischi durante la gravidanza: bere alcol può influire sulle prime fasi della gravidanza, aumentando il rischio di aborto spontaneo e problemi allo sviluppo fetale.
Sebbene un consumo moderato di alcol possa avere effetti minimi, alle donne che cercano di concepire si raccomanda generalmente di astenersi o ridurre il consumo di alcol.
7. Assunzione di caffeina
Sebbene un consumo moderato di caffeina (ad esempio, fino a 200 mg al giorno, ovvero circa un caffè da 12 once) sia generalmente considerato sicuro, livelli elevati di consumo di caffeina possono avere un impatto negativo sulla fertilità:
• Ritardo del concepimento: alcuni studi hanno dimostrato che un elevato consumo di caffeina può essere associato a un ritardo del concepimento o a un aumento del rischio di aborto spontaneo.
• Ridotto assorbimento di alcuni nutrienti: un consumo eccessivo di caffeina può interferire con l'assorbimento di nutrienti essenziali come calcio e ferro, importanti per la salute riproduttiva.
La maggior parte degli operatori sanitari consiglia di limitare l'assunzione di caffeina quando si cerca di concepire.
8. Tossine ambientali ed esposizione chimica
L'esposizione a tossine ambientali, tra cui alcune sostanze chimiche, inquinanti e sostanze chimiche che alterano il sistema endocrino, può avere un impatto sulla fertilità:
• Interferenti endocrini: sostanze chimiche come il bisfenolo A (BPA), i ftalati e i pesticidi possono imitare o bloccare gli ormoni naturali, provocando squilibri ormonali che interrompono l'ovulazione, i cicli mestruali e la funzione riproduttiva in generale.
• Metalli pesanti: l'esposizione a metalli pesanti come piombo e mercurio può compromettere la funzionalità ovarica, ridurre la qualità degli ovociti e interferire con il ciclo mestruale.
• Rischi professionali: le donne che lavorano in determinati settori, come l'agricoltura, la produzione o i laboratori, possono essere esposte a sostanze chimiche e radiazioni che influiscono negativamente sulla fertilità.
Ridurre l'esposizione alle tossine ambientali, ad esempio evitando contenitori di plastica contenenti BPA, scegliendo alimenti biologici quando possibile e riducendo al minimo l'uso di determinati cosmetici, può aiutare a sostenere la salute riproduttiva.
9. Modelli del sonno e ritmo circadiano
Le cattive abitudini del sonno e i modelli di sonno irregolari possono influire sulla fertilità alterando i livelli ormonali, in particolare gli ormoni riproduttivi che regolano l'ovulazione e i cicli mestruali:
• Melatonina e salute riproduttiva: la melatonina, un ormone associato al sonno, agisce anche come antiossidante che protegge le uova dai danni. Le donne con un sonno insufficiente o di scarsa qualità possono avere livelli di melatonina ridotti, con un potenziale impatto sulla salute delle uova.
• Lavoro a turni: le donne che lavorano di notte o hanno orari irregolari possono avere ritmi circadiani alterati, che possono portare a irregolarità mestruali e riduzione della fertilità.
Mantenere ritmi di sonno regolari e cercare di dormire dalle 7 alle 8 ore a notte può aiutare a sostenere l'equilibrio ormonale e la salute riproduttiva.
10. Uso di droghe ricreative
L'uso di droghe ricreative, come marijuana, cocaina e altre sostanze, può avere effetti dannosi sulla fertilità:
• Squilibri ormonali: molte droghe ricreative interferiscono con i segnali ormonali necessari per l'ovulazione e la regolarità mestruale.
• Qualità degli ovociti e ovulazione: alcuni farmaci, in particolare la marijuana, sono stati associati a disturbi dell'ovulazione e a una ridotta qualità degli ovociti.
• Complicazioni in gravidanza: l'uso di farmaci durante il concepimento o la gravidanza può portare ad aborto spontaneo, malformazioni congenite e problemi di sviluppo nel feto.
Evitare le droghe ricreative è essenziale per ottimizzare la fertilità e ridurre i rischi associati alla gravidanza.
Centro FIVET di Cipro del Nord
North Cyprus IVF Center è una clinica per la fertilità incentrata sul paziente, situata all'interno di "Elite Research and Surgical Hospital” a Nicosia, Cipro. La nostra clinica è una delle cliniche per la fertilità più avanzate al mondo e offre una più ampia scelta di opzioni di trattamento a prezzi convenienti.
Contattaci
Telefono
Inglese: +90 548 875 8000
Francese: +90 548 876 8000
Turco: +90 542 869 8000
Arabo: +90 548 875 8000
Tedesco: +90 548 830 1987
Russo: +90 548 828 9955
info@northcyprusivf.net
© 2020 LowCostIVF - Tutti i diritti riservati. politica sulla riservatezza

