- Di
- Blog
- Infertilità
- Trattamenti di fecondazione in vitro
- Nuovi progressi della fecondazione in vitro
- Terapia sostitutiva mitocondriale!
- Trattamento di fecondazione in vitro a Cipro
- IUI
- Mini fecondazione in vitro
- FIVET + ICSI
- FIV citoplasmatica
- Ciclo tandem di fecondazione in vitro
- Donazione di ovuli
- Donazione di embrioni
- Donazione di sperma
- Genere – Selezione del sesso
- Maternità gestazionale
- Surrogazione gay dello stesso sesso
- Recupero chirurgico dello sperma
- Diagnosi genetica preimpianto PGD
- Congelamento delle uova
- Selezione di genere utilizzando ovociti donati
- Prevenzione dell'anemia falciforme
- FAQ
- Viaggio
- Di
- Blog
- Infertilità
- Trattamenti di fecondazione in vitro
- Nuovi progressi della fecondazione in vitro
- Terapia sostitutiva mitocondriale!
- Trattamento di fecondazione in vitro a Cipro
- IUI
- Mini fecondazione in vitro
- FIVET + ICSI
- FIV citoplasmatica
- Ciclo tandem di fecondazione in vitro
- Donazione di ovuli
- Donazione di embrioni
- Donazione di sperma
- Genere – Selezione del sesso
- Maternità gestazionale
- Surrogazione gay dello stesso sesso
- Recupero chirurgico dello sperma
- Diagnosi genetica preimpianto PGD
- Congelamento delle uova
- Selezione di genere utilizzando ovociti donati
- Prevenzione dell'anemia falciforme
- FAQ
- Viaggio
Terapia con cellule staminali per l'azoospermia
Trattamento dell'azoospermia
In che modo il trattamento con cellule staminali può aiutare con l'infertilità maschile?
L'azoospermia è una condizione in cui non ci sono spermatozoi vivi o maturi nell'eiaculato di un uomo. Nella maggior parte dei casi, l'eiaculato può contenere sperma con altre cellule, quindi, l'esistenza di un eiaculato fluido non suggerisce l'esistenza di spermatozoi. L'azoospermia può essere divisa in due categorie principali:
Azoospermia ostruttiva: Quando si verifica un'ostruzione, gli spermatozoi non possono essere rilasciati nell'eiaculato, anche se la produzione di sperma rimane attiva. L'azoospermia ostruttiva può derivare da varie cause. La causa più comune oggi è la vasectomia, una condizione di cui i pazienti sono in genere a conoscenza. Tuttavia, anche altri fattori possono impedire agli spermatozoi di entrare nell'eiaculato. Questi fattori includono:
1. Anomalie del sistema duttale
Gli spermatozoi devono viaggiare attraverso il sistema duttale per raggiungere l'uretra. Dopo essere stati prodotti nei testicoli, gli spermatozoi passano attraverso diverse strutture, tra cui l'epididimo, il dotto deferente (o dotto deferente), il dotto eiaculatorio e l'uretra. Qualsiasi interruzione nel trasporto degli spermatozoi attraverso o tra queste strutture può ostruirne il percorso. (Fare riferimento alla figura sottostante per una rappresentazione visiva di queste strutture.)
2. Disfunzione eiaculatoria
Il processo di emissione, in cui lo sperma viene depositato nell'uretra prima dell'eiaculazione, può funzionare male. Questa disfunzione può derivare da danni neurologici o, in alcuni casi, da diabete incontrollato.
In caso di azoospermia ostruttiva, utilizzando tecniche chirurgiche di estrazione dello sperma spesso aiutano a ottenere un numero accettabile di spermatozoi vitali da utilizzare durante un ciclo di fecondazione in vitro.
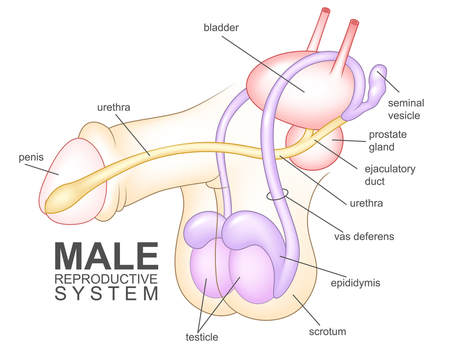
Trattamento dell'azoospermia non ostruttiva: L'azoospermia non ostruttiva (NOA) è una condizione caratterizzata dall'assenza di spermatozoi nell'eiaculato a causa di una produzione di spermatozoi alterata nei testicoli. A differenza dell'azoospermia ostruttiva, che deriva da blocchi nel tratto riproduttivo, la NOA deriva da una disfunzione testicolare intrinseca. Ciò può verificarsi a causa di anomalie genetiche (come la sindrome di Klinefelter o le microdelezioni del cromosoma Y), squilibri ormonali o danni ai testicoli dovuti a infezioni, traumi, chemioterapia o radiazioni. In molti casi, la causa sottostante rimane idiopatica. La NOA è una causa significativa di infertilità maschile e spesso si presenta con un volume testicolare più piccolo e livelli elevati di ormone follicolo-stimolante (FSH) mentre il corpo tenta di compensare la ridotta spermatogenesi. La diagnosi in genere comporta la profilazione ormonale, test genetici e occasionalmente una biopsia testicolare per confermare l'assenza di spermatozoi maturi.
Lo scopo di una biopsia testicolare è di ispezionare a fondo il tessuto testicolare per la presenza di spermatozoi meno maturi. Anche quando la spermatogenesi (il processo di produzione e maturazione dello sperma) non si completa completamente, potrebbero esserci stadi precedenti di spermatozoi presenti che possono essere eventualmente utilizzati. Il seguente diagramma mostra il ciclo completo della spermatogenesi dalle cellule staminali agli spermatozoi maturi:
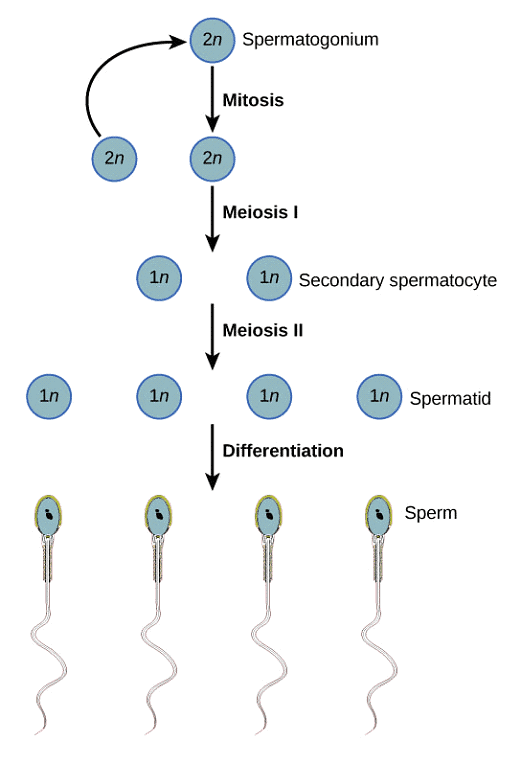
Se la biopsia del paziente rivela la presenza di spermatidi in fase avanzata (spermatidi allungati), anche se il concepimento naturale non funzionerà, gli spermatidi in fase avanzata vengono spesso utilizzati con successo durante un ciclo di fecondazione in vitro con l'uso di ICSI. Tuttavia, qualsiasi stadio di maturazione dello sperma prima degli spermatidi allungati non darà luogo a un esito di fecondazione in vitro di successo.
A questo punto, se non sono presenti cellule germinali e viene fatta la diagnosi di sindrome delle sole cellule del Sertoli, allora l'unica altra opzione per generare un bambino sarà attraverso l'uso di sperma di donatore o l'adozione. Le cellule germinali sono cellule spermatiche immature che hanno il potenziale per crescere e differenziarsi in cellule spermatiche mature. Queste possono essere considerate cellule spermatiche immature e indifferenziate. Includono:
– Spermatogoni
– Spermatociti primari
– Spermatociti secondari
– Spermatidi in fase iniziale
– Spermatidi in fase avanzata
La presenza di cellule germinali nel tessuto testicolare è un prerequisito per la terapia con cellule staminali. Il motivo è semplice. Utilizziamo cellule staminali mesenchimali dal tessuto adiposo del paziente per il trattamento con cellule staminali. Le cellule staminali mesenchimali hanno un potenziale di differenziazione limitato. Tuttavia, date le giuste condizioni, possono differenziarsi in molti tipi di cellule. Le cellule staminali mesenchimali tendono principalmente a differenziarsi nei tipi di cellule circostanti, a meno che non siano specificamente programmate per differenziarsi in un tipo di cellula specifico. Nei nostri trattamenti, non è coinvolta alcuna programmazione cellulare. Le cellule staminali derivate dal tessuto adiposo del paziente vengono isolate e iniettate nel tessuto testicolare dove sono presenti le cellule germinali. Avendo cellule germinali nell'ambiente circostante, le cellule staminali le seguono come modello e si differenziano anche in cellule germinali. Tuttavia, questa è solo una parte del processo. Dato che le cellule germinali esistenti nei testicoli del paziente non sono in grado di completare la spermatogenesi e diventare cellule spermatiche completamente mature, sono necessari ulteriori passaggi per promuovere tale differenziazione.
Quando introduciamo cellule staminali nei tubuli seminiferi, iniettiamo anche il plasma ricco di piastrine del paziente, derivato dal suo campione di sangue periferico. Il plasma ricco di piastrine è ricco di fattori di crescita che consentono la crescita e lo sviluppo cellulare, oltre a migliorare l'afflusso di sangue al tessuto. Pertanto, le cellule staminali godono di una ricca infusione di fattori di crescita nelle vicinanze per facilitarne lo sviluppo. Inoltre, utilizziamo esosomi derivati dalla placenta per migliorare la comunicazione cellulare nei testicoli.
La terapia con cellule staminali, nel suo complesso, mira a:
1- Aumentare la popolazione di cellule germinali nel tessuto testicolare fornendo cellule staminali al tessuto testicolare.
2- Lasciare che queste cellule germinali crescano e si sviluppino con l'aiuto di fattori di crescita.
3- Migliorare la comunicazione cellulare e facilitare la risposta alla stimolazione ormonale con l'ausilio degli esosomi.
Che cosa è il plasma ricco di piastrine (PRP)? Il PRP è una concentrazione di piastrine derivate dal sangue di un individuo, arricchita con fattori di crescita e proteine bioattive che promuovono la guarigione e la rigenerazione dei tessuti. Il PRP è comunemente utilizzato nei trattamenti medici ed estetici per accelerare la riparazione dei tessuti danneggiati, ridurre l'infiammazione e stimolare la proliferazione cellulare.
Le piastrine svolgono un ruolo fondamentale nella guarigione delle ferite e nella riparazione dei tessuti, rilasciando fattori di crescita quali:
⦁ Fattore di crescita derivato dalle piastrine (PDGF): Stimola la crescita cellulare e la formazione di nuovi vasi sanguigni.
⦁ Fattore di crescita trasformante-beta (TGF-β): Favorisce la riparazione dei tessuti e riduce l'infiammazione.
⦁ Fattore di crescita endoteliale vascolare (VEGF): Favorisce la formazione di nuovi vasi sanguigni.
⦁ Fattore di crescita epidermico (EGF): Supporta la rigenerazione cellulare e la guarigione delle ferite.
Quando il PRP viene iniettato in una zona bersaglio, questi fattori di crescita reclutano e attivano i processi di guarigione naturali dell'organismo, tra cui l'attivazione delle cellule staminali e la sintesi del collagene.
Cosa sono gli esosomi?
Gli esosomi sono minuscole nanovescicole che si trovano negli spazi interstiziali e nei fluidi corporei. A causa delle loro dimensioni, gli esosomi sono sempre stati visti come artefatti o spazzatura cellulare senza alcuna funzione fisiologica. Tuttavia, con i progressi della ricerca nel campo della medicina, ora si sa che fanno parte di un meticoloso sistema di comunicazione intracellulare.
Gli esosomi sono noti per il loro coinvolgimento in tutti i tipi di comunicazione cellulare. Forniscono segnali autocrini locali tra tipi cellulari simili, segnali paracrini locali tra tipi cellulari diversi e segnali endocrini distanti. Il coinvolgimento in una segnalazione cellulare così estesa ha fatto guadagnare loro il nome di "signalosomi". Quando gli esosomi vengono introdotti nel corpo, migliorano la comunicazione attraverso tutti i canali, il che aiuta con la salute generale e la funzione delle cellule.
Rispetto alle cellule staminali adulte, gli esosomi contengono 300% più fattori di crescita, essenziali per la crescita cellulare, lo sviluppo e la rigenerazione. Gli esosomi possono essere somministrati tramite infusione endovenosa o possono essere diretti in un sito specifico mediante iniezione diretta.
Come si svolge la terapia con cellule staminali?
Al North Cyprus IVF Center, le terapie con cellule staminali che eseguiamo per il trattamento dell'azoospermia non ostruttiva utilizzano un cocktail di cellule staminali mesenchimali, plasma ricco di piastrine ed esosomi. L'isolamento delle cellule staminali richiede una procedura chirurgica chiamata liposuzione.
IL procedura di liposuzione per ottenere cellule staminali mesenchimali (MSC) è una tecnica chirurgica minimamente invasiva utilizzata per raccogliere tessuto adiposo, che è una ricca fonte di MSC. La procedura chirurgica prevede una serie di passaggi:
1. Preparazione preoperatoria:
Il paziente viene sottoposto a una valutazione medica per assicurarsi che sia idoneo alla procedura. Ciò comporta una serie di test ormonali, potenzialmente una valutazione dello scroto e una biopsia testicolare per valutare la cellularità dei tubuli seminiferi.
Al paziente verrà inoltre chiesto di sottoporsi ad alcuni esami del sangue per controllare la funzionalità epatica e renale, nonché alcuni marker tumorali come l'alfa-fetoproteina (AFP) e la beta-gonadotropina corionica umana (β-hCG).
2. Iniezione di soluzione tumescente:
Una soluzione tumescente, contenente soluzione salina, lidocaina (un anestetico locale) ed epinefrina (per ridurre il sanguinamento), viene iniettata nell'area interessata. Questa soluzione aiuta ad allentare le cellule adipose, riduce il dolore e riduce al minimo il sanguinamento durante la procedura.
3. Estrazione del grasso (liposuzione):
Viene praticata una piccola incisione sulla pelle e un cannula (un tubo sottile e cavo) viene inserito. La cannula è collegata a un dispositivo a vuoto, che aspira delicatamente il tessuto adiposo da aree come l'addome, le cosce o i glutei.
4. Elaborazione del tessuto adiposo:
Il grasso estratto viene raccolto in contenitori sterili e processato per isolare le MSC. Il processo prevede:
Centrifugazione per separare il grasso da altri componenti come sangue e fluidi,
Digestione enzimatica utilizzando la collagenasi per scomporre la matrice extracellulare e rilasciare le MSC.
Filtrazione e lavaggio per purificare le MSC e rimuovere i detriti.
5. Reimpianto:
Le MSC vengono trasformate in un cocktail con PRP ed esosomi e vengono iniettate direttamente nelle aree bersaglio nei testicoli. L'intera procedura viene eseguita in poche ore quando il paziente è sotto sedazione. Pertanto, le procedure di liposuzione e reimpianto vengono eseguite in una volta sola senza richiedere due sedazioni separate.
Sebbene la procedura sia generalmente sicura, i rischi includono piccole contusioni, infezioni o fastidi nel sito di liposuzione o reimpianto. Questa tecnica è ampiamente utilizzata nella medicina rigenerativa grazie all'elevata potenza e versatilità delle MSC derivate dal tessuto adiposo.
Durata richiesta del soggiorno a Cipro:
La maggior parte dei nostri pazienti ci raggiunge dall'estero. A causa di impegni lavorativi o domestici, i tempi di viaggio possono essere limitati. Ecco perché chiediamo che i test preliminari/biopsia vengano eseguiti localmente prima dell'arrivo del paziente, in modo da ridurre al minimo la durata del soggiorno a Cipro. Ci si aspetta che tu rimanga a Cipro per circa 3 giorni per la terapia con cellule staminali. Questo ci darà abbastanza tempo per eseguire i test preoperatori necessari, ottenere il tuo campione di sangue ed eseguire la procedura. Ci si aspetta che tu rimanga per la notte nel nostro ospedale per osservazione e potrai tornare a casa il giorno successivo.
Cosa aspettarsi dopo la procedura? Percentuali di successo:
Dopo l'iniezione di cellule staminali, c'è un periodo di attesa di tre mesi per osservare l'effetto. La spermatogenesi (produzione e maturazione degli spermatozoi) richiede circa 65-70 giorni. Pertanto, le cellule staminali che vengono impiantate richiederanno questo lasso di tempo prima di poter osservare qualsiasi effetto.
Il successo della procedura dipende in larga misura dalla cellularità di base del tessuto testicolare, per cominciare. I pazienti che hanno già spermatidi in fase precoce o avanzata nel loro tessuto testicolare (Jpunteggio ohnsen di 7 o 8) sono il gruppo di pazienti che ha le maggiori possibilità di successo con la terapia con cellule staminali. Nella maggior parte dei casi, siamo in grado di osservare spermatozoi maturi nell'eiaculato dopo il periodo di tre mesi. Mentre il numero di spermatozoi maturi nell'eiaculato non sarà sufficiente per il concepimento naturale, spesso pianifichiamo ed eseguiamo un ciclo di fecondazione in vitro di successo con questo gruppo di pazienti. La possibilità di ottenere con successo spermatozoi maturi nell'eiaculato in questo gruppo di pazienti è di circa 75%.
Pazienti che non hanno spermatidi nei tubuli seminiferi (forse alcuni) ma hanno spermatociti secondari (Punteggio Johnsen da 5 a 6) sono anche propensi a vedere un miglioramento nella loro attività spermatogenica che può portare a spermatozoi maturi che possono entrare nell'eiaculato. Tuttavia, in questo gruppo di pazienti, osservare spermatozoi maturi nell'eiaculato è meno comune. La nostra aspettativa in questo gruppo di pazienti è di essere in grado di trovare spermatidi in maturazione in una biopsia testicolare da utilizzare durante un ciclo di fecondazione in vitro. Se l'analisi del liquido seminale eseguita tre mesi dopo la terapia con cellule staminali non indica alcuno spermatozoo nell'eiaculato, il passo successivo sarà quello di organizzare una procedura di estrazione dello sperma testicolare per ottenere spermatozoi vitali che possono essere utilizzati durante l'ICSI. La possibilità di ottenere con successo spermatozoi maturi nell'eiaculato in questo gruppo di pazienti è di circa 25%. La possibilità di trovare spermatozoi vitali nell'eiaculato o tramite TESE è di circa 40%.
I pazienti che hanno solo spermatociti primari nei loro tubuli seminiferi (Punteggio Johnsen di 4) non è probabile che si osservino spermatozoi maturi nell'eiaculato dopo la procedura con cellule staminali. Nella maggior parte dei casi, vediamo un miglioramento nell'attività spermatogenica nel senso che il tessuto diventa più popolato di cellule germinali. Tuttavia, nella grande maggioranza dei pazienti, non troviamo spermatozoi sufficientemente maturi da essere utilizzati durante l'ICSI. Il successo con questo gruppo di pazienti può essere stimato a 15%, il che significa che 15% di pazienti avranno spermatozoi sufficientemente maturi da poter essere utilizzati in un ciclo di fecondazione in vitro.
Sulla base delle statistiche dei nostri pazienti fino ad oggi, i pazienti con solo spermatogoni nei tubuli seminiferi (Punteggio Johnsen di 3) hanno probabilità di avere 6% di avere spermatozoi sufficientemente maturi da poter essere utilizzati durante l'ICSI dopo la procedura con cellule staminali.
Non ci aspettiamo un esito positivo nel gruppo di pazienti con punteggio di Johnsen pari o inferiore a 2 (sindrome delle sole cellule del Sertoli o nessuna cellula).
Cos'è il punteggio Johnsen?
IL Sistema di punteggio Johnsen è un metodo istologico utilizzato per valutare campioni di biopsia testicolare valutando la spermatogenesi (la produzione di sperma) nei tubuli seminiferi. Sviluppato da SG Johnsen nel 1970, il sistema assegna un punteggio numerico a ciascun tubulo seminifero in base alla presenza e alla maturità delle cellule germinali, nonché allo stato generale della spermatogenesi. È comunemente utilizzato nella valutazione dell'infertilità maschile.
Criteri di punteggio
A ciascun tubulo seminifero viene assegnato un punteggio che va da Da 1 a 10 in base ai seguenti criteri:
Punteggio 10: Spermatogenesi completa con molti spermatozoi visibili.
Punteggio 9: Spermatogenesi leggermente ridotta ma con molti spermatidi in fase avanzata presenti.
Punteggio 8: Pochi spermatidi tardivi, che indicano una spermatogenesi moderatamente compromessa.
Punteggio 7: Presenza di molti spermatidi precoci ma nessun spermatozoo o spermatidi tardivi.
Punteggio 6: Presenza di pochi spermatidi precoci ma nessun spermatozoo o spermatozoo tardivo.
Punteggio 5: Sono presenti molti spermatociti, ma non spermatidi o spermatozoi.
Punteggio 4: Sono presenti pochi spermatociti, ma non spermatidi o spermatozoi.
Punteggio 3: Sono presenti spermatogoni (precursori delle cellule germinali), ma non spermatociti, spermatidi o spermatozoi.
Punteggio 2: Solo cellule del Sertoli, senza cellule germinali presenti.
Punteggio 1: Nessun tubulo seminifero presente nella biopsia (danno testicolare estremo).
Interpretazione dei punteggi
UN punteggio più alto indica una spermatogenesi normale o quasi normale.
UN punteggio più basso riflette una spermatogenesi alterata o assente.
Calcolando il punteggio medio Johnsen in tutti i tubuli esaminati, possiamo quantificare il grado di compromissione della spermatogenesi e prendere decisioni informate sulle opzioni di trattamento, come ad esempio procedere con tecnologie di riproduzione assistita, utilizzare trattamenti con cellule staminali o valutare opzioni di donazione.
Costo della terapia con cellule staminali per l'azoospermia non ostruttiva:
Il costo della terapia con cellule staminali per il trattamento dell'azoospermia non ostruttiva è di 7.000 euro, incluso il protocollo PRP, la liposuzione e la purificazione delle cellule staminali, gli esosomi e l'impianto nel tessuto testicolare. In questo preventivo è incluso anche un pernottamento in ospedale.
Non esitate a contattarci Contattaci per maggiori informazioni.
Nuovi progressi nelle tecnologie IVF
Centro FIVET di Cipro del Nord
North Cyprus IVF Center è una clinica per la fertilità incentrata sul paziente, situata all'interno di "Elite Research and Surgical Hospital” a Nicosia, Cipro. La nostra clinica è una delle cliniche per la fertilità più avanzate al mondo e offre una più ampia scelta di opzioni di trattamento a prezzi convenienti.
Contattaci
Telefono
Inglese: +90 548 875 8000
Francese: +90 548 876 8000
Turco: +90 542 869 8000
Arabo: +90 548 875 8000
Tedesco: +90 548 830 1987
Russo: +90 548 828 9955
info@northcyprusivf.net
© 2020 LowCostIVF - Tutti i diritti riservati. politica sulla riservatezza


