- Nosotros
- Blog
- Esterilidad
- Tratamientos de FIV
- Nuevos avances en FIV
- Terapia de reemplazo mitocondrial!
- Tratamiento de FIV en Chipre
- IUI
- Mini FIV
- FIV + IICE
- FIV citoplasmática
- Ciclo de FIV en tándem
- donación de óvulos
- Donación de embriones
- Donación de esperma
- Género - Selección de sexo
- Subrogación gestacional
- Subrogación gay del mismo sexo
- Recuperación quirúrgica de espermatozoides
- Diagnóstico Genético Pre Implantación DGP
- Congelación de óvulos
- Selección de género utilizando óvulos de donantes
- Prevención de la enfermedad de células falciformes
- Preguntas Frecuentes
- Viajar
- Nosotros
- Blog
- Esterilidad
- Tratamientos de FIV
- Nuevos avances en FIV
- Terapia de reemplazo mitocondrial!
- Tratamiento de FIV en Chipre
- IUI
- Mini FIV
- FIV + IICE
- FIV citoplasmática
- Ciclo de FIV en tándem
- donación de óvulos
- Donación de embriones
- Donación de esperma
- Género - Selección de sexo
- Subrogación gestacional
- Subrogación gay del mismo sexo
- Recuperación quirúrgica de espermatozoides
- Diagnóstico Genético Pre Implantación DGP
- Congelación de óvulos
- Selección de género utilizando óvulos de donantes
- Prevención de la enfermedad de células falciformes
- Preguntas Frecuentes
- Viajar
Terapia con células madre para la azoospermia
Tratamiento de azoospermia
¿Cómo puede el tratamiento con células madre ayudar con la infertilidad masculina?
La azoospermia es una afección en la que no hay espermatozoides vivos o maduros en el eyaculado de un hombre. En la mayoría de los casos, el eyaculado puede contener semen con otras células, por lo tanto, la existencia de un eyaculado fluido no sugiere la existencia de espermatozoides. La azoospermia se puede dividir en dos categorías principales:
Azoospermia obstructiva:Cuando se produce una obstrucción, los espermatozoides no pueden liberarse en el eyaculado, aunque la producción de espermatozoides sigue activa. La azoospermia obstructiva puede deberse a diversas causas. La causa más común en la actualidad es la vasectomía, una afección que los pacientes suelen conocer. Sin embargo, otros factores también pueden impedir que los espermatozoides entren en el eyaculado. Estos factores incluyen:
1. Anormalidades del sistema ductal
Los espermatozoides deben viajar a través del sistema de conductos para llegar a la uretra. Después de producirse en los testículos, los espermatozoides pasan por varias estructuras, entre ellas el epidídimo, el conducto deferente, el conducto eyaculador y la uretra. Cualquier alteración en el transporte de los espermatozoides a través de estas estructuras o entre ellas puede obstruir su camino. (Consulte la siguiente figura para ver una representación visual de estas estructuras).
2. Disfunción eyaculatoria
El proceso de emisión, en el que el esperma se deposita en la uretra antes de la eyaculación, puede funcionar mal. Esta disfunción puede ser consecuencia de un daño neurológico o, en algunos casos, de una diabetes no controlada.
En casos de azoospermia obstructiva, el uso de tecnicas quirurgicas de extraccion de espermatozoides A menudo ayudan a obtener una cantidad aceptable de espermatozoides viables para ser utilizados durante un ciclo de FIV.
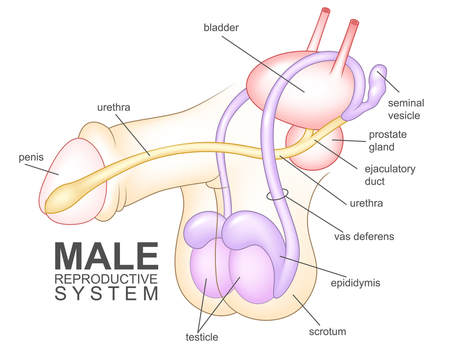
Tratamiento de la azoospermia no obstructiva:La azoospermia no obstructiva (ANO) es una afección que se caracteriza por la ausencia de espermatozoides en el eyaculado debido a una producción deficiente de espermatozoides en los testículos. A diferencia de la azoospermia obstructiva, que resulta de bloqueos en el tracto reproductivo, la ANO surge de una disfunción testicular intrínseca. Esto puede ocurrir debido a anomalías genéticas (como el síndrome de Klinefelter o microdeleciones del cromosoma Y), desequilibrios hormonales o daño a los testículos por infecciones, traumatismos, quimioterapia o radiación. En muchos casos, la causa subyacente sigue siendo idiopática. La ANO es una causa importante de infertilidad masculina y, a menudo, se presenta con un volumen testicular más pequeño y niveles elevados de hormona folículo estimulante (FSH) a medida que el cuerpo intenta compensar la espermatogénesis reducida. El diagnóstico generalmente implica un perfil hormonal, pruebas genéticas y, ocasionalmente, una biopsia testicular para confirmar la ausencia de espermatozoides maduros.
El objetivo de una biopsia testicular es inspeccionar minuciosamente el tejido testicular para detectar la presencia de espermatozoides menos maduros. Incluso cuando la espermatogénesis (el proceso de producción y maduración de los espermatozoides) no llega a su fin, es posible que existan etapas anteriores de espermatozoides presentes que posiblemente se puedan utilizar. El siguiente diagrama muestra el ciclo completo de la espermatogénesis desde las células madre hasta los espermatozoides maduros:
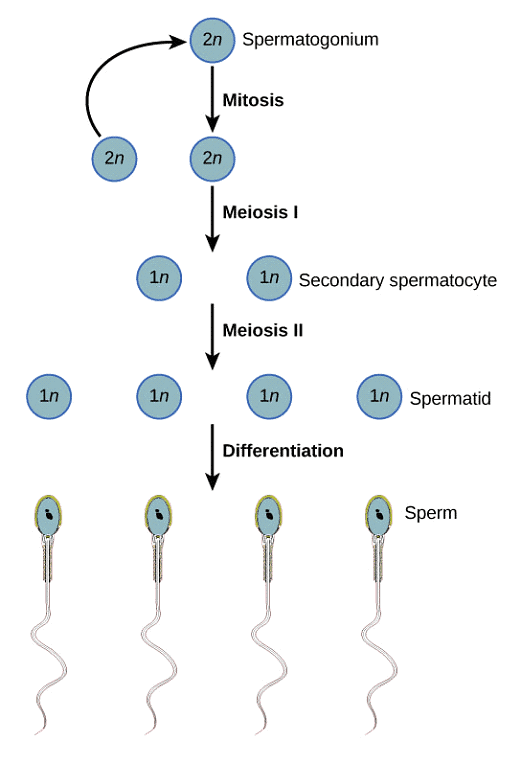
Si la biopsia del paciente revela la presencia de espermátidas en etapa avanzada (espermátidas alargadas), aunque la concepción natural no funcione, las espermátidas en etapa avanzada suelen utilizarse con éxito durante un ciclo de FIV mediante el uso de ICSI. Sin embargo, cualquier etapa de maduración de los espermatozoides anterior a la elongación de las espermátidas no dará como resultado un resultado exitoso de la FIV.
En este punto, si no hay células germinales presentes y se realiza el diagnóstico de síndrome de células de Sertoli únicamente, entonces la única opción para engendrar un hijo será mediante el uso de esperma de un donante o la adopción. Las células germinales son espermatozoides inmaduros que tienen el potencial de crecer y diferenciarse en espermatozoides maduros. Estos pueden considerarse espermatozoides inmaduros e indiferenciados. Entre ellos se incluyen:
– Espermatogonias
– Espermatocitos primarios
– Espermatocitos secundarios
– Espermátidas en etapa temprana
– Espermátidas en etapa avanzada
La presencia de células germinales en el tejido testicular es un requisito previo para la terapia con células madre. La razón es sencilla. Para el tratamiento con células madre utilizamos células madre mesenquimales del propio tejido adiposo del paciente. Las células madre mesenquimales tienen un potencial de diferenciación limitado. Sin embargo, si se dan las condiciones adecuadas, pueden diferenciarse en muchos tipos de células. Las células madre mesenquimales tienden principalmente a diferenciarse en los tipos de células circundantes, a menos que se programen específicamente para diferenciarse en un tipo de célula específico. En nuestros tratamientos, no hay programación celular involucrada. Se aíslan las células madre derivadas del propio tejido adiposo del paciente y se inyectan en el tejido testicular donde hay células germinales. Al tener células germinales en el entorno, las células madre las siguen como plantilla y también se diferencian en células germinales. Sin embargo, esto es solo una parte del proceso. Dado que las células germinales existentes en los testículos del paciente no pueden completar la espermatogénesis y convertirse en espermatozoides completamente maduros, es necesario realizar pasos adicionales para promover dicha diferenciación.
Cuando introducimos células madre en los túbulos seminíferos, también inyectamos plasma rico en plaquetas del propio paciente, que se obtiene de su muestra de sangre periférica. El plasma rico en plaquetas es rico en factores de crecimiento que permiten el crecimiento y desarrollo celular, además de mejorar el suministro de sangre al tejido. Por lo tanto, las células madre disfrutan de una rica infusión de factores de crecimiento en las inmediaciones para facilitar su desarrollo. Además, utilizamos exosomas derivados de la placenta para mejorar la comunicación celular en los testículos.
La terapia con células madre, en su conjunto, tiene como objetivo:
1- Aumentar la población de células germinales en el tejido testicular aportando células madre al tejido testicular.
2- Permitir que estas células germinales crezcan y se desarrollen con la ayuda de factores de crecimiento.
3- Mejorar la comunicación celular y facilitar la respuesta a la estimulación hormonal con la ayuda de los exosomas.
¿Qué es el plasma rico en plaquetas (PRP)?? El PRP es una concentración de plaquetas derivadas de la propia sangre del individuo, enriquecida con factores de crecimiento y proteínas bioactivas que promueven la curación y la regeneración de los tejidos. El PRP se utiliza habitualmente en tratamientos médicos y estéticos para acelerar la reparación de los tejidos dañados, reducir la inflamación y estimular la proliferación celular.
Las plaquetas desempeñan un papel clave en la cicatrización de heridas y la reparación de tejidos al liberar factores de crecimiento como:
⦁ Factor de crecimiento derivado de plaquetas (PDGF):Estimula el crecimiento celular y la formación de nuevos vasos sanguíneos.
⦁ Factor de crecimiento transformante beta (TGF-β):Promueve la reparación de tejidos y reduce la inflamación.
⦁ Factor de crecimiento endotelial vascular (VEGF):Fomenta la formación de nuevos vasos sanguíneos.
⦁ Factor de crecimiento epidérmico (EGF):Apoya la regeneración celular y la cicatrización de heridas.
Cuando se inyecta PRP en un área objetivo, estos factores de crecimiento reclutan y activan los procesos de curación naturales del cuerpo, incluida la activación de células madre y la síntesis de colágeno.
¿Qué son los exosomas?
Los exosomas son pequeñas nanovesículas que se encuentran en los espacios intersticiales y en los fluidos corporales. Debido a sus tamaños, los exosomas siempre han sido vistos como artefactos o basura celular sin función fisiológica. Sin embargo, con los avances en la investigación en el campo de la medicina, ahora se sabe que son parte de un meticuloso sistema de comunicación intracelular.
Los exosomas son conocidos por su participación en todo tipo de comunicación celular. Proporcionan señales autocrinas locales entre tipos de células similares, señales paracrinas locales entre diferentes tipos de células, así como señales endocrinas distantes. La participación en una señalización celular tan extensa les ha valido el nombre de "señalosomas". Cuando los exosomas se introducen en el cuerpo, mejoran la comunicación a través de todos los canales, lo que ayuda con la salud y el funcionamiento general de las células.
En comparación con las células madre adultas, los exosomas contienen 300% más factores de crecimiento, que son esenciales para el crecimiento, el desarrollo y la regeneración celular. Los exosomas se pueden administrar mediante infusión IV o se pueden dirigir a un sitio específico mediante inyección directa.
¿Cómo se realiza la terapia con células madre?
En North Cyprus IVF Center, las terapias con células madre que realizamos para el tratamiento de la azoospermia no obstructiva utilizan una combinación de células madre mesenquimales, plasma rico en plaquetas y exosomas. El aislamiento de las células madre requiere un procedimiento quirúrgico llamado liposucción.
El procedimiento de liposucción Para obtener células madre mesenquimales (MSC) Es una técnica quirúrgica mínimamente invasiva que se utiliza para extraer tejido adiposo, que es una fuente rica de células madre mesenquimales. El procedimiento quirúrgico implica una serie de pasos:
1. Preparación preoperatoria:
El paciente se somete a una evaluación médica para garantizar que sea apto para el procedimiento. Esto implica una serie de pruebas hormonales, una posible evaluación del escroto y una biopsia testicular para evaluar la celularidad de los túbulos seminíferos.
También se le pide al paciente que se realice una serie de análisis de sangre para verificar la función hepática y renal, así como ciertos inhibidores de tumores como la alfa-fetoproteína (AFP) y la beta gonadotropina coriónica humana (b-hCG).
2. Inyección de solución tumescente:
Se inyecta en la zona afectada una solución tumescente que contiene solución salina, lidocaína (un anestésico local) y epinefrina (para reducir el sangrado). Esta solución ayuda a aflojar las células grasas, reduce el dolor y minimiza el sangrado durante el procedimiento.
3. Extracción de grasa (liposucción):
Se hace una pequeña incisión en la piel y se coloca una aguja Se inserta una cánula (un tubo delgado y hueco) que se conecta a un dispositivo de vacío que succiona suavemente el tejido graso de zonas como el abdomen, los muslos o los glúteos.
4. Procesamiento del tejido adiposo:
La grasa extraída se recoge en recipientes estériles y se procesa para aislar las células madre mesenquimales. El procesamiento implica:
Centrifugación para separar la grasa de otros componentes como la sangre y los líquidos,
Digestión enzimática utilizando colagenasa para descomponer la matriz extracelular y liberar MSC.
Filtración y lavado para purificar las MSC y eliminar los residuos.
5. Reimplantación:
Las células madre mesenquimales se mezclan con PRP y exosomas y se inyectan directamente en las zonas diana de los testículos. Todo el procedimiento se realiza en pocas horas mientras el paciente está bajo sedación. Por lo tanto, los procedimientos de liposucción y reimplantación se llevan a cabo en una sola sesión sin necesidad de dos sedaciones separadas.
Si bien el procedimiento es generalmente seguro, los riesgos incluyen hematomas menores, infección o molestias en el lugar de la liposucción o reimplantación. Esta técnica se utiliza ampliamente en medicina regenerativa debido a la alta potencia y versatilidad de las células madre mesenquimales derivadas del tejido adiposo.
Duración de estancia requerida en Chipre:
La mayoría de nuestros pacientes viajan desde el extranjero. Debido a compromisos laborales o familiares, los tiempos de viaje pueden ser limitados. Por eso solicitamos que las pruebas preliminares/biopsia se realicen localmente antes de la llegada del paciente para que la duración de la estadía en Chipre se pueda minimizar. Se espera que permanezca en Chipre durante aproximadamente 3 días para la terapia con células madre. Esto nos dará tiempo suficiente para realizar las pruebas preoperatorias necesarias, obtener su muestra de sangre y realizar el procedimiento. Se espera que pase la noche en nuestro hospital para observación y pueda viajar de regreso a casa al día siguiente.
¿Qué esperar después del procedimiento? Tasas de éxito:
Después de la inyección de células madre, hay un período de espera de tres meses para observar el efecto. La espermatogénesis (producción y maduración de los espermatozoides) dura aproximadamente entre 65 y 70 días. Por lo tanto, las células madre que se implantan requerirán este tiempo antes de que podamos observar algún efecto.
El éxito del procedimiento depende en gran medida de la celularidad basal del tejido testicular. Los pacientes que ya tienen espermátidas en etapa temprana o tardía en su tejido testicular (JPuntuación de Ohnsen de 7 u 8) son el grupo de pacientes que tienen mayores posibilidades de éxito con la terapia con células madre. En la mayoría de los casos, podemos observar espermatozoides maduros en el eyaculado después del período de tres meses. Si bien la cantidad de espermatozoides maduros en el eyaculado no será suficiente para la concepción natural, a menudo planificamos y ejecutamos un ciclo de FIV exitoso con este grupo de pacientes. La probabilidad de obtener con éxito espermatozoides maduros en el eyaculado en este grupo de pacientes es de alrededor de 75%.
Pacientes que no tienen espermátidas en los túbulos seminíferos (quizás algunas) pero tienen espermatocitos secundarios (Puntuación de Johnsen de 5 a 6) también es probable que vean una mejora en su actividad espermatogénica que puede resultar en espermatozoides maduros que pueden entrar en el eyaculado. Sin embargo, en este grupo de pacientes, observar espermatozoides maduros en el eyaculado es menos común. Nuestra expectativa en este grupo de pacientes es poder encontrar espermátidas maduras en una biopsia testicular para ser utilizadas durante un ciclo de FIV. Si el análisis de semen realizado tres meses después de la terapia con células madre no indica ningún espermatozoide en el eyaculado, entonces el siguiente paso será organizar un procedimiento de extracción de espermatozoides testiculares para obtener espermatozoides viables que puedan usarse durante la ICSI. La probabilidad de obtener con éxito espermatozoides maduros en el eyaculado en este grupo de pacientes es de alrededor de 25%. La probabilidad de encontrar espermatozoides viables ya sea en el eyaculado o mediante TESE es de alrededor de 40%.
Pacientes que sólo tienen espermatocitos primarios en sus túbulos seminíferos (Puntuación de Johnsen de 4) no es probable que observemos espermatozoides maduros en el eyaculado después del procedimiento con células madre. En la mayoría de los casos, vemos una mejora en la actividad espermatogénica en el sentido de que el tejido se vuelve más poblado con células germinales. Sin embargo, en una gran mayoría de pacientes, no encontramos espermatozoides suficientemente maduros para ser utilizados durante la ICSI. El éxito con este grupo de pacientes se puede estimar en 15%, lo que significa que el 15% de los pacientes tendrán espermatozoides suficientemente maduros que se pueden utilizar en un ciclo de FIV.
Según nuestras estadísticas de pacientes hasta la fecha, los pacientes con solo espermatogonias en los túbulos seminíferos (Puntuación de Johnsen de 3) es probable que tengan una posibilidad de 6% de tener células espermáticas lo suficientemente maduras como para poder usarse durante la ICSI después del procedimiento con células madre.
No esperamos un resultado exitoso en el grupo de pacientes que tienen una puntuación Johnsen de 2 o menos (síndrome de células de Sertoli solamente o sin células).
¿Qué es la puntuación Johnsen?
El Sistema de puntuación de Johnsen Es un método histológico que se utiliza para evaluar muestras de biopsia testicular mediante la evaluación de la espermatogénesis (la producción de espermatozoides) en los túbulos seminíferos. Desarrollado por SG Johnsen en 1970, el sistema asigna una puntuación numérica a cada túbulo seminífero en función de la presencia y madurez de las células germinales, así como del estado general de la espermatogénesis. Se utiliza comúnmente en la evaluación de la infertilidad masculina.
Criterios de puntuación
A cada túbulo seminífero se le asigna una puntuación que va desde 1 a 10 basado en los siguientes criterios:
Puntuación 10:Espermatogénesis completa con muchos espermatozoides visibles.
Puntuación 9:Espermatogénesis ligeramente reducida pero con muchas espermátidas en etapa tardía presentes.
Puntuación 8:Pocas espermátidas tardías, lo que indica una espermatogénesis moderadamente deteriorada.
Puntuación 7:Presencia de muchas espermátidas tempranas pero no de espermátidas tardías ni de espermatozoides.
Puntuación 6:Presencia de pocas espermátidas tempranas pero no de espermátidas tardías ni de espermatozoides.
Puntuación 5:Hay muchos espermatocitos presentes, pero no hay espermátidas ni espermatozoides.
Puntuación 4:Hay pocos espermatocitos presentes, pero no hay espermátidas ni espermatozoides.
Puntuación 3:Hay espermatogonias (precursores de células germinales) presentes, pero no espermatocitos, espermátidas ni espermatozoides.
Puntuación 2:Solo células de Sertoli sin células germinales presentes.
Puntuación 1:No se encuentran túbulos seminíferos presentes en la biopsia (daño testicular extremo).
Interpretación de las puntuaciones
A puntuación más alta Indica espermatogénesis normal o casi normal.
A puntuación más baja refleja espermatogénesis deteriorada o ausente.
Calculando el Puntuación media de Johnsen En todos los túbulos examinados, podemos cuantificar el grado de deterioro espermatogénico y tomar decisiones informadas sobre las opciones de tratamiento, como avanzar con tecnologías de reproducción asistida, utilizar tratamientos con células madre o considerar opciones de donantes.
Costo de la terapia con células madre para la azoospermia no obstructiva:
El coste de la terapia con células madre para el tratamiento de la azoospermia no obstructiva es de 7.000 euros, incluyendo el protocolo PRP, la liposucción y purificación de células madre, los exosomas y la implantación en el tejido testicular. En este presupuesto también se incluye la estancia en el hospital.
Por favor, siéntete libre de Contáctenos para más información.
Nuevos avances en tecnologías de FIV
Centro de FIV del norte de Chipre
North Cyprus IVF Center es una clínica de fertilidad centrada en el paciente, ubicada dentro de "Hospital Quirúrgico y de Investigación Elite”En Nicosia, Chipre. Nuestra clínica es una de las clínicas de fertilidad más avanzadas del mundo y ofrece una selección más amplia de opciones de tratamiento a precios asequibles.
Contáctanos
Teléfono
Inglés: +90 548 875 8000
Francés: +90 548 876 8000
Turco: +90 542 869 8000
Arábica: +90 548 875 8000
Alemán: +90 548 830 1987
Ruso: +90 548 828 9955
Correo electrónico
info@northcyprusivf.net
© 2020 LowCostIVF - Todos los derechos reservados. política de privacidad


