- Nosotros
- Blog
- Esterilidad
- Tratamientos de FIV
- Nuevos avances en FIV
- Terapia de reemplazo mitocondrial!
- Tratamiento de FIV en Chipre
- IUI
- Mini FIV
- FIV + IICE
- FIV citoplasmática
- Ciclo de FIV en tándem
- donación de óvulos
- Donación de embriones
- Donación de esperma
- Género - Selección de sexo
- Subrogación gestacional
- Subrogación gay del mismo sexo
- Recuperación quirúrgica de espermatozoides
- Diagnóstico Genético Pre Implantación DGP
- Congelación de óvulos
- Selección de género utilizando óvulos de donantes
- Prevención de la enfermedad de células falciformes
- Preguntas Frecuentes
- Viajar
- Nosotros
- Blog
- Esterilidad
- Tratamientos de FIV
- Nuevos avances en FIV
- Terapia de reemplazo mitocondrial!
- Tratamiento de FIV en Chipre
- IUI
- Mini FIV
- FIV + IICE
- FIV citoplasmática
- Ciclo de FIV en tándem
- donación de óvulos
- Donación de embriones
- Donación de esperma
- Género - Selección de sexo
- Subrogación gestacional
- Subrogación gay del mismo sexo
- Recuperación quirúrgica de espermatozoides
- Diagnóstico Genético Pre Implantación DGP
- Congelación de óvulos
- Selección de género utilizando óvulos de donantes
- Prevención de la enfermedad de células falciformes
- Preguntas Frecuentes
- Viajar
Terapia de reemplazo mitocondrial
Una nueva técnica médica innovadora
Terapia de reemplazo mitocondrial (TRM) en el Centro de FIV del Norte de Chipre
En colaboración con el Dr. Shoukhrat Mitalipov: Pioneros en el futuro de la fertilidad
En el Centro de FIV de Chipre Norte, nos enorgullece colaborar con el Dr. Shoukhrat Mitalipov, uno de los principales expertos mundiales en genética reproductiva y biología mitocondrial. El Dr. Mitalipov es reconocido internacionalmente por desarrollar la Terapia de Reemplazo Mitocondrial (TRM), una técnica de vanguardia diseñada originalmente para prevenir la transmisión de enfermedades mitocondriales, que ahora ofrece nuevas esperanzas a las mujeres con infertilidad relacionada con la edad y fracasos recurrentes de la FIV.
Esta asociación nos permite ofrecer MRT como un tratamiento de fertilidad especializado fuera del entorno de un ensayo clínico, combinando la experiencia del equipo del Dr. Mitalipov con la experiencia clínica del Dr. Savas Ozyigit, el Dr. Ahmet Ozyigit y el equipo de embriología del North Cyprus IVF Center, ubicado en el Elite Hospital.
¿Qué son las mitocondrias?
Las mitocondrias son los orgánulos productores de energía que se encuentran en casi todas las células del cuerpo, incluyendo los ovocitos (óvulos). A medida que la mujer envejece, la cantidad y la función mitocondriales disminuyen, lo que afecta la capacidad del ovocito para permitir la fecundación, el desarrollo embrionario y la implantación normales. Esta disminución es una de las principales causas de la infertilidad relacionada con la edad.
TEl papel de las mitocondrias en la salud celular y reproductiva
Las mitocondrias son orgánulos de doble membrana, conocidos como las centrales energéticas de la célula, ya que generan trifosfato de adenosina (ATP), la principal fuente de energía utilizada para impulsar casi todos los procesos celulares. Sin embargo, las mitocondrias también desempeñan funciones cruciales en:
• Regulación de la apoptosis (muerte celular programada)
• Homeostasis del calcio
• Gestión de especies reactivas de oxígeno (ROS)
• Esteroidogénesis y señalización celular
• Maduración de los ovocitos, formación del huso y desarrollo embrionario temprano.
En los ovocitos humanos, cada célula contiene entre 100.000 y 600.000 mitocondrias, muchas más que las células somáticas típicas, lo que subraya su papel central en la competencia reproductiva (May-Panloup et al., 2005).
A medida que las mujeres envejecen, particularmente después de los 35 años, la función mitocondrial en los ovocitos sufre un deterioro progresivo:
1. Número reducido de copias de ADNmt
Las mitocondrias de los ovocitos dependen de suficientes copias de ADN mitocondrial (ADNmt) para mantener la producción de ATP durante la maduración y la fecundación. Estudios muestran una reducción significativa del número de copias de ADNmt con la edad, lo que compromete la disponibilidad energética necesaria para la formación normal del huso y la segregación cromosómica (Fragouli et al., 2015).
2. Aumento de las mutaciones del ADN mitocondrial
El ADNmt carece de histonas protectoras y posee mecanismos de reparación limitados, lo que lo hace muy susceptible al daño oxidativo. Con la edad, la exposición acumulada a ROS provoca un aumento de mutaciones en el ADNmt, lo que perjudica la respiración mitocondrial y agrava aún más el estrés oxidativo (Barritt et al., 2002; Wallace, 2013).
3. Producción de ATP deteriorada
Las mitocondrias envejecidas generan menos ATP a través de la fosforilación oxidativa, lo que da como resultado ovocitos deficientes en energía que tienen dificultades para completar la división meiótica o apoyar la embriogénesis temprana (Bentov y Casper, 2013).
4. Potencial de membrana alterado y fragmentación
Las mitocondrias envejecidas presentan pérdida del potencial de membrana, mayor fragmentación y morfología alterada, lo que conduce a un metabolismo celular deteriorado y susceptibilidad a la apoptosis (Wilding et al., 2001).
5. Asociación con aneuploidía y mala calidad embrionaria
La disfunción mitocondrial en ovocitos se ha correlacionado con anomalías del huso ovárico, segregación cromosómica incorrecta y menores tasas de formación de blastocistos (Santos et al., 2006). Se ha demostrado que la disfunción mitocondrial en ovocitos altera el ensamblaje del huso ovárico y la segregación cromosómica, lo que provoca errores meióticos y afecta el desarrollo embrionario. Este fenómeno fue demostrado en modelos de primates humanos y no humanos por el Dr. Shoukhrat Mitalipov y sus colegas (Tachibana et al., 2009, Nature).
¿Cómo encaja la terapia de reemplazo mitocondrial?
La salud mitocondrial no solo es un indicador de la vitalidad de los ovocitos, sino también un factor limitante para el éxito reproductivo. La terapia de reemplazo mitocondrial busca restaurar un citoplasma bioenergéticamente competente, permitiendo que el ADN nuclear del paciente funcione en un entorno celular rejuvenecido.
Al reemplazar las mitocondrias envejecidas y disfuncionales con mitocondrias de donantes saludables, la MRT aborda una causa raíz de la infertilidad relacionada con la edad a nivel celular, algo que la FIV tradicional no puede superar cuando el entorno citoplasmático del óvulo está comprometido.
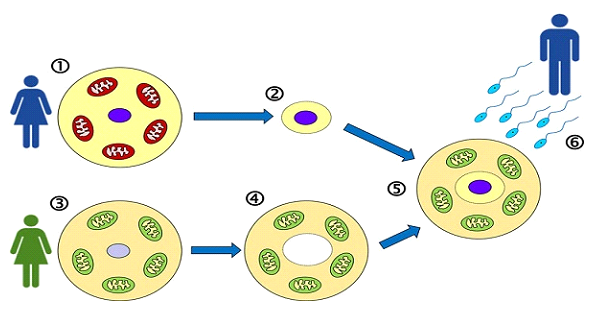
La MRT es una técnica revolucionaria que reemplaza las mitocondrias disfuncionales del óvulo de una mujer con mitocondrias sanas de un óvulo de donante, creando un entorno más viable para el desarrollo del embrión, al tiempo que se preserva el material genético nuclear de la mujer.
¿Cómo funciona el MRT?
A diferencia de la transferencia citoplasmática, donde se inyecta una pequeña cantidad de citoplasma de óvulos de donante en el óvulo de una paciente, la TRM implica la transferencia completa del ADN nuclear de la madre a un óvulo de donante enucleado que conserva sus mitocondrias sanas. Esta técnica, conocida como Transferencia del Huso Materno (TSM), permite la visualización y manipulación precisas del material genético.
Pasos del proceso MRT:
Recuperación de óvulos: La paciente se somete a estimulación ovárica y recolección de óvulos. Debido a la menor producción de óvulos en mujeres mayores de 40 años, podrían ser necesarias múltiples recuperaciones. Se requiere un mínimo de 3 ovocitos de grado M2 para la TRM. Cuantos más ovocitos tenga la paciente, mayores serán las probabilidades de éxito. Los óvulos de la paciente se congelan hasta que se encuentre una donante adecuada y estén listos para la recuperación.
Preparación de óvulos de donante: Se extrae un óvulo de donante y se extrae cuidadosamente su núcleo, dejando el citoplasma con mitocondrias intactas y sanas. Este procedimiento se realiza con ovocitos frescos. Por lo tanto, el protocolo de TRM se realiza únicamente con óvulos frescos de donante.
• Transferencia del huso ovárico: se extrae el ADN nuclear (material genético) del paciente y se transfiere al óvulo donante enucleado.
• Fecundación: El óvulo reconstruido, que ahora contiene el material genético del paciente y las mitocondrias sanas del donante, se fecunda mediante ICSI (inyección intracitoplasmática de espermatozoides). En la mayoría de los casos, no es posible obtener una muestra de esperma fresco si los pacientes viajan desde el extranjero. Por lo tanto, solicitamos que se proporcione una muestra de esperma con antelación y se mantenga congelada para preparar un ciclo de TRM.
• Desarrollo embrionario: Los embriones resultantes se cultivan hasta el estadio de blastocisto y luego se vitrifican (congelan) para su posterior transferencia. Dado que los ovocitos de la donante se utilizan frescos, técnicamente sería la primera vez que se intentaría la congelación (aunque los ovocitos de la paciente ya se congelaron previamente).
• Transferencia de embriones: En un ciclo posterior, la paciente se somete a una preparación endometrial para la transferencia de embriones.
La terapia de reemplazo mitocondrial (TRM) consiste en transferir material genético nuclear del óvulo de una mujer a un óvulo de donante con mitocondrias sanas. El objetivo es preservar el ADN nuclear de la paciente, a la vez que se proporciona un citoplasma bioenergéticamente competente. Existen dos técnicas principales para lograrlo:
1. Transferencia del huso materno (MST): el método utilizado en nuestra unidad de FIV.
La MST se realiza en la etapa de metafase II (MII) del ovocito, antes de la fecundación. El complejo del huso meiótico materno (que contiene los cromosomas) se extrae cuidadosamente del óvulo no fecundado de la paciente y se transfiere a un óvulo de donante al que se le ha extraído el huso. El óvulo reconstruido se fecunda con un espermatozoide.
Este método es ideal para el tratamiento de la infertilidad y la disfunción ovocitaria relacionada con la edad, ya que evita la manipulación posfertilización. El riesgo de arrastre mitocondrial es típicamente <1%, lo que minimiza el riesgo de recurrencia de la enfermedad mitocondrial si la indicación para la TRM es esta. De lo contrario, esto es irrelevante.
2. Transferencia Pronuclear (PNT)
La PNT se realiza en la etapa de cigoto, tras la fecundación. Los pronúcleos (masculino y femenino) se extraen de un óvulo fecundado y se transfieren a un cigoto donante enucleado. Este método se estudia principalmente para la prevención de enfermedades mitocondriales hereditarias. Sin embargo, el riesgo de arrastre mitocondrial es mayor que el de la MST (~2–5%), según la técnica.
¿Por qué la transferencia de huso es superior en aplicaciones de fertilidad?
Consideraciones éticas y legales
La MST evita la creación y destrucción de embriones, ya que se lleva a cabo antes de la fecundación. Esto la ha hecho más aceptable ética y legalmente en muchas jurisdicciones en comparación con la PNT. La PNT implica la manipulación de un cigoto fecundado, lo que plantea importantes preocupaciones bioéticas.
Menor arrastre mitocondrial
La MST demuestra sistemáticamente una menor carga de ADNmt, lo que reduce el riesgo de transmitir mutaciones mitocondriales a la descendencia. Mitalipov et al. (2009, 2016) demostraron que la MST resultó en una cantidad indetectable o insignificante de ADNmt del ovocito original, mientras que la PNT puede portar mayores cantidades de ADNmt defectuoso debido a la mezcla citoplasmática.
Reducción del riesgo de problemas de reprogramación epigenética
Dado que la MST ocurre antes de la fecundación, la remodelación epigenética se lleva a cabo en un único entorno citoplasmático, lo que podría resultar en una expresión génica más estable durante la embriogénesis. Por el contrario, la PNT combina núcleos ya fecundados con un citoplasma extraño, lo que puede provocar discordancia epigenética o un retraso en la reprogramación.
Mejores resultados en el desarrollo embrionario
En estudios con ovocitos y embriones humanos, incluidos los de Tachibana et al. (2013) y Zhang et al. (2017), los embriones MST mostraron una mayor competencia para el desarrollo y menores tasas de fragmentación que los embriones derivados de PNT. La MST también se ha aplicado con mayor facilidad a aplicaciones de fertilidad, como se observó en el primer nacimiento vivo mediante MST en Grecia (2019), en una paciente con repetidos fracasos de FIV.
¿Quién es candidato para MRT?
La MRT se considera en los siguientes escenarios clínicos:
• Mujeres con disfunción mitocondrial documentada o marcadores sugestivos de mala calidad citoplasmática de los ovocitos
• Pacientes en edad materna avanzada (normalmente >40) con repetidos fracasos de FIV debido a factores relacionados con los ovocitos
• Mujeres con reserva ovárica normal pero con bajo desarrollo embrionario o tasas de fertilización sugestivas de insuficiencia citoplasmática
• Personas que buscan un hijo biológicamente relacionado pero que previamente se les había recomendado considerar la donación de óvulos debido a la mala calidad de los ovocitos.
Antecedentes científicos y resultados clínicos:
En 2019, la TRM se utilizó con éxito para lograr el nacimiento de un niño sano en Grecia gracias a una colaboración liderada por el Dr. Mitalipov. La madre había sufrido múltiples ciclos de FIV fallidos debido a la mala calidad de los óvulos. Este caso marcó uno de los primeros nacimientos vivos mediante la Transferencia de Huso Materno para la infertilidad, en lugar de la prevención de enfermedades genéticas.
En esta cohorte se observó una tasa de éxito reportada de 25%, lo que significa que 1 de cada 4 mujeres que previamente habían fracasado en la FIV lograron el embarazo mediante la TMR. Si bien esta cifra puede parecer modesta, es significativa para las mujeres que previamente se consideraban no respondedoras a los protocolos estándar de FIV.
Debemos tener en cuenta que, si bien las mujeres que participaron en este estudio tuvieron múltiples ciclos de FIV fallidos, tenían 40 años o menos. La tasa de 25% podría no ser aplicable a mujeres de edades más avanzadas. Sin embargo, las mujeres del ensayo de Grecia se sometieron a un único procedimiento de recolección de ovocitos y, en la mayoría de los casos, su número fue muy limitado. En el Centro de FIV de Chipre Norte, generalmente buscamos obtener la mayor cantidad posible de ovocitos mediante múltiples recolecciones de óvulos, especialmente en pacientes mayores de 43 años, para mejorar las probabilidades.
El proceso de tratamiento en el Centro de FIV del Norte de Chipre
Dado que la cantidad y la calidad de los óvulos tienden a disminuir simultáneamente en mujeres de edad avanzada, la mayoría de las candidatas requerirán dos o más ciclos de punción para acumular una cantidad suficiente de ovocitos maduros para la TMR. El proceso se desarrolla de la siguiente manera:
1. Estimulación ovárica y congelación de óvulos
miCada ciclo de recuperación incluye estimulación y recolección de óvulos, seguida de la vitrificación de los mismos. Esto puede repetirse según sea necesario (normalmente de 2 a 3 veces) según la respuesta ovárica. Tenemos pacientes que obtienen de 9 a 10 ovocitos en un ciclo, y también pacientes que se someten a entre 4 y 5 recuperaciones de ovocitos antes de obtener la cantidad ideal. Algunas pacientes prefieren hasta 15 o 16 ovocitos para tener múltiples embriones que podrían permitir un futuro proyecto de hermanos.
2. Coordinación de óvulos de donante frescos
Una vez congelado un número suficiente de óvulos de la paciente, se preparan ovocitos frescos de donante para que coincidan con el procedimiento de TRM. Los óvulos frescos son esenciales, ya que la integridad mitocondrial y la actividad citoplasmática se degradan con la congelación.
3. MRT y creación de embriones
El procedimiento de TRM se realiza mediante la técnica de transferencia de huso materno, seguida de ICSI para fecundar los ovocitos reconstruidos. Los embriones se cultivan hasta el estadio de blastocisto y se congelan para su posterior transferencia. El Dr. Shoukhrat Mitalipov suele viajar a Chipre dos veces al año (en julio y diciembre), fecha en la que se prevé realizar los procedimientos. Dependiendo del volumen de pacientes, se puede añadir un tercer procedimiento de TRM al calendario.
4. Preparación endometrial y transferencia de embriones
En un ciclo aparte, se prepara hormonalmente el útero de la paciente para recibir el embrión. Una vez confirmado el grosor y la receptividad del endometrio, se realiza una transferencia de embriones congelados (TEC).
Cronograma y logística para pacientes internacionales
La mayoría de nuestros pacientes de MRT viajan desde el extranjero y nos adaptamos a una programación flexible coordinando la evaluación inicial de forma remota:
• La estimulación ovárica y el seguimiento preliminar (hormonas, ecografías) se pueden realizar localmente bajo nuestra orientación.
• Solo necesitará viajar a Chipre para cada extracción de óvulos, lo que generalmente requiere una estadía de 3 a 5 días.
• Una vez finalizada la MRT y congelados los embriones, se requiere un viaje aparte de 2 días para la transferencia final de embriones.
Costo y planificación
El coste total del tratamiento con TRM depende del número de ciclos de punción ovárica necesarios. En promedio, las pacientes se someten a dos punciones ováricas, lo que eleva el coste total a aproximadamente 14.000 €. Esto incluye:
• Dos recuperaciones de óvulos y protocolos de medicación.
• Vitrificación y almacenamiento de ovocitos
• Obtención de óvulos frescos de donante
• Procedimiento MRT (transferencia de huso y creación de embriones)
• Cultivo y congelación de blastocistos
• Transferencia final de embriones congelados con preparación endometrial
Cada procedimiento adicional de extracción de ovocitos tiene un coste de 2500 €. En algunos casos, las pacientes suelen optar por un tratamiento con PRP ovárico y exosomas entre ciclos para mejorar el recuento y la calidad de los ovocitos para una posterior extracción.
¿Es la coincidencia de haplogrupos una preocupación?
Actualmente, no realizamos la selección de donantes mitocondriales basándonos en la compatibilidad de haplogrupos maternos. Si bien el concepto de compatibilidad de haplogrupos se ha debatido en la literatura científica, la relevancia clínica del desajuste mitocondrial nuclear sigue siendo teórica y no se ha demostrado que afecte al desarrollo embrionario, la implantación ni la salud posnatal temprana en casos humanos de TMR. En modelos de primates humanos y no humanos, incluidos los realizados por el equipo del Dr. Mitalipov, el desajuste de haplogrupos no ha resultado en resultados adversos del desarrollo (Tachibana et al., 2009, Nature; Zhang et al., 2017). Si bien el seguimiento multigeneracional a largo plazo de las interacciones mitocondriales en humanos aún está en curso, la evidencia actual sugiere que los resultados del desarrollo a corto y mediano plazo no se ven comprometidos por los desajustes de haplogrupos (Mitalipov y Wolf, Nat Rev Mol Cell Biol, 2014).
Además, la prueba de haplogrupos no es una prueba de detección estándar y validada en los programas de donación de óvulos y no está disponible de forma rutinaria para su aplicación clínica. Nos centramos principalmente en la selección de donantes con excelente calidad ovocitaria, función mitocondrial sana y en el cribado clínico de enfermedades genéticas e infecciosas, que tienen un mayor impacto en los resultados del tratamiento.
Estudios, incluidos aquellos dirigidos por el Dr. Mitalipov, han demostrado que los embriones creados utilizando haplogrupos mitocondriales no coincidentes (por ejemplo, de diferentes orígenes étnicos o linajes) pueden desarrollarse normalmente y dar lugar a nacimientos saludables.
¿Por qué elegir MRT en lugar de donación de óvulos?
La TRM ofrece una oportunidad única para que las mujeres conciban con su propio material genético, incluso cuando la calidad de los óvulos haya disminuido significativamente debido a la edad. A diferencia de la donación de óvulos, que da como resultado un hijo sin parentesco genético, la TRM conserva el ADN nuclear materno, lo que significa que su hijo portará su herencia genética.
¿Qué pasa si la TRM no funciona? ¿Puedo someterme a un ciclo de FIV en tándem?
Sí, por supuesto, puedes pasar por un ciclo de FIV en tándem junto con tu tratamiento de MRT y, de hecho, esto es algo que recomendamos activamente en determinadas situaciones clínicas.
En la terapia de reemplazo mitocondrial (TRM), solo se utiliza el componente citoplasmático (mitocondrias) del óvulo de la donante, mientras que se conserva su propio material genético nuclear. Dado que el niño resultante será genéticamente suyo, no es necesaria la compatibilidad fenotípica con la donante en los ciclos de TRM. Las mitocondrias de la donante son puramente funcionales y no contribuyen a los rasgos físicos ni a las características de personalidad.
Sin embargo, en casos en los que prevemos una menor probabilidad de éxito, por ejemplo, debido a una producción de óvulos muy baja o una calidad ovocitaria gravemente reducida, se puede considerar un ciclo de FIV en tándem como plan de respaldo. Esto significa que realizamos un ciclo de FIV simultáneo con ovocitos de donante junto con su ciclo de TMR. Esto ofrece la ventaja de crear dos grupos separados de embriones:
• Un grupo derivado de su propio material genético a través de MRT
• Otro grupo derivado de óvulos de donante.
¿Cómo funciona la FIV en tándem junto con la TMR?
• Se realiza estimulación y recuperación ovárica para obtener ovocitos para MRT.
• Paralelamente, coordinamos con una donante idónea para un ciclo de donación de óvulos en fresco.
• Sus ovocitos se someten a una transferencia de huso materno (MST) y se fertilizan mediante ICSI.
• Los ovocitos del donante se fecundan con el esperma de su pareja (o del donante seleccionado) para crear un segundo conjunto de embriones.
• Todos los embriones se cultivan hasta la etapa de blastocisto, momento en el que:
• Se pueden seleccionar uno o más embriones, ya sea de MRT o de FIV de donante, para transferencia inmediata.
• Los embriones restantes de cualquiera de los grupos se pueden vitrificar (congelar) y almacenar para uso futuro.
Una de las principales ventajas del enfoque tándem es que conserva total flexibilidad. Dependiendo de la calidad del embrión y sus preferencias de tratamiento, puede:
• Elija transferir únicamente su propio embrión (derivado de MRT)
• Optar por transferir un embrión de óvulo de donante
• O bien optar por una transferencia dual de embriones, uno de cada grupo, aunque esto conlleva una mayor probabilidad de tener gemelos.
Cualquier embrión restante se puede congelar de forma segura para ciclos futuros, lo que le brinda opciones en el futuro sin la necesidad de repetir la estimulación o la compatibilidad de donantes.
La FIV en tándem proporciona:
• Tranquilidad y respaldo en caso de que los embriones MRT no se desarrollen de forma óptima
• Mayores tasas acumuladas de embarazo al incrementar el grupo de embriones viables o simplemente la tranquilidad de tener embriones disponibles para la transferencia en caso de que los propios óvulos no funcionen.
• Eficiencia temporal, ya que ambas estrategias se ejecutan en una única ventana de tratamiento.
• Eficiencia financiera, ya que no necesitaría pasar por un ciclo de FIV adicional separado utilizando ovocitos de donante, lo que supondría un costo más alto.
¿Listo para aprender más?
Si le han dicho que sus probabilidades de éxito con sus propios óvulos son demasiado bajas, o si ha experimentado repetidos fracasos de FIV, la TMR puede ofrecerle un nuevo camino hacia la paternidad. Contáctenos para programar una consulta o comenzar su evaluación.
Centro de FIV del norte de Chipre
North Cyprus IVF Center es una clínica de fertilidad centrada en el paciente, ubicada dentro de "Hospital Quirúrgico y de Investigación Elite”En Nicosia, Chipre. Nuestra clínica es una de las clínicas de fertilidad más avanzadas del mundo y ofrece una selección más amplia de opciones de tratamiento a precios asequibles.
Contáctanos
Teléfono
Inglés: +90 548 875 8000
Francés: +90 548 876 8000
Turco: +90 542 869 8000
Arábica: +90 548 875 8000
Alemán: +90 548 830 1987
Ruso: +90 548 828 9955
Correo electrónico
info@northcyprusivf.net
© 2020 LowCostIVF - Todos los derechos reservados. política de privacidad