- Über Uns
- Blog
- Unfruchtbarkeit
- IVF-Behandlungen
- Neue IVF-Fortschritte
- Mitochondriale Ersatztherapie!
- IVF-Behandlung in Zypern
- IUI
- Mini-IVF
- IVF + ICSI
- Zytoplasmatische IVF
- Tandem-IVF-Zyklus
- Eizellspende
- Embryonenspende
- Samenspende
- Geschlecht – Geschlechtsauswahl
- Schwangerschafts-Leihmutterschaft
- Gleichgeschlechtliche Leihmutterschaft für Schwule
- Chirurgische Spermienentnahme
- Genetische Diagnostik vor der Implantation, PID
- Einfrieren von Eiern
- Geschlechtsauswahl mithilfe von Spendereizellen
- Prävention von Sichelzellanämie
- FAQ
- Reisen
- Über Uns
- Blog
- Unfruchtbarkeit
- IVF-Behandlungen
- Neue IVF-Fortschritte
- Mitochondriale Ersatztherapie!
- IVF-Behandlung in Zypern
- IUI
- Mini-IVF
- IVF + ICSI
- Zytoplasmatische IVF
- Tandem-IVF-Zyklus
- Eizellspende
- Embryonenspende
- Samenspende
- Geschlecht – Geschlechtsauswahl
- Schwangerschafts-Leihmutterschaft
- Gleichgeschlechtliche Leihmutterschaft für Schwule
- Chirurgische Spermienentnahme
- Genetische Diagnostik vor der Implantation, PID
- Einfrieren von Eiern
- Geschlechtsauswahl mithilfe von Spendereizellen
- Prävention von Sichelzellanämie
- FAQ
- Reisen
Mitochondriale Ersatztherapie
Eine bahnbrechende neue medizinische Technik
Mitochondriale Ersatztherapie (MRT) im IVF-Zentrum Nordzypern
In Zusammenarbeit mit Dr. Shoukhrat Mitalipov – Pionierarbeit für die Zukunft der Fruchtbarkeit
Im Nordzypern-IVF-Zentrum sind wir stolz auf die Zusammenarbeit mit Dr. Shoukhrat Mitalipov, einem der weltweit führenden Experten für Reproduktionsgenetik und Mitochondrienbiologie. Dr. Mitalipov ist international anerkannt für die Entwicklung der Mitochondrienersatztherapie (MRT), einer hochmodernen Technik, die ursprünglich zur Verhinderung der Übertragung mitochondrialer Erkrankungen entwickelt wurde und nun Frauen mit altersbedingter Unfruchtbarkeit und wiederholtem IVF-Versagen neue Hoffnung bietet.
Diese Partnerschaft ermöglicht es uns, MRT als spezialisierte Fruchtbarkeitsbehandlung außerhalb eines klinischen Studienrahmens anzubieten und dabei die Expertise des Teams von Dr. Mitalipov mit der klinischen Erfahrung von Dr. Savas Ozyigit, Dr. Ahmet Ozyigit und dem Embryologie-Team des North Cyprus IVF Center im Elite Hospital zu kombinieren.
Was sind Mitochondrien?
Mitochondrien sind die energieproduzierenden Organellen, die in fast jeder Körperzelle vorkommen, einschließlich der Eizellen. Mit zunehmendem Alter einer Frau nimmt die Anzahl und Funktion der Mitochondrien ab, wodurch die Fähigkeit der Eizelle, eine normale Befruchtung, Embryonalentwicklung und Einnistung zu unterstützen, beeinträchtigt wird. Dieser Rückgang ist eine der Hauptursachen für altersbedingte Unfruchtbarkeit.
TDie Rolle der Mitochondrien für die zelluläre und reproduktive Gesundheit
Mitochondrien sind doppelmembranige Organellen, die als „Kraftwerke“ der Zelle gelten, da sie Adenosintriphosphat (ATP) produzieren, den primären Energieträger für nahezu alle zellulären Prozesse. Mitochondrien spielen jedoch auch eine entscheidende Rolle bei:
• Regulierung der Apoptose (programmierter Zelltod)
• Kalziumhomöostase
• Management reaktiver Sauerstoffspezies (ROS)
• Steroidogenese und Zellsignalisierung
• Eizellreifung, Spindelbildung und frühe embryonale Entwicklung
In menschlichen Eizellen enthält jede Zelle zwischen 100.000 und 600.000 Mitochondrien, viel mehr als typische somatische Zellen, was ihre zentrale Rolle bei der Fortpflanzungsfähigkeit unterstreicht (May-Panloup et al., 2005).
Mit zunehmendem Alter der Frau, insbesondere nach dem 35. Lebensjahr, verschlechtert sich die mitochondriale Funktion in den Eizellen zunehmend:
1. Reduzierte mtDNA-Kopienzahl
Die Mitochondrien der Eizelle sind auf ausreichende Kopien mitochondrialer DNA (mtDNA) angewiesen, um die ATP-Produktion während der Reifung und Befruchtung aufrechtzuerhalten. Studien zeigen eine signifikante Abnahme der mtDNA-Kopienzahl mit zunehmendem Alter, was die für die normale Spindelbildung und Chromosomensegregation notwendige Energieverfügbarkeit beeinträchtigt (Fragouli et al., 2015).
2. Erhöhte mitochondriale DNA-Mutationen
Der mtDNA fehlen schützende Histone und sie verfügt über eingeschränkte Reparaturmechanismen, was sie sehr anfällig für oxidative Schäden macht. Mit zunehmendem Alter führt die kumulative Belastung mit ROS zu vermehrten mtDNA-Mutationen, die die mitochondriale Atmung beeinträchtigen und den oxidativen Stress weiter verstärken (Barritt et al., 2002; Wallace, 2013).
3. Beeinträchtigte ATP-Produktion
Gealterte Mitochondrien erzeugen durch oxidative Phosphorylierung weniger ATP, was zu energiearmen Eizellen führt, die Schwierigkeiten haben, die meiotische Teilung abzuschließen oder die frühe Embryogenese zu unterstützen (Bentov & Casper, 2013).
4. Verändertes Membranpotential und Fragmentierung
Gealterte Mitochondrien weisen einen Verlust des Membranpotentials, eine erhöhte Fragmentierung und eine veränderte Morphologie auf, was zu einer Beeinträchtigung des Zellstoffwechsels und einer Anfälligkeit für Apoptose führt (Wilding et al., 2001).
5. Zusammenhang mit Aneuploidie und schlechter Embryoqualität
Mitochondriale Dysfunktion in Eizellen wurde mit Spindelanomalien, Chromosomenfehlverteilung und einer geringeren Blastozystenbildungsrate in Zusammenhang gebracht (Santos et al., 2006). Mitochondriale Dysfunktion in Eizellen beeinträchtigt nachweislich den Spindelaufbau und die Chromosomentrennung, was zu meiotischen Fehlern und einer beeinträchtigten Embryonalentwicklung führt. Dieses Phänomen wurde von Dr. Shoukhrat Mitalipov und Kollegen sowohl an menschlichen als auch an nicht-menschlichen Primatenmodellen nachgewiesen (Tachibana et al., 2009, Nature).
Wie passt die Mitochondrienersatztherapie dazu?
Die Gesundheit der Mitochondrien ist nicht nur ein Indikator für die Vitalität der Eizelle, sondern auch ein limitierender Faktor für den Fortpflanzungserfolg. Die Mitochondrienersatztherapie zielt darauf ab, ein bioenergetisch kompetentes Zytoplasma wiederherzustellen, damit die Kern-DNA des Patienten in einer verjüngten Zellumgebung funktionieren kann.
Durch den Ersatz gealterter, dysfunktionaler Mitochondrien durch gesunde Spendermitochondrien bekämpft die MRT eine Grundursache der altersbedingten Unfruchtbarkeit auf Zellebene. Diese kann durch herkömmliche IVF nicht behoben werden, wenn die zytoplasmatische Umgebung der Eizelle beeinträchtigt ist.
MRT ist eine revolutionäre Technik, bei der die dysfunktionalen Mitochondrien in der Eizelle einer Frau durch gesunde Mitochondrien aus einer Spendereizelle ersetzt werden. Dadurch wird eine lebensfähigere Umgebung für die Embryonalentwicklung geschaffen, während das Kerngenetikmaterial der Frau erhalten bleibt.
Wie funktioniert MRT?
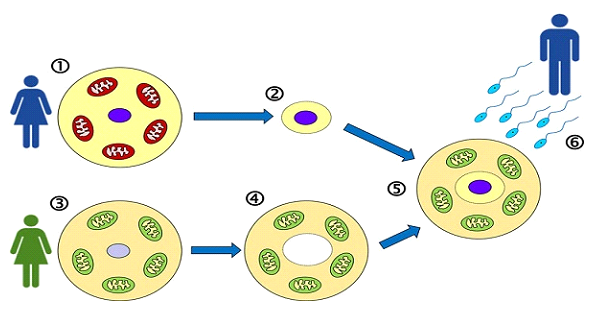
Im Gegensatz zum zytoplasmatischen Transfer, bei dem eine kleine Menge Zytoplasma einer Spendereizelle in die Eizelle einer Patientin injiziert wird, umfasst die MRT die vollständige Übertragung der Kern-DNA der Mutter in eine entkernte Spendereizelle, die ihre eigenen gesunden Mitochondrien behält. Diese Technik ist als Maternal Spindle Transfer (MST) bekannt und ermöglicht eine präzise Visualisierung und Manipulation des genetischen Materials.
Schritte des MRT-Prozesses:
Eizellentnahme: Die Patientin wird einer ovariellen Stimulation unterzogen und anschließend Eizellen entnommen. Aufgrund der geringeren Eizellausbeute bei Frauen über 40 können mehrere Entnahmezyklen erforderlich sein. Für die MRT-Behandlung werden mindestens drei Eizellen der Klasse M2 benötigt. Je mehr Eizellen eine Patientin hat, desto höher sind die Erfolgschancen. Die Eizellen der Patientin werden eingefroren, bis eine geeignete Spenderin gefunden ist und ihre Eizellen zur Entnahme bereit sind.
• Vorbereitung der Spendereizelle: Eine Spendereizelle wird entnommen und ihr Zellkern vorsichtig entfernt. Zurück bleibt das Zytoplasma mit intakten, gesunden Mitochondrien. Dieser Eingriff wird an frischen Eizellen durchgeführt. Daher wird das MRT-Protokoll ausschließlich mit frischen Eizellen von Spenderinnen durchgeführt.
• Spindeltransfer: Die Kern-DNA (genetisches Material) der Patientin wird extrahiert und in die entkernte Spendereizelle übertragen.
Befruchtung: Die rekonstruierte Eizelle, die nun das genetische Material der Patientin und die gesunden Mitochondrien der Spenderin enthält, wird mittels ICSI (intrazytoplasmatische Spermieninjektion) befruchtet. Bei Patienten aus dem Ausland ist die Abgabe einer frischen Spermienprobe in den meisten Fällen nicht möglich. Daher bitten wir um die Abgabe einer Spermienprobe im Vorfeld und die Einfrierung zur Vorbereitung eines MRT-Zyklus.
Embryonalentwicklung: Die entstehenden Embryonen werden bis zum Blastozystenstadium kultiviert und anschließend für einen späteren Transfer vitrifiziert (eingefroren). Da die gespendeten Eizellen frisch verwendet werden, wäre dies technisch gesehen der erste Versuch, sie einzufrieren (obwohl die Eizellen der Patientin bereits zuvor eingefroren wurden).
• Embryotransfer: In einem nachfolgenden Zyklus wird die Gebärmutterschleimhaut der Patientin auf den Embryotransfer vorbereitet.
Bei der Mitochondrienersatztherapie (MRT) wird Kerngenetik aus der Eizelle einer Frau in eine Spendereizelle mit gesunden Mitochondrien übertragen. Ziel ist es, die Kern-DNA der Patientin zu erhalten und gleichzeitig ein bioenergetisch kompetentes Zytoplasma bereitzustellen. Hierzu werden zwei Haupttechniken eingesetzt:
1. Maternal Spindle Transfer (MST) – Die in unserer IVF-Einheit verwendete Methode.
Die MST wird im Stadium der Metaphase II (MII) der Eizelle vor der Befruchtung durchgeführt. Der mütterliche meiotische Spindelkomplex (mit Chromosomen) wird vorsichtig aus der unbefruchteten Eizelle der Patientin entfernt und in eine Spendereizelle übertragen, deren Spindel entfernt wurde. Die rekonstruierte Eizelle wird anschließend mit Spermien befruchtet.
Diese Methode eignet sich ideal zur Behandlung von Unfruchtbarkeit und altersbedingter Eizellfunktionsstörung, da sie eine Manipulation nach der Befruchtung vermeidet. Das Risiko einer mitochondrialen Verschleppung liegt typischerweise unter 1%, wodurch das Risiko eines Wiederauftretens mitochondrialer Erkrankungen minimiert wird, wenn die Indikation für die MRT eine mitochondriale Erkrankung ist. Andernfalls ist dies eher irrelevant.
2. Pronukleärer Transfer (PNT)
Die PNT wird im Zygotenstadium nach der Befruchtung durchgeführt. Die Vorkerne (männlich und weiblich) werden aus einer befruchteten Eizelle entnommen und in eine enukleierte Spenderzygote übertragen. Diese Methode wird hauptsächlich zur Vorbeugung erblicher mitochondrialer Erkrankungen untersucht. Das Risiko einer mitochondrialen Verschleppung ist jedoch je nach Technik höher als bei der MST (~2–5%).
Warum ist der Spindeltransfer bei Fruchtbarkeitsanwendungen überlegen?
Ethische und rechtliche Überlegungen
Bei der MST werden weder Embryonen erzeugt noch zerstört, da sie vor der Befruchtung stattfindet. Dies hat sie in vielen Ländern im Vergleich zur PNT ethisch und rechtlich akzeptabler gemacht. Bei der PNT wird eine befruchtete Zygote manipuliert, was größere bioethische Bedenken aufwirft.
Niedrigerer mitochondrialer Carryover
MST weist durchweg eine geringere mtDNA-Übertragung auf, wodurch das Risiko der Übertragung mitochondrialer Mutationen auf die Nachkommen reduziert wird. Mitalipov et al. (2009, 2016) zeigten, dass MST zu nicht nachweisbarer oder vernachlässigbarer mtDNA aus der ursprünglichen Eizelle führte, während PNT aufgrund zytoplasmatischer Vermischung höhere Mengen defekter mtDNA aufweisen kann.
Reduziertes Risiko von Problemen bei der epigenetischen Neuprogrammierung
Da die MST vor der Befruchtung stattfindet, findet die epigenetische Umgestaltung innerhalb einer einzigen zytoplasmatischen Umgebung statt, was möglicherweise zu einer stabileren Genexpression während der Embryogenese führt. Im Gegensatz dazu kombiniert die PNT bereits befruchtete Kerne mit einem fremden Zytoplasma, was zu epigenetischer Diskordanz oder verzögerter Umprogrammierung führen kann.
Bessere Ergebnisse bei der Embryonalentwicklung
In Studien an menschlichen Eizellen und Embryonen, darunter denen von Tachibana et al. (2013) und Zhang et al. (2017), zeigten MST-Embryonen eine höhere Entwicklungskompetenz und geringere Fragmentierungsraten als PNT-Embryonen. MST konnte zudem leichter in der Fruchtbarkeitsforschung eingesetzt werden, wie die erste Lebendgeburt mittels MST in Griechenland (2019) bei einer Patientin mit wiederholten IVF-Versagen zeigte.
Wer ist ein Kandidat für MRT?
Die MRT kommt in folgenden klinischen Szenarien zum Einsatz:
• Frauen mit dokumentierter mitochondrialer Dysfunktion oder Markern, die auf eine schlechte Zytoplasmaqualität der Eizellen hindeuten
• Patientinnen im fortgeschrittenen mütterlichen Alter (typischerweise >40) mit wiederholten IVF-Misserfolgen aufgrund eizellenbezogener Faktoren
• Frauen mit normaler ovarieller Reserve, aber schlechter Embryoentwicklung oder Befruchtungsraten, die auf eine zytoplasmatische Insuffizienz hindeuten
• Personen, die ein biologisch verwandtes Kind wünschen, denen aber aufgrund der schlechten Eizellenqualität zuvor eine Eizellspende empfohlen wurde
Wissenschaftlicher Hintergrund und klinische Ergebnisse:
Im Jahr 2019 gelang es in Griechenland, mithilfe von MRT in Zusammenarbeit mit Dr. Mitalipov ein gesundes Kind zur Welt zu bringen. Die Mutter hatte aufgrund schlechter Eizellenqualität mehrere fehlgeschlagene IVF-Zyklen hinter sich. Dieser Fall war eine der ersten Lebendgeburten, bei denen der maternale Spindeltransfer zur Behandlung von Unfruchtbarkeit und nicht zur Vorbeugung genetischer Erkrankungen eingesetzt wurde.
In dieser Kohorte wurde eine Erfolgsrate von 25% beobachtet. Das bedeutet, dass jede vierte Frau, deren IVF-Behandlung zuvor fehlgeschlagen war, mithilfe der MRT schwanger wurde. Diese Zahl mag zwar bescheiden erscheinen, ist aber für Frauen, die zuvor als Nicht-Responder auf Standard-IVF-Protokolle galten, von Bedeutung.
Wir sollten bedenken, dass die an dieser Studie teilnehmenden Frauen zwar mehrere fehlgeschlagene IVF-Zyklen hinter sich hatten, jedoch 40 Jahre oder jünger waren. Die 25%-Rate trifft möglicherweise nicht auf Frauen in höheren Altersgruppen zu. Die Frauen in der griechischen Studie unterzogen sich jedoch einer einzigen Eizellentnahme, und in den meisten Fällen verfügten sie über eine sehr begrenzte Anzahl an Eizellen. Im Nordzypern-IVF-Zentrum streben wir in der Regel an, durch mehrere Eizellentnahmen möglichst viele Eizellen zu gewinnen, insbesondere bei Patientinnen über 43 Jahren, um die Chancen zu verbessern.
Der Behandlungsablauf im IVF-Zentrum Nordzypern
Da die Eizellmenge und -qualität bei Frauen im fortgeschrittenen Alter tendenziell gleichzeitig abnimmt, benötigen die meisten Kandidatinnen zwei oder mehr Eizellentnahmezyklen, um eine ausreichende Anzahl reifer Eizellen für die MRT zu erhalten. So läuft der Prozess ab:
1. Eierstockstimulation und Einfrieren von Eizellen
EJeder Entnahmezyklus umfasst die Stimulation und Eizellentnahme, gefolgt von der Vitrifikation der Eizellen. Dieser Vorgang kann je nach Reaktion der Eierstöcke nach Bedarf (typischerweise 2–3 Mal) wiederholt werden. Wir haben Patientinnen, die in einem Zyklus 9–10 Eizellen gewinnen, und auch Patientinnen, die 4–5 Eizellentnahmen benötigen, bevor die ideale Anzahl an Eizellen erreicht ist. Manche Patientinnen wünschen sich bis zu 15–16 Eizellen, um mehrere Embryonen zu erhalten, die möglicherweise ein zukünftiges Geschwisterprojekt ermöglichen.
2. Koordination frischer gespendeter Eizellen
Sobald eine ausreichende Anzahl von Eizellen der Patientin eingefroren wurde, werden zeitgleich mit der MRT-Untersuchung frische Spendereizellen bereitgestellt. Frische Eizellen sind unerlässlich, da die mitochondriale Integrität und die zytoplasmatische Aktivität durch das Einfrieren beeinträchtigt werden.
3. MRT & Embryonenerzeugung
Das MRT-Verfahren wird mit der maternalen Spindeltransfer-Technik durchgeführt, gefolgt von einer ICSI zur Befruchtung der rekonstruierten Eizellen. Die Embryonen werden bis zum Blastozystenstadium kultiviert und für einen späteren Transfer eingefroren. Dr. Shoukhrat Mitalipov reist in der Regel zweimal jährlich nach Zypern (einmal im Juli und einmal im Dezember). Zu diesen Zeitpunkten werden die Verfahren voraussichtlich durchgeführt. Je nach Patientenaufkommen kann ein drittes MRT-Verfahren in den Zeitplan aufgenommen werden.
4. Endometriumvorbereitung und Embryotransfer
In einem separaten Zyklus wird die Gebärmutter der Patientin hormonell auf die Aufnahme des Embryos vorbereitet. Sobald die Dicke und Aufnahmefähigkeit des Endometriums bestätigt sind, wird ein Kryo-Embryotransfer (FET) durchgeführt.
Zeitplan und Logistik für internationale Patienten
Die meisten unserer MRT-Patienten reisen aus dem Ausland an und wir ermöglichen eine flexible Terminplanung, indem wir die Erstuntersuchung aus der Ferne koordinieren:
• Die ovarielle Stimulation und die vorläufige Überwachung (Hormone, Scans) können vor Ort unter unserer Anleitung durchgeführt werden.
• Sie müssen nur für jede Eizellentnahme nach Zypern reisen, was normalerweise einen Aufenthalt von 3–5 Tagen erfordert.
• Nachdem die MRT abgeschlossen und die Embryonen eingefroren sind, ist für den endgültigen Embryotransfer eine separate 2-tägige Reise erforderlich.
Kosten und Planung
Die Gesamtkosten einer MRT-Behandlung hängen von der Anzahl der benötigten Eizellentnahmezyklen ab. Durchschnittlich werden zwei Eizellentnahmen durchgeführt, was die Gesamtkosten auf etwa 14.000 € beläuft. Diese Kosten beinhalten:
• Zwei Eizellentnahmen und Medikamentenprotokolle
• Vitrifizierung und Lagerung von Eizellen
• Beschaffung frischer Spendereizellen
• MRT-Verfahren (Spindeltransfer und Embryonenbildung)
• Blastozystenkultur und Einfrieren
• Abschließender Transfer gefrorener Embryonen mit Endometriumvorbereitung
Jede weitere Eizellentnahme kostet 2.500 €. In manchen Fällen entscheiden sich Patientinnen zwischen den Zyklen für eine ovarielle PRP- und Exosomenbehandlung, um die Anzahl und Qualität der Eizellen für eine spätere Eizellentnahme zu verbessern.
Ist die Übereinstimmung der Haplogruppen ein Problem?
Derzeit führen wir keine mitochondriale Spenderauswahl basierend auf mütterlicher Haplogruppenübereinstimmung durch. Obwohl das Konzept der Haplogruppenkompatibilität in der wissenschaftlichen Literatur diskutiert wurde, bleibt die klinische Relevanz von mitonukleären Mismatches theoretisch und hat sich in MRT-Fällen beim Menschen nicht auf die Embryonalentwicklung, die Implantation oder die frühe postnatale Gesundheit ausgewirkt. Sowohl in menschlichen als auch in nicht-menschlichen Primatenmodellen, einschließlich der von Dr. Mitalipovs Team durchgeführten, führte Haplogruppen-Mismatching nicht zu nachteiligen Entwicklungsergebnissen (Tachibana et al., 2009, Nature; Zhang et al., 2017). Während die langfristige, generationsübergreifende Verfolgung mitonukleärer Interaktionen beim Menschen noch andauert, deuten aktuelle Erkenntnisse darauf hin, dass kurz- bis mittelfristige Entwicklungsergebnisse durch Haplogruppen-Mismatches nicht beeinträchtigt werden (Mitalipov & Wolf, Nat Rev Mol Cell Biol, 2014).
Darüber hinaus ist der Haplogruppentest kein standardisierter, validierter Screeningtest in Eizellspendeprogrammen und steht für die klinische Anwendung nicht routinemäßig zur Verfügung. Unser Hauptaugenmerk liegt auf der Auswahl von Spenderinnen mit hervorragender Eizellqualität, gesunder Mitochondrienfunktion und klinischem Screening auf genetische und infektiöse Erkrankungen, die den Behandlungserfolg maßgeblich beeinflussen.
Studien, darunter auch die von Dr. Mitalipov geleiteten, haben gezeigt, dass Embryonen, die unter Verwendung nicht übereinstimmender mitochondrialer Haplogruppen (z. B. aus unterschiedlichen ethnischen Hintergründen oder Abstammungslinien) erzeugt wurden, sich normal entwickeln und zu gesunden Geburten führen können.
Warum MRT statt Eizellspende wählen?
Die MRT bietet Frauen die einzigartige Möglichkeit, mit ihrem eigenen genetischen Material schwanger zu werden, selbst wenn die Qualität der Eizellen altersbedingt deutlich nachgelassen hat. Im Gegensatz zur Eizellspende, die ein genetisch nicht verwandtes Kind zur Welt bringt, bleibt bei der MRT die mütterliche Kern-DNA erhalten, sodass Ihr Kind Ihr genetisches Erbe trägt.
Was ist, wenn die MRT nicht funktioniert? Kann ich einen Tandem-IVF-Zyklus durchführen?
Ja, auf jeden Fall. Sie können parallel zu Ihrer MRT-Behandlung einen Tandem-IVF-Zyklus durchführen. Tatsächlich empfehlen wir dies in bestimmten klinischen Situationen ausdrücklich.
Bei der mitochondrialen Ersatztherapie (MRT) wird ausschließlich der zytoplasmatische Bestandteil (Mitochondrien) der gespendeten Eizelle verwendet, während Ihr eigenes Kerngenetikmaterial erhalten bleibt. Da das entstehende Kind genetisch von Ihnen abstammt, ist eine phänotypische Übereinstimmung mit der Spenderin in MRT-Zyklen nicht erforderlich. Die Mitochondrien der Spenderin sind rein funktional und tragen nicht zu körperlichen Merkmalen oder Persönlichkeitseigenschaften bei.
In Fällen, in denen wir jedoch eine geringere Erfolgswahrscheinlichkeit erwarten, beispielsweise aufgrund einer sehr geringen Eizellausbeute oder einer stark verminderten Eizellqualität, kann ein Tandem-IVF-Zyklus als Backup-Plan in Betracht gezogen werden. Das bedeutet, dass wir parallel zu Ihrem MRT-Zyklus einen simultanen IVF-Zyklus mit gespendeten Eizellen durchführen. Dies bietet den Vorteil, dass zwei separate Embryonengruppen entstehen:
• Eine Gruppe, die aus Ihrem eigenen genetischen Material mittels MRT abgeleitet wurde
• Eine weitere Gruppe stammte aus gespendeten Eizellen.
Wie funktioniert Tandem-IVF neben MRT?
• Bei Ihnen wird eine ovarielle Stimulation und Entnahme durchgeführt, um Eizellen für die MRT zu gewinnen.
• Parallel dazu koordinieren wir mit einer geeigneten Spenderin einen neuen Eizellspendezyklus.
• Ihre Eizellen werden einem maternalen Spindeltransfer (MST) unterzogen und mittels ICSI befruchtet.
• Die gespendeten Eizellen werden mit dem Sperma Ihres Partners (oder eines ausgewählten Spenders) befruchtet, um einen zweiten Satz Embryonen zu erzeugen.
• Alle Embryonen werden bis zum Blastozystenstadium kultiviert. Zu diesem Zeitpunkt:
• Ein oder mehrere Embryonen, entweder aus MRT oder Spender-IVF, können für die sofortige Übertragung ausgewählt werden.
• Verbleibende Embryonen aus beiden Gruppen können vitrifiziert (eingefroren) und für die spätere Verwendung aufbewahrt werden.
Ein großer Vorteil des Tandem-Verfahrens ist die volle Flexibilität. Je nach Embryoqualität und Ihren Behandlungspräferenzen können Sie:
• Wählen Sie die Übertragung nur Ihres eigenen (MRT-abgeleiteten) Embryos
• Entscheiden Sie sich für die Übertragung eines Embryos aus einer gespendeten Eizelle
• Oder entscheiden Sie sich für einen doppelten Embryotransfer, einen aus jeder Gruppe, obwohl dies mit einer höheren Wahrscheinlichkeit von Zwillingen verbunden ist.
Alle verbleibenden Embryonen können sicher für zukünftige Zyklen eingefroren werden, sodass Sie für die Zukunft Optionen haben, ohne die Stimulation oder Spendersuche wiederholen zu müssen.
Tandem-IVF bietet:
• Beruhigung und Unterstützung für den Fall, dass sich MRT-Embryonen nicht optimal entwickeln
• Höhere kumulative Schwangerschaftsraten durch Vergrößerung des Pools lebensfähiger Embryonen oder einfach die Gewissheit, Embryonen für die Übertragung zur Verfügung zu haben, falls die Übertragung mit eigenen Eizellen nicht funktioniert.
• Zeiteffizienz, da beide Strategien in einem einzigen Behandlungsfenster ausgeführt werden
• Finanzielle Effizienz, da kein zusätzlicher separater IVF-Zyklus mit gespendeten Eizellen erforderlich ist, der höhere Kosten verursachen würde.
Bereit, mehr zu erfahren?
Wenn Ihnen gesagt wurde, dass Ihre Erfolgschancen mit Ihren eigenen Eizellen zu gering sind oder Sie wiederholte IVF-Versuche erlebt haben, kann die MRT Ihnen einen neuen Weg zur Elternschaft eröffnen. Kontaktieren Sie uns, um einen Beratungstermin zu vereinbaren oder Ihre Untersuchung einzuleiten.
IVF-Zentrum Nordzypern
Das IVF-Zentrum Nordzypern ist eine patientenorientierte Fruchtbarkeitsklinik mit Sitz in „Elite-Forschungs- und Chirurgiekrankenhaus“ in Nikosia, Zypern. Unsere Klinik ist eine der fortschrittlichsten Fruchtbarkeitskliniken der Welt und bietet eine größere Auswahl an Behandlungsmöglichkeiten zu erschwinglichen Preisen.
Kontakt
Telefon
Englisch: +90 548 875 8000
Französisch: +90 548 876 8000
Türkisch: +90 542 869 8000
Arabisch: +90 548 875 8000
Deutsch: +90 548 830 1987
Russisch: +90 548 828 9955
info@northcyprusivf.net
© 2020 LowCostIVF – Alle Rechte vorbehalten. Datenschutz-Bestimmungen