- Nosotros
- Blog
- Esterilidad
- Tratamientos de FIV
- Nuevos avances en FIV
- Terapia de reemplazo mitocondrial!
- Tratamiento de FIV en Chipre
- IUI
- Mini FIV
- FIV + IICE
- FIV citoplasmática
- Ciclo de FIV en tándem
- donación de óvulos
- Donación de embriones
- Donación de esperma
- Género - Selección de sexo
- Subrogación gestacional
- Subrogación gay del mismo sexo
- Recuperación quirúrgica de espermatozoides
- Diagnóstico Genético Pre Implantación DGP
- Congelación de óvulos
- Selección de género utilizando óvulos de donantes
- Prevención de la enfermedad de células falciformes
- Preguntas Frecuentes
- Viajar
- Nosotros
- Blog
- Esterilidad
- Tratamientos de FIV
- Nuevos avances en FIV
- Terapia de reemplazo mitocondrial!
- Tratamiento de FIV en Chipre
- IUI
- Mini FIV
- FIV + IICE
- FIV citoplasmática
- Ciclo de FIV en tándem
- donación de óvulos
- Donación de embriones
- Donación de esperma
- Género - Selección de sexo
- Subrogación gestacional
- Subrogación gay del mismo sexo
- Recuperación quirúrgica de espermatozoides
- Diagnóstico Genético Pre Implantación DGP
- Congelación de óvulos
- Selección de género utilizando óvulos de donantes
- Prevención de la enfermedad de células falciformes
- Preguntas Frecuentes
- Viajar
Infertilidad Femenina
Diagnóstico y Manejo
El diagnóstico de la infertilidad femenina suele ser más complejo que el de la masculina. Si bien la infertilidad masculina a veces se puede evaluar con un único análisis de semen, la evaluación de la infertilidad femenina suele requerir una serie de pruebas y exámenes exhaustivos, que pueden o no arrojar un diagnóstico definitivo.
Las mujeres no sólo aportan el óvulo, sino también el entorno necesario para que un embrión se desarrolle hasta convertirse en un ser humano viable. Aunque la infertilidad femenina suele estar relacionada con problemas de salud del óvulo, diversas afecciones ováricas y uterinas también pueden afectar a la capacidad de una mujer para concebir de forma natural. Existen pautas establecidas para diagnosticar la infertilidad femenina primaria; sin embargo, cualquier evaluación de infertilidad debe comenzar con una historia clínica completa. Las siguientes preguntas pueden ayudar a orientar el diagnóstico y el tratamiento de la infertilidad femenina primaria:
⦁ ¿Alguna vez has estado embarazada?
⦁ ¿Alguna vez has tenido un aborto espontáneo? Si es así, ¿en qué momento del embarazo ocurrió el aborto espontáneo?
⦁ ¿Tiene antecedentes familiares de infertilidad?
⦁ ¿Tiene ciclos menstruales regulares?
⦁ ¿Ha sido examinado recientemente para detectar enfermedades infecciosas, incluidas las enfermedades de transmisión sexual?
⦁ ¿Tienes mascotas?
Las respuestas a cada una de estas preguntas pueden brindar información importante al especialista en fertilidad. Por ejemplo, tener mascotas puede aumentar la probabilidad de que una mujer contraiga infecciones que pueden causar infertilidad, como la toxoplasmosis. De manera similar, un historial familiar de infertilidad podría indicar causas genéticas de infertilidad. Durante cualquier evaluación de infertilidad, los pacientes no deben conformarse con nada menos que un historial médico completo. Una copia de nuestro formulario de historial médico se encuentra en nuestra página de “Contacto”. Si bien el cuestionario es solo el comienzo de una evaluación de infertilidad, estas preguntas pueden ayudar a identificar posibles causas de infertilidad, pero el siguiente paso es evaluar la fisiología reproductiva tanto del paciente masculino como de la femenino. En particular, las pruebas hormonales pueden brindar información sobre la función ovárica de una mujer y ayudar a guiar el tratamiento.
¿Cuáles son las causas comunes de infertilidad femenina?
1- Problemas de ovulación
La ovulación es una parte fundamental del ciclo reproductivo femenino y es esencial para la concepción. Durante la ovulación, un óvulo maduro se libera de uno de los ovarios y queda disponible para la fertilización por parte del espermatozoide. En la mayoría de las mujeres, este proceso ocurre una vez por ciclo, normalmente unas dos semanas antes del inicio del período menstrual. El óvulo viaja a través de la trompa de Falopio, donde puede ser fertilizado, y luego se desplaza al útero para su implantación.
Cuando la ovulación no se produce de forma regular o no se produce en absoluto, se habla de disfunción ovulatoria. La disfunción ovulatoria es una de las principales causas de infertilidad femenina y representa entre el 25 y el 30% de los casos de infertilidad. Las mujeres que experimentan problemas de ovulación pueden tener ciclos menstruales irregulares, falta de menstruación o incluso una ausencia total de menstruación (amenorrea). Sin embargo, algunas mujeres con disfunción ovulatoria pueden tener ciclos menstruales regulares, lo que dificulta la identificación del problema subyacente sin realizar más pruebas.
Tipos de trastornos de la ovulación
Los problemas de ovulación pueden manifestarse de diversas formas, cada una con diferentes causas subyacentes. Los trastornos ovulatorios más comunes incluyen:
1. anovulación: Es la ausencia total de ovulación, en la que los ovarios no liberan un óvulo durante el ciclo menstrual. La anovulación suele estar asociada a desequilibrios hormonales, síndrome de ovario poliquístico (SOP) o insuficiencia ovárica primaria (IOP).
2. Oligo-ovulación:En este caso, la ovulación se produce de forma irregular o poco frecuente. Las mujeres con oligoovulación pueden tener ciclos impredecibles o largos intervalos entre períodos, lo que puede dificultar la sincronización de las relaciones sexuales para la concepción. La oligoovulación también suele estar relacionada con afecciones como el síndrome de ovario poliquístico u otros problemas hormonales.
3. Defecto de la fase lútea (LPD):Esta afección se produce cuando la fase lútea (el período posterior a la ovulación) no produce niveles adecuados de progesterona para sustentar un óvulo fertilizado. Los niveles bajos de progesterona pueden impedir que el revestimiento uterino se espese lo suficiente, lo que dificulta la implantación y el desarrollo del embrión, lo que puede provocar una pérdida prematura del embarazo.
Causas de los problemas de ovulación
Los problemas de ovulación se deben principalmente a desequilibrios hormonales y alteraciones de las señales entre el cerebro y los órganos reproductivos. Las causas más comunes de los trastornos de la ovulación incluyen:
1. Síndrome de ovario poliquístico (SOP):El síndrome de ovario poliquístico es una de las causas más frecuentes de disfunción ovulatoria y afecta a entre el 5 y el 101 % de las mujeres en edad reproductiva. Las mujeres con síndrome de ovario poliquístico suelen tener niveles elevados de andrógenos (hormonas masculinas), que interfieren en la ovulación. El síndrome de ovario poliquístico puede provocar anovulación, períodos irregulares y otros problemas metabólicos, como resistencia a la insulina.
2. Disfunción hipotalámica:El hipotálamo, ubicado en el cerebro, regula muchas funciones corporales, incluida la liberación de la hormona liberadora de gonadotropina (GnRH), que envía señales a la glándula pituitaria para que produzca las hormonas necesarias para la ovulación: la hormona folículo estimulante (FSH) y la hormona luteinizante (LH). El estrés, la pérdida de peso extrema, el ejercicio excesivo o los trastornos alimentarios pueden alterar la función del hipotálamo y provocar una ovulación irregular o ausente.
3. Insuficiencia ovárica primaria (IPO):También conocida como insuficiencia ovárica prematura, la insuficiencia ovárica prematura ocurre cuando los ovarios pierden su función normal antes de los 40 años. Esta afección a veces se debe a factores genéticos, trastornos autoinmunes o ciertos tratamientos médicos (por ejemplo, quimioterapia). La insuficiencia ovárica prematura puede provocar una reducción de la producción de estrógeno, ciclos irregulares y, finalmente, el cese de la ovulación.
4. Hiperprolactinemia:Los niveles elevados de prolactina, una hormona responsable de la producción de leche, pueden inhibir la ovulación al alterar el equilibrio de las hormonas reproductivas. Esta afección puede ser causada por medicamentos, tumores hipofisarios o problemas de tiroides.
5. Trastornos de la tiroides:Tanto el hipertiroidismo (tiroides hiperactiva) como el hipotiroidismo (tiroides hipoactiva) pueden interferir con los ciclos menstruales y ovulatorios normales. Las hormonas tiroideas desempeñan un papel fundamental en la regulación del sistema reproductivo del cuerpo y cualquier desequilibrio puede provocar problemas de ovulación.
Síntomas de problemas de ovulación
Los síntomas de los problemas de ovulación pueden variar ampliamente según el trastorno específico. Los síntomas comunes que pueden indicar disfunción ovulatoria incluyen:
• Ciclos menstruales irregulares (demasiado largos, demasiado cortos o impredecibles)
• Ausencia de menstruación (amenorrea)
• Sangrado menstrual abundante o muy leve
• Ausencia de síntomas premenstruales (sensibilidad en los senos, hinchazón)
• Dificultad para predecir la ovulación (patrones irregulares de temperatura corporal basal)
• Acné, exceso de vello facial o corporal y aumento de peso (especialmente en mujeres con SOP)
Estos síntomas no confirman un problema de ovulación, pero pueden ser indicadores que justifiquen una evaluación más profunda por parte de un profesional de la salud.
Diagnóstico de problemas de ovulación
Para diagnosticar los trastornos de la ovulación se pueden realizar una serie de evaluaciones y pruebas, entre ellas:
1. Historial médico y examen físico:Una historia clínica completa y un examen físico completo pueden revelar posibles causas subyacentes, como factores de estilo de vida, cambios de peso o niveles de estrés que podrían influir en la ovulación.
2. Seguimiento de la ovulación:Se les puede pedir a las mujeres que controlen sus ciclos menstruales, su temperatura corporal basal o que utilicen kits de predicción de la ovulación. Los análisis de sangre de progesterona realizados durante la fase lútea pueden confirmar si se ha producido la ovulación.
3. Pruebas hormonales:Los análisis de sangre pueden evaluar los niveles de hormonas clave, incluidas FSH, LH, estrógeno, prolactina, testosterona y hormonas tiroideas, para determinar cualquier desequilibrio que pueda afectar la ovulación.
4. Ultrasonido:Una ecografía transvaginal puede ayudar a visualizar los ovarios y detectar la presencia de folículos, quistes u otras anomalías. Esta técnica de diagnóstico por imágenes puede ser especialmente útil para diagnosticar el síndrome de ovario poliquístico o para controlar la respuesta de los ovarios al tratamiento hormonal si se está realizando un tratamiento de fertilidad.
5. Pruebas adicionales para detectar condiciones subyacentes:Si las pruebas iniciales apuntan a un problema como IOP, SOP o un trastorno de la tiroides, se pueden realizar pruebas adicionales para confirmar el diagnóstico.
Los problemas de ovulación pueden dificultar la concepción, ya que la ovulación irregular o ausente reduce la cantidad de oportunidades de que se fecunde un óvulo. Incluso cuando se produce la ovulación, afecciones como el defecto de la fase lútea o la mala calidad de los óvulos pueden interferir con la implantación o aumentar el riesgo de aborto espontáneo. Afortunadamente, muchos trastornos de la ovulación son tratables y los avances en la medicina de la fertilidad ofrecen varias opciones para las mujeres que sufren infertilidad relacionada con la ovulación.
2- Problemas con las trompas de Falopio
Las trompas de Falopio obstruidas o dañadas son una causa importante de infertilidad femenina, ya que alteran la vía normal de encuentro entre el óvulo y el espermatozoide, impidiendo así la fecundación. Las trompas de Falopio, que conectan los ovarios con el útero, desempeñan un papel crucial en el proceso reproductivo. Cada mes, después de la ovulación, un óvulo se libera de uno de los ovarios y viaja a través de la trompa de Falopio, donde puede encontrarse con el espermatozoide y ser fecundado. Una vez fecundado, el embrión continúa moviéndose a través de la trompa hasta que llega al útero para su implantación. Cuando una o ambas trompas de Falopio están obstruidas o dañadas, este viaje se ve impedido, lo que dificulta o imposibilita la concepción natural.
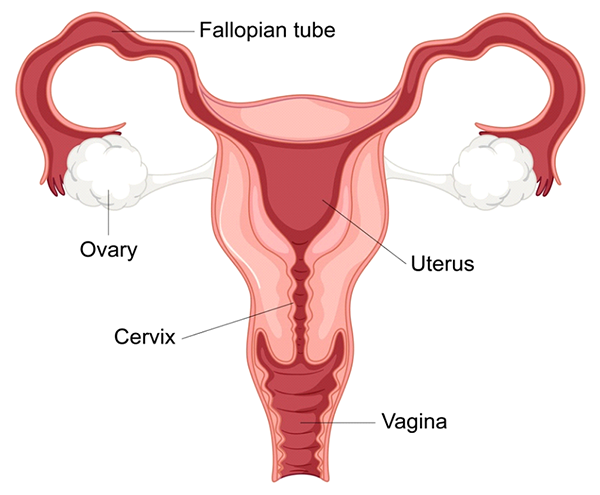
Cómo afecta el daño a las trompas de Falopio a la fertilidad
Los daños o bloqueos en las trompas de Falopio pueden afectar la fertilidad al:
a) Impedir que los espermatozoides lleguen al óvulo: si las trompas de Falopio están totalmente obstruidas, los espermatozoides no pueden llegar al óvulo y no se produce la fecundación. Esta situación se conoce como infertilidad por factor tubárico, que representa alrededor del 25-35% de los casos de infertilidad femenina.
b) Interferencia con la captación de óvulos: los daños en las fimbrias (los extremos con flecos de las trompas de Falopio cerca de los ovarios) pueden impedir que el óvulo sea captado y atraído hacia la trompa de Falopio después de la ovulación. Sin este proceso, el óvulo no puede viajar por la trompa para encontrarse con el espermatozoide.
c) Impedir el transporte del embrión: si una trompa de Falopio parcialmente bloqueada permite la fecundación pero impide el paso del óvulo fecundado (embrión), puede producirse un embarazo ectópico. Se trata de una afección grave en la que el embrión se implanta y crece dentro de la trompa de Falopio en lugar de hacerlo en el útero, lo que puede provocar complicaciones médicas y requiere un tratamiento inmediato.
d) Inhibición de la implantación en el útero: aunque la trompa esté parcialmente bloqueada o dañada, puede afectar el transporte oportuno del embrión al útero. El transporte tardío del embrión puede reducir la probabilidad de una implantación exitosa o aumentar el riesgo de implantación en un lugar inadecuado.
Causas de obstrucción o daño de las trompas de Falopio
1. Enfermedad inflamatoria pélvica (EIP): La EIP es una infección de los órganos reproductores femeninos, a menudo causada por infecciones de transmisión sexual (ITS), como clamidia o gonorrea. Si no se tratan, estas infecciones pueden provocar inflamación y cicatrización de las trompas de Falopio, lo que provoca bloqueos parciales o totales. La EIP es una de las causas más comunes de infertilidad por factor tubárico.
2. Endometriosis: La endometriosis es una afección en la que un tejido similar al revestimiento del útero crece fuera del útero, a menudo en los ovarios, las trompas de Falopio o el revestimiento pélvico. Los implantes endometriales en las trompas de Falopio o cerca de ellas pueden causar adherencias, inflamación o cicatrices, lo que provoca bloqueos o restricción del movimiento de las trompas.
3. Cirugía de trompas: Las cirugías previas en las trompas de Falopio, como procedimientos para reparar un embarazo tubárico, eliminar quistes o tratar infecciones tubáricas, pueden provocar cicatrices y adherencias que obstruyan las trompas. Las mujeres que se han sometido a una ligadura de trompas (esterilización quirúrgica) también pueden sufrir infertilidad debido al bloqueo intencional de las trompas.
4. Adherencias de cirugías abdominales o pélvicas: las cirugías que involucran el abdomen o la pelvis, como la apendicectomía, la cesárea o las cirugías para quistes ováricos, pueden provocar la formación de tejido cicatricial alrededor de las trompas de Falopio. Estas adherencias pueden obstruir las trompas o restringir su movimiento, lo que afecta el viaje del óvulo hacia el útero.
5. Hidrosálpinx: el hidrosálpinx es una afección en la que una o ambas trompas de Falopio se bloquean y se llenan de líquido. Esta afección suele ser consecuencia de infecciones, enfermedad inflamatoria pélvica o endometriosis. El líquido que se encuentra dentro del hidrosálpinx puede ser tóxico para los embriones y puede reducir la tasa de éxito de la fertilización in vitro (FIV) si no se trata.
6. Anomalías congénitas: En casos raros, algunas mujeres pueden nacer con anomalías estructurales en las trompas de Falopio, lo que puede provocar bloqueos o disfunción.
Diagnóstico de trompas de Falopio bloqueadas o dañadas
Para diagnosticar bloqueos o daños en las trompas de Falopio, a menudo se utilizan los siguientes métodos de diagnóstico:
1. Histerosalpingografía (HSG):La HSG es un procedimiento radiográfico en el que se inyecta un tinte especial en el útero y las trompas de Falopio para evaluar su estructura. El tinte aparece en las radiografías y puede revelar bloqueos o anomalías en las trompas.
2. Sonohisterografía:Este procedimiento es similar a la HSG, pero utiliza ultrasonido en lugar de rayos X. Se inyecta una solución salina en el útero, lo que permite al médico ver las trompas de Falopio y evaluar si hay obstrucciones o daños.
3. Laparoscopia:La laparoscopia es un procedimiento quirúrgico mínimamente invasivo que implica la inserción de una pequeña cámara a través de una pequeña incisión en el abdomen. Este procedimiento permite al médico ver las trompas de Falopio directamente, eliminar obstrucciones o adherencias menores y evaluar el estado de los órganos pélvicos circundantes. La laparoscopia se realiza a menudo cuando otras pruebas de diagnóstico no han sido concluyentes o cuando hay síntomas de endometriosis o adherencias pélvicas.
4. Prueba de anticuerpos contra clamidia:Dado que la infección por clamidia puede causar daño a las trompas sin síntomas evidentes, este análisis de sangre busca anticuerpos contra la clamidia. Un resultado positivo puede indicar una infección anterior que podría haber afectado las trompas.
La FIV se recomienda a menudo para mujeres con trompas de Falopio bloqueadas o gravemente dañadas, ya que evita por completo la necesidad de tener trompas. En la FIV, se extraen óvulos de los ovarios, se fecundan con esperma en un laboratorio y los embriones resultantes se transfieren directamente al útero. La FIV se considera el tratamiento más eficaz para la infertilidad por factor tubárico, en particular en casos de daño grave o irreversible. Las mujeres con una trompa bloqueada aún pueden intentar concebir de forma natural, pero la FIV ofrece una alternativa si otros esfuerzos no dan resultado.
3- Problemas físicos con el útero
Las anomalías físicas o los problemas estructurales del útero son otro factor importante en la infertilidad femenina. El útero, o matriz, proporciona el entorno para la implantación del embrión y el crecimiento de un feto en desarrollo. Los problemas estructurales del útero pueden interrumpir la implantación de un óvulo fertilizado, afectar el desarrollo del embrión o aumentar el riesgo de aborto espontáneo. Estos problemas se conocen a menudo como infertilidad por factor uterino y pueden afectar tanto la capacidad de concebir como la probabilidad de mantener un embarazo saludable.
Tipos de problemas estructurales del útero y su impacto en la fertilidad
Existen varios tipos de problemas físicos que pueden afectar al útero y provocar infertilidad. Cada afección tiene efectos únicos sobre la fertilidad, según su ubicación, gravedad y causa subyacente. Los problemas estructurales uterinos más comunes asociados con la infertilidad incluyen:
1. Miomas (leiomiomas uterinos):
Los fibromas son crecimientos no cancerosos compuestos de músculo y tejido fibroso que se desarrollan dentro o sobre las paredes del útero. Si bien los fibromas son bastante comunes y afectan hasta el 70-80% de las mujeres a los 50 años, no siempre causan infertilidad. El impacto de los fibromas en la fertilidad depende de su tamaño, número y ubicación dentro del útero. Los fibromas submucosos, que crecen dentro de la cavidad uterina, tienen más probabilidades de interferir con la implantación o el desarrollo del embrión. Los fibromas grandes o múltiples también pueden alterar la forma de la cavidad uterina u obstruir las trompas de Falopio, lo que dificulta aún más la concepción. Los fibromas también pueden aumentar el riesgo de aborto espontáneo, parto prematuro y complicaciones durante el embarazo, según su tamaño y ubicación.
2. Pólipos uterinos:
Los pólipos uterinos son crecimientos benignos y pequeños que surgen del revestimiento del útero (endometrio). Aunque por lo general no son cancerosos, los pólipos pueden interferir con la fertilidad al bloquear el paso de los espermatozoides, impedir la implantación o interrumpir el suministro de sangre a un embrión implantado. Los pólipos pueden ser especialmente problemáticos si se ubican cerca del lugar donde normalmente se implantaría un embrión. En tales casos, pueden impedir un embarazo exitoso o aumentar el riesgo de un aborto espontáneo temprano.
3. Anomalías uterinas congénitas:
Se trata de anomalías estructurales del útero que están presentes desde el nacimiento y que se deben a problemas de desarrollo en la formación de los conductos de Müller, que dan origen al útero, las trompas de Falopio y la parte superior de la vagina. Las anomalías uterinas congénitas pueden adoptar una de las siguientes formas:
Útero bicorne:El útero tiene forma de corazón con una hendidura profunda en la parte superior que crea dos cavidades. Un útero bicorne puede aumentar el riesgo de aborto espontáneo, parto prematuro y posición fetal anormal.
Útero septado:Un tabique (pared) fibroso o muscular divide la cavidad uterina, parcial o totalmente. Esta afección se asocia con mayores tasas de aborto espontáneo y de fracaso de la implantación, ya que el tabique puede tener un suministro sanguíneo reducido, lo que lo hace menos propicio para la implantación del embrión.
Útero unicorne:Solo se forma la mitad del útero, lo que suele dar lugar a una cavidad uterina más pequeña de lo habitual. Esto puede provocar dificultades para mantener un embarazo, con un mayor riesgo de aborto espontáneo y parto prematuro.
Útero didelfo:Esta rara afección, también conocida como “útero doble”, se produce cuando se forman dos cavidades uterinas separadas. Aunque la concepción es posible, el embarazo puede ser de mayor riesgo debido al espacio uterino limitado.
Las anomalías uterinas congénitas a menudo contribuyen a abortos recurrentes y también pueden dificultar la concepción de las mujeres, especialmente si la forma del útero impide una implantación adecuada.
4. Adherencias intrauterinas (síndrome de Asherman):
Las adherencias intrauterinas son bandas de tejido cicatricial que se forman dentro del útero, a menudo como resultado de un traumatismo en el revestimiento uterino. Suelen ser consecuencia de cirugías uterinas, como la dilatación y el legrado (D&C), o infecciones. El síndrome de Asherman puede provocar una obstrucción parcial o total de la cavidad uterina, lo que puede impedir la implantación o provocar abortos espontáneos recurrentes. En casos graves, las adherencias pueden impedir la menstruación por completo (amenorrea). Las mujeres con síndrome de Asherman pueden experimentar períodos menstruales escasos o ausentes, dolor pélvico e infertilidad, especialmente si las adherencias alteran el funcionamiento normal del útero.
5. Adenomiosis:
La adenomiosis se produce cuando el tejido endometrial (el revestimiento del útero) crece dentro de la pared muscular del útero. Esta afección puede provocar un engrosamiento y agrandamiento del útero y provocar períodos menstruales dolorosos o abundantes, dolor pélvico e infertilidad. La adenomiosis suele estar asociada a fallos de implantación y a un mayor riesgo de aborto espontáneo. Si bien no se comprende por completo la causa exacta de la infertilidad en la adenomiosis, se cree que el crecimiento anormal del tejido endometrial en la pared muscular altera el funcionamiento adecuado del útero.
6. Problemas endometriales:
El grosor y la calidad del endometrio son fundamentales para que la implantación del embrión sea exitosa. En algunos casos, las mujeres pueden tener un endometrio demasiado delgado o que no se desarrolla adecuadamente, a menudo debido a desequilibrios hormonales, ciertos medicamentos o cirugías uterinas previas. Un endometrio delgado puede reducir la probabilidad de implantación, ya que puede no brindar el soporte necesario para que el embrión se adhiera y se desarrolle.
Síntomas de problemas estructurales del útero
Si bien algunas mujeres con problemas estructurales uterinos pueden no presentar síntomas, otras pueden experimentar lo siguiente:
• Sangrado menstrual irregular o abundante (común en el caso de fibromas, pólipos y adenomiosis)
• Períodos dolorosos o dolor pélvico.
• Pérdida recurrente del embarazo o aborto espontáneo
• Dificultad para concebir a pesar de la ovulación regular y la salud de los espermatozoides.
• Dolor durante las relaciones sexuales
Debido a que los síntomas pueden ser sutiles o superponerse con otras afecciones, los problemas estructurales uterinos a menudo solo se diagnostican después de que una mujer busca una evaluación por infertilidad o abortos espontáneos recurrentes.
Diagnóstico de problemas estructurales del útero
Para diagnosticar problemas estructurales en el útero, a menudo se utiliza una combinación de pruebas de diagnóstico por imágenes y, si es necesario, procedimientos mínimamente invasivos.
Ultrasonido:La ecografía transvaginal es una herramienta de diagnóstico por imágenes de primera línea para evaluar la estructura uterina. Puede identificar fibromas, pólipos, anomalías congénitas y adenomiosis. En algunos casos, la ecografía 3D puede proporcionar una visión más detallada de la forma del útero.
Histerosalpingografía (HSG):Este procedimiento de rayos X implica inyectar un tinte de contraste en el útero para delinear la forma de la cavidad uterina y verificar si hay bloqueos o adherencias en las trompas de Falopio.
Sonohisterografía:Durante una ecografía se inyecta una solución salina en el útero para obtener una visión más clara de la cavidad uterina. Esta técnica puede ayudar a identificar pólipos, fibromas y adherencias.
Imágenes por resonancia magnética (IRM):La resonancia magnética proporciona imágenes de alta resolución del útero y es particularmente útil para diagnosticar adenomiosis, anomalías congénitas y fibromas uterinos profundos.
Histeroscopia:La histeroscopia implica la inserción de un endoscopio delgado e iluminado a través del cuello uterino para ver directamente el interior del útero. Permite al médico inspeccionar visualmente la cavidad uterina para detectar pólipos, fibromas o adherencias y, si es necesario, extirparlos o tratarlos durante el mismo procedimiento.
Laparoscopia:La laparoscopia es un procedimiento quirúrgico mínimamente invasivo que permite al médico ver el exterior del útero y las estructuras circundantes, como las trompas de Falopio y los ovarios. Es particularmente útil para identificar la endometriosis o las adherencias pélvicas que pueden afectar la fertilidad.
4- Problemas con el cuello uterino
Los problemas cervicales pueden afectar significativamente la fertilidad de una mujer, ya que el cuello uterino desempeña un papel fundamental en el viaje de los espermatozoides hasta el óvulo. El cuello uterino es la parte inferior del útero que se conecta con la vagina y sirve como puerta de entrada para que los espermatozoides ingresen al útero y suban hacia las trompas de Falopio, donde generalmente ocurre la fertilización. Los problemas cervicales que interfieren con la función o la estructura del cuello uterino pueden impedir que los espermatozoides lleguen al óvulo, reducir la probabilidad de implantación o aumentar el riesgo de pérdida del embarazo.

Tipos de problemas cervicales y su impacto en la fertilidad
Existen varios tipos de problemas cervicales que pueden afectar la fertilidad:
1. Anormalidades del moco cervical:
El moco cervical, producido por las glándulas del interior del cuello uterino, es fundamental para facilitar el movimiento de los espermatozoides. En la época de la ovulación, el moco cervical se vuelve fino, elástico y resbaladizo (similar a la consistencia de la clara de huevo), lo que facilita el paso de los espermatozoides a través del cuello uterino y hacia el útero. Cuando el moco cervical es demasiado espeso, escaso u hostil (desfavorable para los espermatozoides), puede obstaculizar el movimiento de los espermatozoides o matarlos antes de que lleguen al óvulo. Esta afección a veces se denomina “moco cervical hostil” y suele deberse a desequilibrios hormonales, infecciones, determinados medicamentos o problemas de salud subyacentes. Un moco cervical insuficiente o de mala calidad también puede impedir que los espermatozoides sobrevivan lo suficiente para llegar al óvulo, lo que reduce la probabilidad de fertilización.
2. Estenosis cervical (estrechamiento del canal cervical):
La estenosis cervical es una afección en la que el canal cervical se estrecha o cierra de forma anormal, lo que dificulta el paso de los espermatozoides. Esta afección puede ser congénita (presente desde el nacimiento) o adquirida debido a cirugías, infecciones, traumatismos o radioterapia. En casos graves, la estenosis cervical puede obstruir por completo el paso de los espermatozoides, impidiendo de forma efectiva la concepción natural. La estenosis cervical también puede provocar irregularidades menstruales y dolor, ya que la sangre menstrual puede tener dificultades para pasar a través del cuello uterino estrechado. En casos de estenosis grave, se pueden recomendar técnicas de reproducción asistida como la inseminación intrauterina (IIU) o la fertilización in vitro (IVF) para evitar el paso del cuello uterino.
3. Infecciones e inflamaciones del cuello uterino:
Las infecciones del cuello uterino, como la cervicitis (inflamación del cuello uterino) o las infecciones de transmisión sexual (ITS) como la clamidia y la gonorrea, pueden afectar la fertilidad. La inflamación y la infección del cuello uterino pueden alterar la calidad del moco cervical, haciéndolo menos favorable para los espermatozoides. En algunos casos, las infecciones no tratadas pueden provocar el desarrollo de tejido cicatricial, que puede estrechar el canal cervical. Las infecciones también pueden propagarse hacia arriba, dando lugar a la enfermedad inflamatoria pélvica (EIP), que puede afectar aún más la fertilidad al causar cicatrices y bloqueos en las trompas de Falopio.
4. Insuficiencia cervical (cuello uterino incompetente):
La insuficiencia cervical, también conocida como cérvix incompetente, ocurre cuando el cuello uterino es demasiado débil para permanecer cerrado durante el embarazo. Aunque esta afección no impide directamente la concepción, puede provocar un aborto espontáneo, especialmente en el segundo trimestre, ya que el cuello uterino puede comenzar a dilatarse de manera prematura. La insuficiencia cervical puede deberse a factores genéticos, cirugías cervicales previas (por ejemplo, procedimiento LEEP o biopsia cónica), traumatismo en el parto o anomalías congénitas. Las mujeres con esta afección a menudo experimentan pérdidas recurrentes del embarazo y pueden requerir intervenciones médicas para sostener el cuello uterino durante el embarazo.
5. Cirugías o procedimientos cervicales previos:
Ciertos procedimientos cervicales, como la escisión electroquirúrgica con asa (LEEP) o la biopsia cónica, se utilizan para eliminar células precancerosas del cuello uterino, pero a veces pueden afectar la fertilidad. Estos procedimientos pueden debilitar el cuello uterino o causar cicatrices, lo que puede provocar insuficiencia o estenosis cervical. Si bien la mayoría de las mujeres conservan la fertilidad después de estos procedimientos, aquellas que experimentan complicaciones pueden enfrentar un mayor riesgo de infertilidad, pérdida recurrente del embarazo o parto prematuro. En algunos casos, las cicatrices cervicales de la cirugía pueden afectar la producción de moco o dificultar el paso de los espermatozoides.
6. Anticuerpos antiespermáticos en el moco cervical:
En casos excepcionales, el sistema inmunológico de una mujer puede producir anticuerpos contra los espermatozoides, percibiéndolos como invasores extraños. Estos anticuerpos pueden estar presentes en el moco cervical y pueden afectar el movimiento de los espermatozoides, dañarlos o impedir que lleguen al útero. La presencia de anticuerpos antiespermáticos en el moco cervical puede provocar lo que se conoce como “infertilidad inmunológica”, que puede requerir tratamientos específicos, como la inseminación intrauterina o la fecundación in vitro, para ayudar a evitar el cuello uterino y mejorar las posibilidades de fertilización.
Diagnóstico de problemas cervicales en casos de infertilidad
El diagnóstico de la infertilidad relacionada con el cuello uterino generalmente implica una serie de pruebas y evaluaciones. Un examen pélvico permite al médico evaluar el tamaño, la forma y la posición del cuello uterino y verificar si hay anomalías visibles o signos de inflamación. A veces, se puede solicitar una prueba poscoital si se sospecha la presencia de moco hostil. En esta prueba, se recoge una muestra de moco cervical después de la relación sexual para examinar el movimiento de los espermatozoides dentro del moco. Esta prueba ayuda a evaluar si el moco cervical favorece o inhibe el movimiento de los espermatozoides, aunque hoy en día se usa con menos frecuencia debido a la variabilidad de los resultados.
La HSG es un procedimiento radiográfico que utiliza un medio de contraste para evaluar la forma del útero y la permeabilidad (apertura) del canal cervical y las trompas de Falopio. Ayuda a detectar cualquier bloqueo estructural en el cuello uterino. Se pueden realizar cultivos cervicales para identificar infecciones, mientras que una biopsia cervical puede evaluar la presencia de células anormales o precancerosas. Estas pruebas pueden ayudar a identificar infecciones o cicatrices que pueden estar afectando la fertilidad.
La ecografía puede utilizarse para evaluar la estructura y la longitud del cuello uterino, especialmente en casos en los que se sospecha una insuficiencia cervical. La ecografía transvaginal se utiliza a menudo para controlar la longitud del cuello uterino durante el embarazo en mujeres con antecedentes de insuficiencia cervical.
5- Edad
La edad es uno de los factores más importantes que afectan la fertilidad femenina. A medida que la mujer envejece, su fertilidad disminuye de forma natural debido a cambios en la cantidad y calidad de sus óvulos, así como a alteraciones en su sistema reproductivo que afectan a la concepción y el embarazo. La disminución de la fertilidad suele comenzar entre los 20 y los 30 años y se acelera significativamente después de los 35 años. Cuando la mujer llega a los 40, la probabilidad de concebir de forma natural disminuye considerablemente y el riesgo de complicaciones aumenta. A medida que la mujer envejece, se producen los siguientes cambios:
1. Disminución de la cantidad de óvulos (reserva ovárica)
Las mujeres nacen con todos los óvulos que tendrán en su vida, aproximadamente entre 1 y 2 millones en el momento del nacimiento. En la pubertad, este número ya ha disminuido a alrededor de 300.000 a 400.000, y con cada ciclo menstrual, se agotan más óvulos. Al final de los 30, la cantidad de óvulos restantes (conocida como reserva ovárica) disminuye rápidamente. A medida que una mujer se acerca a la menopausia, generalmente alrededor de los 50, quedan muy pocos óvulos viables, si es que quedan alguno. La disminución de la reserva ovárica afecta la capacidad de una mujer para concebir, ya que menos óvulos significan menos oportunidades de fertilización. La reducción de la oferta de óvulos también limita la eficacia de los tratamientos de fertilidad como la fertilización in vitro (FIV) porque los ovarios pueden no producir suficientes óvulos en respuesta a la estimulación.
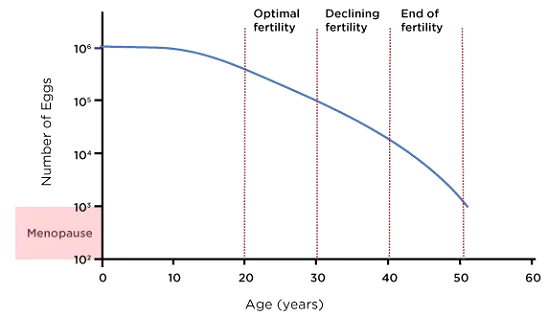
2. Disminución de la calidad de los óvulos
Con la edad no sólo disminuye la cantidad de óvulos, sino también su calidad. La calidad de los óvulos se refiere a la integridad genética y cromosómica de un óvulo. A medida que las mujeres envejecen, los óvulos tienen más probabilidades de acumular anomalías cromosómicas, lo que aumenta la probabilidad de trastornos genéticos, como el síndrome de Down, y reduce las posibilidades de una concepción exitosa. Las anomalías cromosómicas también aumentan el riesgo de aborto espontáneo, en particular en mujeres mayores de 35 años. Los estudios muestran que la tasa de aborto espontáneo en mujeres de entre 20 y 30 años es de aproximadamente 10-15%, pero esta tasa aumenta a alrededor de 35% en mujeres de entre 40 y 49 años.
No sólo los problemas genéticos son frecuentes en los ovocitos en las edades más avanzadas, sino que los orgánulos citoplasmáticos también pierden su función con el aumento de la edad. En particular, la función mitocondrial es vital para el crecimiento y desarrollo celular y las mitocondrias envejecidas pueden dejar de proporcionar el equilibrio necesario entre la producción de energía y el daño oxidativo dentro de los ovocitos. Algunos tratamientos de nueva generación, como la "terapia de reemplazo mitocondrial", pueden ser útiles en los casos en los que el envejecimiento de los ovocitos es una preocupación durante los tratamientos de fertilidad. La disminución de la calidad de los óvulos es una razón importante por la que las tasas de embarazo y de nacimientos vivos disminuyen con la edad, incluso con el uso de tratamientos de fertilidad.
3. Mayor riesgo de problemas de salud reproductiva
A medida que las mujeres envejecen, tienen más probabilidades de desarrollar problemas de salud que pueden afectar la fertilidad, como endometriosis, fibromas uterinos y complicaciones crónicas de la enfermedad inflamatoria pélvica. Estos problemas de salud no solo afectan las posibilidades de concepción, sino que también pueden aumentar el riesgo de complicaciones en el embarazo y abortos espontáneos.
4. Receptividad uterina reducida
Con la edad, el útero también puede experimentar cambios que afecten su capacidad para sustentar un embarazo. El revestimiento endometrial, que se engrosa en cada ciclo para prepararse para un posible embrión, puede no desarrollarse de manera tan óptima como antes. Este cambio puede reducir la probabilidad de una implantación exitosa, incluso si hay un embrión sano presente. El sistema vascular del útero también puede verse afectado por la edad, lo que reduce el flujo sanguíneo al revestimiento endometrial. Un flujo sanguíneo adecuado es esencial para un útero receptivo que pueda sustentar un embrión, por lo que la disminución del flujo sanguíneo puede reducir la fertilidad y aumentar el riesgo de pérdida temprana del embarazo.
5. Mayor riesgo de complicaciones en el embarazo
Las mujeres mayores que conciben de forma natural o con asistencia enfrentan un mayor riesgo de complicaciones durante el embarazo. Estas complicaciones incluyen:
Diabetes gestacional: Las mujeres mayores de 35 años tienen mayor riesgo de desarrollar diabetes gestacional, lo que puede afectar la salud materna y fetal.
Hipertensión y preeclampsia: la presión arterial alta y la preeclampsia (una complicación del embarazo potencialmente peligrosa caracterizada por presión arterial alta) son más comunes en madres mayores.
Placenta previa: Las mujeres mayores de 35 años tienen un mayor riesgo de placenta previa, una afección en la que la placenta cubre el cuello uterino, lo que puede provocar complicaciones durante el parto.
Parto prematuro: Las mujeres mayores de 35 años tienen mayor riesgo de tener un parto prematuro, lo que puede afectar la salud del bebé.
Estas complicaciones del embarazo, si bien no afectan directamente la capacidad de concebir, subrayan los riesgos adicionales para la salud que enfrentan las mujeres que intentan concebir a una edad más avanzada. La edad afecta no solo la concepción natural, sino también las tasas de éxito de las tecnologías de reproducción asistida como la FIV. Las mujeres menores de 35 años generalmente tienen mayores tasas de éxito con la FIV en comparación con las mujeres mayores de 40. A los 43 años, la tasa de éxito de la FIV con los propios óvulos de una mujer disminuye significativamente, en gran medida debido a la disminución de la cantidad y la calidad de los óvulos. Para aumentar sus posibilidades, algunas mujeres mayores optan por utilizar óvulos de una donante más joven, lo que mejora en gran medida las tasas de éxito porque los óvulos de la donante suelen ser de mayor calidad. Sin embargo, el proceso de donación de óvulos es costoso y requiere una consideración y una preparación cuidadosas.
Opciones de preservación de la fertilidad: congelación de óvulos y embriones
Debido a la disminución de la fertilidad asociada con la edad, algunas mujeres optan por preservar su fertilidad mediante la congelación de óvulos o embriones (criopreservación) cuando son más jóvenes, especialmente si planean retrasar el embarazo.
Congelación de óvulos: este proceso implica estimular los ovarios para que produzcan múltiples óvulos, que luego se recuperan y se congelan para su uso futuro. La congelación de óvulos puede permitir que las mujeres utilicen óvulos más jóvenes y saludables cuando estén listas para concebir, lo que aumenta sus posibilidades de lograr un embarazo exitoso más adelante en la vida.
Congelación de embriones: este proceso, similar a la congelación de óvulos, implica la fertilización de los óvulos recuperados con esperma antes de la congelación. Esta opción suele ser elegida por mujeres que tienen una relación estable y desean tener embriones listos para la implantación en el futuro.
Estas técnicas ofrecen opciones a las mujeres que desean retrasar el embarazo y, al mismo tiempo, preservar la calidad de sus óvulos o embriones. Si bien la edad es un factor importante en la fertilidad, los avances médicos como las técnicas de reproducción asistida, la congelación de óvulos y la congelación de embriones brindan opciones para ayudar a las mujeres a concebir más adelante en la vida. Comprender los efectos de la edad en la fertilidad puede ayudar a las mujeres a tomar decisiones reproductivas informadas y buscar ayuda de manera temprana si planean concebir a una edad más avanzada.
6- Problemas del sistema inmunológico
Los problemas inmunológicos pueden afectar significativamente la fertilidad de las mujeres, lo que a menudo provoca infertilidad inexplicable, abortos recurrentes o complicaciones durante el embarazo. El sistema inmunológico está diseñado para proteger al cuerpo de infecciones e invasores extraños, pero en algunos casos, las respuestas inmunológicas pueden interferir con la fertilidad al atacar las células reproductivas, los tejidos o incluso el embrión. Estos problemas de fertilidad relacionados con el sistema inmunológico pueden ser resultado de enfermedades autoinmunes, respuestas inmunológicas a los espermatozoides o embriones o una activación anormal del sistema inmunológico.
1. Trastornos autoinmunes e infertilidad
En los trastornos autoinmunes, el sistema inmunitario ataca por error los propios tejidos del organismo como si fueran invasores extraños. Varias enfermedades autoinmunes están asociadas con la infertilidad:
Lupus eritematoso sistémico (LES): el lupus es una enfermedad autoinmune que puede causar inflamación en todo el cuerpo, incluidos los órganos reproductivos. Las mujeres con lupus pueden sufrir irregularidades menstruales, abortos espontáneos recurrentes o partos prematuros debido a ataques del sistema inmunitario al útero o la placenta.
Síndrome antifosfolípido (SAF): El SAF es un trastorno autoinmune en el que el sistema inmunitario produce anticuerpos contra los fosfolípidos, moléculas de las membranas celulares, y suele estar asociado a pérdidas recurrentes del embarazo. Estos anticuerpos antifosfolípidos pueden provocar la formación de coágulos sanguíneos en la placenta, lo que corta el suministro de sangre al feto y provoca un aborto espontáneo. El SAF también está relacionado con otras complicaciones, como la preeclampsia y el parto prematuro.
Tiroiditis de Hashimoto y enfermedad de Graves: ambas son trastornos tiroideos autoinmunes en los que el sistema inmunitario ataca a la glándula tiroides, ya sea reduciendo (enfermedad de Hashimoto) o aumentando (enfermedad de Graves) la producción de hormona tiroidea. Las hormonas tiroideas desempeñan un papel fundamental en la regulación del ciclo menstrual y en el apoyo al embarazo. Las mujeres con trastornos tiroideos suelen experimentar irregularidades menstruales, problemas de ovulación y un mayor riesgo de aborto espontáneo.
Artritis reumatoide (AR) y otras enfermedades autoinmunes: la AR y otras enfermedades autoinmunes similares pueden generar afecciones inflamatorias que interfieren en la ovulación, la implantación del embrión y el mantenimiento del embarazo. Además, algunos medicamentos utilizados para tratar enfermedades autoinmunes pueden afectar negativamente la fertilidad.
2. Anticuerpos antiespermatozoides
En algunos casos, el sistema inmunológico de una mujer puede producir anticuerpos que atacan específicamente a los espermatozoides. Esta respuesta puede ocurrir si los espermatozoides se exponen al sistema inmunológico a través de un traumatismo, una infección o una cirugía. Los anticuerpos pueden perjudicar la motilidad de los espermatozoides (dificultando su desplazamiento), unirse a la superficie de los espermatozoides o incluso destruirlos por completo, impidiendo así la fertilización. Los anticuerpos antiespermatozoides suelen encontrarse en el moco cervical, pero también pueden estar presentes en otras áreas del sistema reproductivo. Las mujeres con anticuerpos antiespermatozoides pueden requerir tratamientos como la inseminación intrauterina (IIU) o la fertilización in vitro (IVF) para evitar el moco cervical y mejorar las posibilidades de concepción.
3. Anticuerpos antiováricos
Los anticuerpos antiováricos son anticuerpos que atacan el tejido ovárico, dirigiéndose a componentes como los óvulos, los receptores de la hormona folículo estimulante (FSH) o las estructuras que sustentan el desarrollo del óvulo. Esta respuesta inmunitaria puede interferir con la función ovárica, reducir la calidad de los óvulos y provocar un envejecimiento o insuficiencia ovárica precoz (conocida como insuficiencia ovárica primaria o IOP). Las mujeres con anticuerpos antiováricos pueden experimentar ciclos menstruales irregulares, anovulación (ausencia de ovulación) o una reserva ovárica reducida, todo lo cual puede reducir la fertilidad y dificultar la concepción. La insuficiencia ovárica autoinmune a veces está relacionada con otras enfermedades autoinmunes, como la enfermedad de Addison, el lupus o los trastornos de la tiroides.
4. Endometriosis e inflamación
La endometriosis es una enfermedad en la que un tejido similar al revestimiento uterino (endometrio) crece fuera del útero, a menudo en los ovarios, las trompas de Falopio y otros órganos pélvicos. Si bien la endometriosis no es estrictamente una enfermedad autoinmune, se ha descubierto que implica una disfunción del sistema inmunitario y una inflamación crónica. En las mujeres con endometriosis, el sistema inmunitario no logra eliminar el tejido endometrial mal ubicado, lo que provoca una inflamación persistente. Este entorno inflamatorio puede interferir con la calidad de los óvulos, alterar la ovulación y crear adherencias (tejido cicatricial) que bloquean o dañan las trompas de Falopio. La inflamación y la actividad inmunitaria asociadas con la endometriosis también pueden crear un entorno hostil para los espermatozoides, los óvulos y los embriones, lo que dificulta lograr un embarazo exitoso.
5. Células asesinas naturales (NK) y fallos de implantación
Las células asesinas naturales (NK) son células inmunitarias que desempeñan un papel esencial en los mecanismos de defensa del cuerpo, incluida la regulación de las respuestas inmunitarias en el útero. En un embarazo típico, las células NK uterinas ayudan a apoyar la implantación al promover el flujo sanguíneo al embrión en desarrollo. Sin embargo, algunas mujeres pueden tener niveles elevados de células NK o células NK anormalmente activadas que apuntan y atacan al embrión, lo que lleva al fracaso de la implantación o la pérdida temprana del embarazo. La actividad elevada de las células NK se asocia con abortos espontáneos recurrentes y puede contribuir a la infertilidad inexplicable. Las pruebas de actividad de las células NK son controvertidas, ya que no todos los investigadores están de acuerdo sobre su impacto en la fertilidad, pero algunos especialistas en fertilidad pueden ofrecer tratamientos inmunomoduladores, como esteroides o inmunoglobulina intravenosa (IVIG), para reducir la actividad de las células NK y mejorar el éxito de la implantación.
6. Desequilibrio de citocinas y respuesta inflamatoria
Las citocinas son pequeñas proteínas producidas por las células inmunitarias que desempeñan un papel en la señalización celular y la regulación inmunitaria. Durante las primeras etapas del embarazo, es necesario un entorno equilibrado de citocinas para favorecer la implantación del embrión y el desarrollo fetal temprano. Sin embargo, un desequilibrio en las citocinas (especialmente un aumento de las citocinas proinflamatorias) puede alterar este proceso. En las mujeres con infertilidad relacionada con el sistema inmunitario, los niveles elevados de citocinas inflamatorias pueden crear un entorno uterino desfavorable, lo que reduce las posibilidades de implantación del embrión o aumenta el riesgo de aborto espontáneo. Afecciones como las enfermedades autoinmunes, las infecciones o la inflamación crónica pueden provocar un desequilibrio de las citocinas, lo que puede contribuir a la infertilidad o a la pérdida recurrente del embarazo.
7. Respuesta inmune a la placenta
La placenta, que nutre al feto en desarrollo, es fundamental para un embarazo exitoso. Durante un embarazo normal, el sistema inmunológico materno tolera la placenta, que tiene material genético tanto de la madre como del padre. Sin embargo, en algunas mujeres, el sistema inmunológico puede considerar la placenta como algo extraño e iniciar una respuesta inmunitaria contra ella. Esta respuesta inmunitaria puede restringir el flujo sanguíneo a la placenta, lo que aumenta el riesgo de aborto espontáneo, preeclampsia, restricción del crecimiento intrauterino y otras complicaciones del embarazo. Afecciones como el síndrome antifosfolípido (SAF) son ejemplos clásicos en los que las respuestas inmunitarias pueden interferir con la función placentaria, lo que lleva a la pérdida del embarazo.
8. Disfunción de implantación inmunológica
Algunas mujeres con infertilidad inexplicable pueden tener lo que se denomina disfunción inmunológica de implantación. Este término se refiere a una respuesta inmunológica hiperactiva o inadecuada que impide que un embrión se implante con éxito en el útero, incluso si tanto el embrión como el revestimiento uterino están sanos. La disfunción inmunológica de implantación es todavía un área de investigación, pero se cree que implica una actividad anormal de las células inmunitarias, incluidas las células NK, las células T y los macrófagos, o un desequilibrio en los factores inmunomoduladores dentro del útero. Todavía se están desarrollando opciones de tratamiento, pero algunos especialistas en fertilidad pueden utilizar corticosteroides, inmunoglobulina intravenosa u otras terapias inmunomoduladoras para intentar mejorar el éxito de la implantación.
Pruebas de diagnóstico para la infertilidad de origen inmunitario
Las pruebas para detectar la infertilidad relacionada con el sistema inmunitario pueden implicar varios enfoques, dependiendo del problema inmunológico sospechado:
Análisis de sangre: Los análisis de sangre pueden detectar anticuerpos específicos (por ejemplo, anticuerpos antiespermatozoides, anticuerpos antiováricos, anticuerpos antifosfolípidos) y medir los niveles o la actividad de las células inmunes.
Ensayos de células NK:Estas pruebas evalúan los niveles y la actividad de las células asesinas naturales en la sangre o el útero, aunque su utilidad clínica aún se debate.
Prueba del perfil de citocinas:Esta prueba mide los niveles de citocinas proinflamatorias y antiinflamatorias para evaluar el equilibrio inmunológico, particularmente en mujeres con pérdidas recurrentes de embarazo.
Histeroscopia o biopsia:Se puede realizar una histeroscopia (visualización del útero con una cámara) o una biopsia endometrial para evaluar la inflamación o la actividad inmunitaria directamente en el útero.
Opciones de tratamiento para la infertilidad relacionada con el sistema inmunológico
Los tratamientos para la infertilidad de origen inmunológico tienen como objetivo abordar el problema inmunológico específico y mejorar las posibilidades de un embarazo exitoso:
Medicamentos inmunomoduladores:
• CorticosteroidesSe pueden usar esteroides en dosis bajas, como la prednisona, para reducir la actividad inmunitaria y la inflamación, en particular en casos de elevación de células NK o falla de implantación relacionada con el sistema inmunitario.
• Inmunoglobulina intravenosa (IVIG):La IgIV se utiliza en algunos casos para suprimir las respuestas inmunitarias anormales, especialmente en mujeres con abortos recurrentes o elevación de células NK, aunque su uso todavía es experimental.
• Heparina de bajo peso molecular (HBPM) y aspirina:En casos de SAF o trastornos de la coagulación, los medicamentos anticoagulantes como la heparina y la aspirina pueden reducir el riesgo de coágulos sanguíneos, lo que favorece la salud de la placenta y reduce el riesgo de aborto espontáneo.
Antibióticos para infecciones: En casos de cervicitis o infecciones de bajo grado, los antibióticos pueden reducir la inflamación en el sistema reproductivo, mejorando potencialmente la fertilidad.
Técnicas de Reproducción Asistida (TRA):
En los casos en que los problemas inmunológicos afectan la concepción natural, las opciones de tecnología de reproducción asistida como la FIV pueden eludir algunas barreras inmunológicas al permitir que la fertilización se produzca fuera del cuerpo. Se pueden utilizar técnicas como la inyección intracitoplasmática de espermatozoides (ICSI) en casos de anticuerpos antiespermatozoides, y la transferencia de embriones puede evitar el moco cervical hostil o las respuestas inmunológicas anormales en el cuello uterino.
7- Defectos de trombofilia
La trombofilia, una afección caracterizada por una mayor tendencia a la formación de coágulos sanguíneos, puede afectar significativamente la fertilidad femenina, en particular al afectar la implantación y aumentar el riesgo de complicaciones en el embarazo. La trombofilia puede ser hereditaria (genética) o adquirida, y a menudo implica anomalías en los mecanismos de coagulación de la sangre. Si bien la trombofilia en sí no impide directamente la concepción, puede crear un entorno que dificulte el progreso del embarazo, lo que conduce a abortos espontáneos recurrentes, complicaciones durante el embarazo y, en algunos casos, problemas con la implantación.
Tipos de trombofilia y su impacto en la fertilidad
La trombofilia puede ser consecuencia de mutaciones genéticas o enfermedades adquiridas que afectan la coagulación sanguínea. Los tipos comunes de trombofilia asociados con la infertilidad y la pérdida del embarazo incluyen:
Trombofilias hereditarias:
a) Mutación del factor V Leiden:Esta mutación hace que la sangre sea más propensa a coagularse al alterar la función del factor de coagulación V, una proteína presente en la sangre. Las mujeres con esta mutación tienen una
b) Mutación del gen de la protrombina (G20210A):Esta mutación aumenta los niveles de protrombina, otra proteína de coagulación, lo que conduce a un mayor riesgo de coágulos sanguíneos y pérdida del embarazo asociada.
do) Deficiencias de proteína C, proteína S y antitrombina:Se trata de enfermedades hereditarias poco frecuentes que reducen la capacidad del organismo para regular la coagulación. Las deficiencias de estas proteínas aumentan el riesgo de coágulos sanguíneos anormales y complicaciones durante el embarazo.
Trombofilia adquirida:
a) Síndrome antifosfolípido (SAF):El síndrome antifosfolípido (SAF) es un trastorno autoinmune en el que el sistema inmunitario produce anticuerpos contra los fosfolípidos, que son moléculas que se encuentran en las membranas celulares. El SAF está fuertemente asociado con la infertilidad y los abortos espontáneos recurrentes, ya que los anticuerpos provocan coágulos de sangre en la placenta, lo que reduce el flujo sanguíneo al feto y conduce a la pérdida del embarazo.
b) Hiperhomocisteinemia:Los niveles elevados de homocisteína (un aminoácido) en la sangre pueden aumentar el riesgo de coágulos sanguíneos y están asociados con la pérdida del embarazo y problemas placentarios. La hiperhomocisteinemia a veces está relacionada con mutaciones del gen MTHFR.
Cómo afecta la trombofilia a la implantación y al embarazo temprano
La coagulación sanguínea desempeña un papel fundamental en las primeras etapas del embarazo, en particular en el establecimiento de la placenta, que sostiene al embrión. La trombofilia puede interferir en estos procesos de varias maneras.
La trombofilia puede provocar la formación de microcoágulos en los vasos sanguíneos del útero y la placenta. Estos coágulos pueden restringir el flujo sanguíneo al endometrio (revestimiento uterino) y a la placenta en desarrollo, privando al embrión de nutrientes esenciales y oxígeno. En las primeras etapas del embarazo, un flujo sanguíneo insuficiente puede impedir la implantación adecuada y provocar una pérdida prematura del embarazo.
La implantación, en la que el embrión se adhiere al revestimiento endometrial, requiere un suministro de sangre saludable y vasos sanguíneos que funcionen bien. Si la coagulación interrumpe el flujo sanguíneo al útero, puede crear un entorno inhóspito para el embrión, lo que reduce la probabilidad de una implantación exitosa. Las mujeres con trombofilia pueden sufrir infertilidad inexplicable debido a repetidos fallos de implantación, incluso si se produce la fertilización.
La trombofilia es un factor de riesgo bien conocido de abortos recurrentes, definidos como dos o más pérdidas de embarazos consecutivos. Los coágulos de sangre que se forman en los vasos sanguíneos de la placenta pueden provocar insuficiencia placentaria, en la que la placenta no puede sostener adecuadamente al embrión o feto en desarrollo. Esto puede provocar:
Pérdida temprana del embarazo:Muchas mujeres con trombofilia experimentan abortos espontáneos durante el primer trimestre, ya que se forman coágulos de sangre en los pequeños vasos sanguíneos de la placenta, cortando el suministro de sangre al embrión.
Pérdida del segundo trimestre:La trombofilia también puede provocar la pérdida del embarazo en el segundo trimestre debido al desarrollo deficiente de la placenta y del flujo sanguíneo, lo que puede provocar una restricción del crecimiento fetal o un desprendimiento de la placenta (cuando la placenta se desprende de la pared uterina).
Nacimiento de un niño muerto:En casos raros, la trombofilia puede contribuir a la muerte fetal si el flujo sanguíneo al feto se restringe gravemente en las últimas etapas del embarazo.
Pruebas diagnósticas de trombofilia en la infertilidad
Las mujeres que sufren pérdidas recurrentes de embarazo, infertilidad inexplicable o complicaciones durante el embarazo pueden someterse a pruebas para detectar trombofilia. Las pruebas más comunes incluyen:
• Pruebas de coagulación sanguínea:Estas pruebas miden los niveles de factores de coagulación y proteínas en la sangre, como el factor V Leiden, protrombina, proteína C, proteína S y antitrombina.
• Prueba de anticuerpos antifosfolípidos:Esta prueba detecta la presencia de anticuerpos antifosfolípidos, que están asociados con el síndrome antifosfolípido. Las pruebas pueden incluir anticuerpos anticardiolipina, anticoagulante lúpico y anticuerpos contra la beta-2 glucoproteína I.
• Niveles de homocisteína:Los niveles elevados de homocisteína se asocian con trastornos de la coagulación y pueden indicar una mutación genética subyacente, como una mutación MTHFR.
Con un tratamiento adecuado, que incluya terapia anticoagulante y un seguimiento estrecho, muchas mujeres con trombofilia pueden concebir con éxito y llevar a término un embarazo saludable. El diagnóstico y el tratamiento tempranos son fundamentales para reducir los riesgos asociados con la trombofilia y mejorar los resultados de fertilidad.
8- Factores de estilo de vida y exposición ambiental
Los factores relacionados con el estilo de vida afectan significativamente la fertilidad femenina al influir en la ovulación, la calidad de los óvulos, los niveles hormonales y la salud reproductiva en general. Algunos de los factores clave del estilo de vida que pueden afectar la fertilidad son la dieta, el peso, la actividad física, los niveles de estrés, el tabaquismo, el consumo de alcohol y la exposición a toxinas ambientales.
1. Dieta y nutrición
Una dieta equilibrada que aporte los nutrientes esenciales es fundamental para la salud reproductiva. Algunos nutrientes, vitaminas y minerales específicos favorecen la ovulación, la producción de hormonas y la calidad de los óvulos. Una mala nutrición o deficiencias específicas pueden alterar estos procesos y afectar la fertilidad:
Antioxidantes: Los alimentos ricos en antioxidantes (como las vitaminas C y E, el folato y el betacaroteno) ayudan a proteger los huevos del estrés oxidativo, que puede dañar la calidad del huevo.
Ácido fólico: esta vitamina B es crucial para la síntesis de ADN y la división celular, por lo que es esencial para la calidad de los óvulos y el desarrollo del embrión.
Hierro: La deficiencia de hierro puede provocar problemas ovulatorios, ya que el hierro es esencial para la producción de sangre y el transporte de oxígeno.
Grasas saludables: los ácidos grasos omega-3, presentes en el pescado, las semillas de lino y las nueces, ayudan a reducir la inflamación y favorecen la producción de hormonas. Las grasas trans, que se encuentran comúnmente en los alimentos procesados, pueden afectar negativamente la ovulación y deben evitarse.
Alto contenido de azúcar y alimentos procesados: Las dietas ricas en azúcar y alimentos procesados pueden provocar resistencia a la insulina y desequilibrios hormonales, que pueden afectar la ovulación.
Una dieta saludable y rica en nutrientes favorece los ciclos menstruales regulares, mejora la calidad de los óvulos y promueve un entorno favorable para la concepción.
2. Peso corporal y fertilidad
El peso corporal tiene un efecto significativo en la fertilidad. Tanto el sobrepeso como el bajo peso pueden provocar desequilibrios hormonales que alteran la ovulación y la regularidad menstrual:
Bajo peso: las mujeres con un índice de masa corporal (IMC) muy bajo pueden tener períodos irregulares o ausentes (amenorrea) debido a los bajos niveles de estrógeno. El estrógeno es esencial para la ovulación y para mantener un ciclo menstrual saludable, y la grasa corporal insuficiente puede afectar su producción.
Sobrepeso/Obesidad: El exceso de peso, especialmente alrededor del abdomen, está relacionado con desequilibrios hormonales y afecciones como el síndrome de ovario poliquístico (SOP), que pueden dificultar la ovulación. La obesidad puede provocar resistencia a la insulina, niveles elevados de andrógenos y reducción de la fertilidad. Los estudios sugieren que incluso una reducción de peso de 5-10% puede mejorar la ovulación y aumentar la probabilidad de concepción.
Mantener un peso saludable es una de las formas más efectivas de optimizar la fertilidad y mejorar los resultados reproductivos.
3. Actividad física
La actividad física regular favorece la salud general, la regulación hormonal y el control del peso. Sin embargo, el impacto del ejercicio en la fertilidad puede depender de su intensidad:
• Ejercicio moderado: la actividad física moderada y regular puede mejorar la fertilidad al regular el peso, reducir el estrés y mejorar el flujo sanguíneo a los órganos reproductivos. Generalmente se recomienda a las mujeres que intentan concebir.
• Ejercicio excesivo: el ejercicio intenso y de alto impacto puede provocar desequilibrios hormonales, especialmente en mujeres con bajo nivel de grasa corporal. El ejercicio excesivo puede provocar una disminución de los niveles de estrógeno, alterar los ciclos menstruales y, en casos graves, provocar amenorrea hipotalámica (ausencia de períodos debido a una producción insuficiente de hormonas).
Equilibrar los niveles de actividad física es clave para apoyar la salud reproductiva, con especial atención a rutinas de ejercicio moderadas y constantes.
4. Estrés y bienestar emocional
El estrés crónico puede afectar negativamente a la fertilidad al alterar el equilibrio hormonal y la ovulación. Los niveles altos de estrés aumentan la producción de cortisol, una hormona que puede interferir con las hormonas reproductivas como la GnRH (hormona liberadora de gonadotropina), que regula la ovulación. El estrés también se asocia con conductas de afrontamiento poco saludables, como una mala alimentación, la falta de sueño y la inactividad física, que pueden afectar aún más a la fertilidad. Además, el costo emocional del estrés puede hacer que la concepción sea más difícil e incluso puede contribuir a un ciclo de estrés e infertilidad. Las prácticas de atención plena, el asesoramiento y las técnicas de manejo del estrés como el yoga, la meditación o la terapia pueden ser beneficiosas para las mujeres que intentan concebir.
5. De fumar
Fumar es uno de los factores de estilo de vida más perjudiciales para la fertilidad. El tabaco contiene sustancias químicas tóxicas, como la nicotina, el monóxido de carbono y el alquitrán, que pueden afectar la salud reproductiva de múltiples maneras:
• Calidad de los óvulos: Fumar acelera la pérdida de óvulos y daña su calidad, lo que conduce a un mayor riesgo de anomalías cromosómicas.
• Ovulación: Las fumadoras tienen más probabilidades de experimentar problemas ovulatorios, lo que hace más difícil concebir.
• Salud uterina: fumar afecta el flujo sanguíneo al útero, creando potencialmente un ambiente desfavorable para la implantación del embrión.
• Menopausia precoz: Las mujeres que fuman suelen llegar a la menopausia entre 1 y 4 años antes que las no fumadoras, lo que reduce su ventana fértil.
Incluso la exposición al humo de segunda mano puede afectar la fertilidad. Dejar de fumar es uno de los cambios más beneficiosos que una mujer puede hacer para mejorar sus posibilidades de concebir.
6. Consumo de alcohol
El consumo excesivo de alcohol puede perjudicar la fertilidad y los resultados del embarazo:
• Ovulación y desequilibrios hormonales: el consumo excesivo de alcohol puede interferir con la producción de hormonas necesarias para la ovulación y la regularidad menstrual, aumentando el riesgo de infertilidad.
• Tasas de fertilidad reducidas: los estudios sugieren que las mujeres que consumen altos niveles de alcohol pueden experimentar tasas de fertilidad reducidas en comparación con las bebedoras moderadas o abstemias.
• Riesgos durante el embarazo: Beber alcohol puede afectar el embarazo temprano, aumentando el riesgo de aborto espontáneo y problemas de desarrollo fetal.
Si bien el consumo moderado de alcohol puede tener efectos mínimos, generalmente se recomienda abstenerse o reducir el consumo de alcohol a las mujeres que intentan concebir.
7. Consumo de cafeína
Si bien la ingesta moderada de cafeína (por ejemplo, hasta 200 mg por día, o aproximadamente un café de 12 onzas) generalmente se considera segura, el consumo de niveles altos de cafeína puede afectar negativamente la fertilidad:
• Concepción tardía: algunos estudios han demostrado que el consumo elevado de cafeína puede estar asociado con un retraso en la concepción o un mayor riesgo de aborto espontáneo.
• Absorción reducida de ciertos nutrientes: el exceso de cafeína puede interferir con la absorción de nutrientes esenciales como el calcio y el hierro, que son importantes para la salud reproductiva.
La mayoría de los profesionales de la salud recomiendan limitar el consumo de cafeína cuando se intenta concebir.
8. Toxinas ambientales y exposición a sustancias químicas
La exposición a toxinas ambientales, incluidas ciertas sustancias químicas, contaminantes y sustancias químicas que alteran el sistema endocrino, puede afectar la fertilidad:
• Alteradores endocrinos: Productos químicos como el bisfenol A (BPA), los ftalatos y los pesticidas pueden imitar o bloquear las hormonas naturales, lo que produce desequilibrios hormonales que alteran la ovulación, los ciclos menstruales y la función reproductiva general.
• Metales pesados: La exposición a metales pesados como el plomo y el mercurio puede afectar la función ovárica, reducir la calidad de los óvulos e interferir con el ciclo menstrual.
• Riesgos laborales: Las mujeres que trabajan en determinadas industrias, como la agricultura, la manufactura o los laboratorios, pueden estar expuestas a sustancias químicas y radiaciones que afectan negativamente la fertilidad.
Reducir la exposición a toxinas ambientales (por ejemplo, evitando envases de plástico con BPA, eligiendo alimentos orgánicos cuando sea posible y minimizando el uso de ciertos cosméticos) puede ayudar a favorecer la salud reproductiva.
9. Patrones de sueño y ritmo circadiano
Los malos hábitos de sueño y los patrones de sueño irregulares pueden afectar la fertilidad al alterar los niveles hormonales, en particular las hormonas reproductivas que regulan la ovulación y los ciclos menstruales:
• Melatonina y salud reproductiva: la melatonina, una hormona asociada con el sueño, también actúa como antioxidante que protege a los óvulos de sufrir daños. Las mujeres que duermen de manera insuficiente o deficiente pueden experimentar niveles reducidos de melatonina, lo que podría afectar la salud de los óvulos.
• Trabajo por turnos: Las mujeres que trabajan turnos nocturnos o tienen horarios irregulares pueden experimentar ritmos circadianos alterados, lo que puede provocar irregularidades menstruales y reducción de la fertilidad.
Mantener patrones de sueño consistentes y procurar dormir entre 7 y 8 horas por noche puede ayudar a mantener el equilibrio hormonal y la salud reproductiva.
10. Uso recreativo de drogas
El consumo de drogas recreativas, como la marihuana, la cocaína y otras sustancias, puede tener efectos nocivos sobre la fertilidad:
• Desequilibrios hormonales: Muchas drogas recreativas interfieren con las señales hormonales necesarias para la ovulación y la regularidad menstrual.
• Calidad de los óvulos y ovulación: Ciertas drogas, en particular la marihuana, se han relacionado con alteraciones en la ovulación y una menor calidad de los óvulos.
• Complicaciones del embarazo: El consumo de drogas durante la concepción o el embarazo puede provocar abortos espontáneos, defectos de nacimiento y problemas de desarrollo en el feto.
Evitar las drogas recreativas es esencial para optimizar la fertilidad y reducir los riesgos asociados al embarazo.
Centro de FIV del norte de Chipre
North Cyprus IVF Center es una clínica de fertilidad centrada en el paciente, ubicada dentro de "Hospital Quirúrgico y de Investigación Elite”En Nicosia, Chipre. Nuestra clínica es una de las clínicas de fertilidad más avanzadas del mundo y ofrece una selección más amplia de opciones de tratamiento a precios asequibles.
Contáctanos
Teléfono
Inglés: +90 548 875 8000
Francés: +90 548 876 8000
Turco: +90 542 869 8000
Arábica: +90 548 875 8000
Alemán: +90 548 830 1987
Ruso: +90 548 828 9955
Correo electrónico
info@northcyprusivf.net
© 2020 LowCostIVF - Todos los derechos reservados. política de privacidad

