- О нас
- Блог
- Бесплодие
- ЭКО лечение
- Новые достижения ЭКО
- Митохондриальная заместительная терапия!
- Лечение ЭКО на Кипре
- ВМИ
- Мини ЭКО
- ЭКО + ИКСИ
- Цитоплазматическое ЭКО
- Тандемный цикл ЭКО
- Пожертвование яйцеклеток
- Донорство эмбрионов
- Донорство спермы
- Пол – Выбор пола
- Гестационное суррогатное материнство
- Суррогатное материнство однополых геев
- Хирургическое извлечение спермы
- Преимплантационная генетическая диагностика ПГД
- Заморозка яиц
- Выбор пола с использованием донорских яйцеклеток
- Профилактика серповидноклеточной анемии
- Часто задаваемые вопросы
- Путешествовать
- О нас
- Блог
- Бесплодие
- ЭКО лечение
- Новые достижения ЭКО
- Митохондриальная заместительная терапия!
- Лечение ЭКО на Кипре
- ВМИ
- Мини ЭКО
- ЭКО + ИКСИ
- Цитоплазматическое ЭКО
- Тандемный цикл ЭКО
- Пожертвование яйцеклеток
- Донорство эмбрионов
- Донорство спермы
- Пол – Выбор пола
- Гестационное суррогатное материнство
- Суррогатное материнство однополых геев
- Хирургическое извлечение спермы
- Преимплантационная генетическая диагностика ПГД
- Заморозка яиц
- Выбор пола с использованием донорских яйцеклеток
- Профилактика серповидноклеточной анемии
- Часто задаваемые вопросы
- Путешествовать
Выкидыши
Повторные (рецидивирующие) выкидыши и варианты лечения
Потеря беременности может стать очень травмирующим опытом для пар. Исследования показывают, что более одной пятой женщин, переживающих потерю беременности, проявляют симптомы тревоги и депрессии. Когда единичная потеря беременности может иметь такие травмирующие последствия, повторная потеря беременности (ПНБ) может иметь разрушительные психологические последствия.
Повторяющийся выкидыш, также известный как повторяющаяся потеря беременности, обычно определяется как возникновение двух или более последовательных потерь беременности до 20 недель беременности. Это явление затрагивает около 1-2% женщин репродуктивного возраста и влечет за собой значительные физические и эмоциональные последствия (Комитет по практике Американского общества репродуктивной медицины, 2012). В отличие от изолированных выкидышей, которые часто приписываются случайным хромосомным аномалиям, повторные выкидыши более вероятны из-за основных патологий. Одна из первых вещей, на которые необходимо обратить внимание, — это когда у пациентки случаются выкидыши. Выкидыши, произошедшие на разных сроках беременности, могут указывать на разные факторы. Понимание этих причин помогает направлять эффективное управление и поддержку затронутых пар.
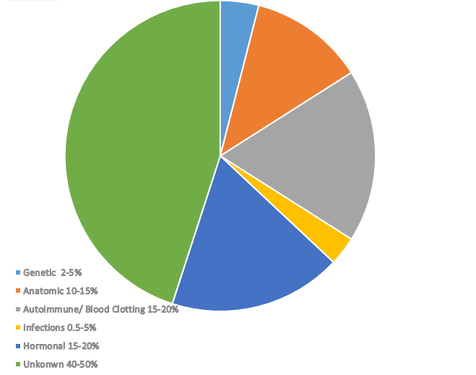
Хотя существует ряд установленных факторов, которые могут быть связаны с повторными потерями беременности, причины почти половины повторных беременностей по-прежнему остаются загадкой. В совокупности аутоиммунные факторы, гормональные проблемы и проблемы со свертываемостью крови составляют почти 70% всех известных причин. Поэтому, когда женщина переживает несколько выкидышей, отправной точкой для тестирования обычно является один из этих трех доменов.
Причины последовательных выкидышей
Известно, что следующие причины (в произвольном порядке) связаны с повторными потерями беременности:
1. Генетический фактор
Генетические причины составляют 2-5 процентов всех выкидышей. Среди генетических причин хромосомные аномалии являются ведущей генетической причиной выкидышей, на долю которых приходится около 50-60% ранних потерь беременности, происходящих по генетическим причинам. Эти аномалии включают как числовые, так и структурные хромосомные дефекты.
А. Анеуплоидия
Анеуплоидия, аномальное число хромосом, является одной из наиболее распространенных причин выкидыша. Трисомия (наличие дополнительной хромосомы) является наиболее часто наблюдаемой анеуплоидией, особенно трисомии хромосом 16, 21 и 22. Моносомия X (синдром Тернера) также распространена среди выкидышей, но редко бывает жизнеспособной после первого триместра (Hassold & Hunt, 2001). Анеуплоидии часто возникают из-за мейотического нерасхождения, процесса, при котором хромосомы не могут правильно разделиться во время деления клеток в гаметах, что приводит к эмбрионам с аномальным хромосомным составом (Nagaoka et al., 2012).
Б. Структурные хромосомные аномалии
Структурные хромосомные аномалии, включая транслокации, инверсии и делеции, также способствуют привычному невынашиванию беременности. Транслокации происходят, когда сегменты хромосом перестраиваются между негомологичными хромосомами. Сбалансированные транслокации, которые не приводят к чистому приобретению или потере генетического материала, могут не влиять на индивидуума, но могут приводить к выкидышам, если перестроенные хромосомы нарушают развитие эмбриона (Stephenson et al., 2002). Анализ кариотипа родителей часто может выявить структурные аномалии у пар с привычным невынашиванием беременности.
С. Генетические синдромы и мутации одного гена
Хотя хромосомные аномалии имеют большое значение, мутации одного гена или генетические синдромы также могут повышать риск выкидыша.
С1. Наследственные генетические синдромы
Наследственные генетические состояния, включая аутосомно-рецессивные или аутосомно-доминантные синдромы, могут способствовать потере беременности. Например, мутации в гене FOXL2, связанные с синдромом блефарофимоза-птоза-эпикантуса инверсуса, могут привести к дисфункции яичников, увеличивая риск выкидыша (Crisponi et al., 2001).
С2. Генные мутации, связанные с тромбофилией
Определенные мутации генов, вызывающие тромбофилию или повышенную свертываемость крови, связаны с выкидышами. Мутации в таких генах, как F5 (фактор V Лейдена) и F2 (протромбин), могут привести к аномальному свертыванию крови в плаценте, нарушая кровоток и в конечном итоге вызывая выкидыш (Rey et al., 2003). Хотя тромбофилия является многофакторным заболеванием, генетическая предрасположенность является фактором, способствующим некоторым повторным потерям беременности.
Д. Эпигенетические факторы и возраст родителей
Эпигенетические изменения, наследственные модификации в экспрессии генов, которые не подразумевают изменений в последовательности ДНК, также способствуют риску выкидыша. Например, ошибки метилирования ДНК могут нарушить экспрессию генов в эмбрионе, что приводит к остановке развития и выкидышу.
Д1. Возраст родителей
Более поздний возраст матери и отца связан с повышенным риском генетических аномалий, в первую очередь из-за накопления мутаций в половых клетках с течением времени. Женщины старше 35 лет подвержены более высокому риску производства ооцитов с хромосомными ошибками, что приводит к выкидышам (Hassold & Chiu, 1985). Аналогичным образом, более поздний возраст отца связан с фрагментацией ДНК в сперме, что может увеличить риск выкидыша из-за аномального развития эмбриона (Kumar et al., 2012).
Д2. Расстройства импринтинга
Нарушения импринтинга, когда определенные гены экспрессируются в специфической для родителя манере, связаны с риском выкидыша. Ошибки в импринтинге могут привести к таким расстройствам, как синдром Прадера-Вилли или синдром Ангельмана, которые могут привести к выкидышам или неблагоприятным исходам беременности (Chong & Hutchinson, 2000).
Достижения в области геномных технологий значительно улучшили понимание генетических причин выкидыша. Высокопроизводительное секвенирование, хромосомный микроматричный анализ (CMA) и предимплантационное генетическое тестирование (PGT) позволяют проводить детальный хромосомный и генетический анализ эмбрионов и родителей.
1. Хромосомный микроматричный анализ (CMA)
CMA заменил кариотипирование во многих клиниках в качестве основного теста для выявления хромосомных аномалий в тканях выкидыша. Эта технология обнаруживает субмикроскопические хромосомные дисбалансы, которые традиционное кариотипирование может пропустить, что позволяет понять причины необъяснимых выкидышей (Reddy et al., 2012).
2. Секвенирование нового поколения (NGS)
NGS облегчило выявление мутаций одного гена и небольших генетических аномалий, которые способствуют выкидышу. Это также помогло обнаружить новые гены, связанные с ранней потерей беременности, что дало дальнейшее понимание генетических причин (Xu et al., 2020). Когда у пациентов происходят многократные потери беременности, цикл ЭКО с использованием NGS-тестирования становится очень эффективным инструментом. Это делается не только при повторных выкидышах, но и является эффективным инструментом при повторных неудачах ЭКО.
2. Анатомические аномалии
Структурные аномалии в репродуктивном тракте могут нарушить имплантацию, нарушить нормальное развитие плода или привести к плацентарной недостаточности, все это может способствовать нежелательному событию выкидыша. Было подсчитано, что анатомические аномалии являются причиной до 15% всех выкидышей.
• Врожденные аномалии матки: Пороки развития матки, такие как перегородчатая, двурогая или однорогая матка, могут увеличить риск выкидыша. Перегородчатая матка, где фиброзная перегородка разделяет полость матки, особенно связана с высоким уровнем выкидышей. Перегородка может не поддерживать адекватный приток крови к имплантированному эмбриону, что приводит к плацентарной недостаточности и потере беременности (Grimbizis et al., 2001). Было показано, что хирургическая коррекция перегородки улучшает исходы беременности.
• Приобретенные аномалии матки: Такие состояния, как фибромиомы (особенно подслизистые фибромиомы, которые деформируют полость матки) и внутриматочные спайки (рубцы внутри матки, часто являющиеся результатом предыдущих операций или инфекций) могут мешать имплантации или развитию плода. Эти структуры могут деформировать форму полости матки, уменьшать пространство и ограничивать приток крови к развивающемуся эмбриону, тем самым увеличивая риск выкидыша (Saravelos et al., 2008).
3. Эндокринные нарушения (гормональные проблемы)
Эндокринные нарушения являются хорошо документированными факторами, способствующими повторной потере беременности, в первую очередь из-за их влияния на гормональный баланс и восприимчивость матки. Известно, что гормональные проблемы играют роль в 15-20% повторных выкидышей.
• Синдром поликистозных яичников (СПКЯ): СПКЯ — распространенное эндокринное расстройство, характеризующееся нерегулярной овуляцией, гиперандрогенией и резистентностью к инсулину. Повышенный уровень инсулина у женщин с СПКЯ может привести к плохому развитию эндометрия и может способствовать ранней потере беременности (Boomsma et al., 2006). Кроме того, гормональный дисбаланс, связанный с СПКЯ, может нарушить лютеиновую фазу (период после овуляции, когда эндометрий готовится к имплантации эмбриона), что может привести к неадекватной среде матки для имплантации.
• Дефект лютеиновой фазы: Лютеиновая фаза, регулируемая прогестероном, вырабатываемым желтым телом после овуляции, имеет решающее значение для поддержания оптимальной эндометриальной среды для имплантации и ранней поддержки эмбриона. Дефицит продукции прогестерона, известный как дефект лютеиновой фазы, может привести к недостаточной подготовке эндометрия, что затрудняет имплантацию и увеличивает риск выкидыша.
• Заболевания щитовидной железы: Функция щитовидной железы играет важную роль в поддержании беременности. Гипотиреоз (недостаточная активность щитовидной железы) может привести к недостаточной выработке гормонов щитовидной железы, которые необходимы для развития плода, особенно в первом триместре, когда плод зависит от гормонов щитовидной железы матери. Даже у женщин с эутиреозом (нормальная функция щитовидной железы) наличие аутоантител к щитовидной железе, в частности антител к тиреопероксидазе (ТПО), связано с 2-3-кратным увеличением риска выкидыша (Thangaratinam et al., 2011). Эти антитела могут влиять на иммунную систему матери, нарушая среду матки.
4. Иммунологические факторы
Иммунная система должна адаптироваться для поддержки беременности, поскольку плод генетически отличается от матери. Нарушения в этой адаптации могут привести к выкидышу.
• Антифосфолипидный синдром (АФС): АФС — это аутоиммунное состояние, характеризующееся наличием антифосфолипидных антител, таких как волчаночный антикоагулянт и антикардиолипиновые антитела. Эти антитела повышают риск образования тромбов в кровеносных сосудах, в том числе в плаценте. Плацентарные тромбы снижают подачу кислорода и питательных веществ плоду, что приводит к выкидышу. АФС — это хорошо документированная причина повторной потери беременности, и его лечение обычно включает антикоагуляционную терапию (Rai et al., 2005).
• Аномалии естественных клеток-киллеров (NK): NK-клетки играют роль на ранних сроках беременности, помогая развитию плаценты. Предполагается, что повышенные уровни NK-клеток или аномальная функция NK-клеток способствуют повторному выкидышу, поскольку сверхактивные NK-клетки могут атаковать плацентарные клетки. Однако точная роль NK-клеток в выкидыше все еще обсуждается, и существуют противоречивые данные о том, улучшает ли модуляция NK-клеток исход беременности (Quenby et al., 2009).
5. Тромбофилические нарушения
Наследственные тромбофилии — это генетические заболевания, которые предрасполагают человека к нарушению свертываемости крови, что может иметь неблагоприятные последствия во время беременности.
• Фактор V Лейденская мутация: Эта мутация приводит к резистентности к активированному протеину C, важному антикоагулянту, что приводит к гиперкоагуляционному состоянию. Во время беременности эта мутация может привести к тромбозу плаценты (образованию сгустков в плаценте), что ухудшает снабжение плода кислородом и питательными веществами, что может вызвать выкидыш, особенно во втором триместре (Preston et al., 2002).
• Мутация гена протромбина: Эта мутация также способствует гиперкоагуляционному состоянию, увеличивая риск образования плацентарных тромбов. Женщины с этой мутацией имеют более высокий риск выкидыша, особенно на поздних сроках беременности.
• Дефицит протеинов C и S: Протеины C и S являются естественными антикоагулянтами. Дефицит этих белков приводит к повышенному образованию сгустков, что может нарушить функцию плаценты. Однако связь между тромбофилиями и ранними выкидышами остается спорной, и некоторые исследования предполагают, что они больше связаны с осложнениями поздней беременности (Lockwood, 2002).
6. Образ жизни и факторы окружающей среды
На исход беременности могут влиять несколько изменяемых факторов образа жизни.
• курение: Никотин и другие токсины в сигаретном дыме ухудшают кровоток в матке, создавая гипоксическую (низкокислородную) среду, которая может нарушить развитие эмбриона и увеличить риск выкидыша. Курение связано с более высоким риском хромосомных аномалий у эмбриона, возможно, из-за окислительного стресса от табака (Green et al., 2007).
• Употребление алкоголя и кофеина: Чрезмерное употребление алкоголя связано с фетальной токсичностью, которая может способствовать выкидышу. Высокое потребление кофеина (обычно более 200-300 мг в день) связано с повышенным риском выкидыша, возможно, из-за его воздействия на сердечно-сосудистую и гормональную системы, которые поддерживают беременность (Ford & Schust, 2009).
• Ожирение: Ожирение связано с более высоким риском выкидыша из-за гормонального дисбаланса, повышенной резистентности к инсулину и хронического слабовыраженного воспаления. Ожирение также может ухудшить восприимчивость эндометрия, что имеет решающее значение для успешной имплантации и сохранения беременности (Metwally et al., 2008).
7. Инфекции
Некоторые инфекции могут увеличить риск выкидыша, вызывая воспалительные реакции, которые повреждают ткани плода или нарушают взаимодействие матери и плода. Хотя инфекционные причины часто приводят к потере беременности во время активной фазы, некоторые инфекции могут вызывать хронические проблемы, которые могут быть фактором повторных выкидышей:
• Хламидия трахоматис и уреаплазма уреалитикум: Эти бактерии могут вызывать хронический эндометрит, воспаление слизистой оболочки матки, которое может нарушить имплантацию или нарушить функцию плаценты, что приведет к выкидышу. Хроническая инфекция этими бактериями связана с неблагоприятными исходами беременности, хотя доказательства, связывающие их конкретно с повторным выкидышем, неоднозначны (Baud et al., 2008).
• Цитомегаловирус (ЦМВ): ЦМВ — это вирус герпеса, который может передаваться плоду, если мать инфицирована во время беременности. Инфекция ЦМВ плода может привести к аномалиям развития и повысить риск выкидыша, особенно если заражение происходит на ранних сроках беременности. Это, вероятно, будет проблемой в активной фазе инфекции.
8. Необъяснимые причины
Примерно половина всех повторных выкидышей остаются необъяснимыми, несмотря на тщательную оценку. Необъяснимые повторные выкидыши могут включать в себя тонкие отклонения в иммунной, генетической или гормональной функции, которые не могут обнаружить современные диагностические тесты. Кроме того, во многих случаях вероятны многофакторные причины, когда незначительные отклонения в нескольких системах в совокупности способствуют потере беременности (Coomarasamy et al., 2014). В некоторых случаях, даже если причина неизвестна, можно предпринять определенные профилактические меры, и мы наблюдаем положительные результаты этих мер, что показывает, что даже если определенные проблемы могут не проявляться в лабораторных анализах, они все равно могут реагировать на антикоагуляцию, кортикостероиды, антибиотики и другие профилактические меры.
Рекомендации
• Бод, Д., Реган, Л. и Грюб, Г. (2008). Новая роль хламидий и хламидийподобных организмов в неблагоприятных исходах беременности. Текущее мнение об инфекционных заболеваниях, 21(1), 70-76.
• Boomsma, CM, Fauser, BC, & Macklon, NS (2006). Осложнения беременности у женщин с синдромом поликистозных яичников. Семинары по репродуктивной медицине, 24(1), 35-43.
• Чонг, С. и Хатчинсон, В. (2000). Роль геномного импринтинга в развитии и болезнях. The Lancet, 355(9197), 2117–2122.
• Кумарасами, А. и др. (2014). Исследование PROMISE: влияние прогестерона на повторные выкидыши. Оценка технологий здравоохранения, 18(40), 1-70.
• Криспони, Л., Дейана, М., Лой, А. и др. (2001). Предполагаемый фактор транскрипции forkhead FOXL2 мутирует при блефарофимозе/птозе/синдроме обратного эпикантуса. Nature Genetics, 27(2), 159–166.
• Форд, Х. Б. и Шуст, Д. Дж. (2009). Повторная потеря беременности: этиология, диагностика и терапия. Обзоры по акушерству и гинекологии, 2(2), 76-83.
• Гримбизис, ГФ и др. (2001). Пороки развития матки и результаты гистероскопического лечения. Human Reproduction Update, 7(2), 161-174.
• Грин, КА и др. (2007). Курение и выкидыш: систематический обзор. Tobacco Control, 16(2), 120-124.
• Хассолд, Т. и др. (2007). Происхождение человеческой анеуплоидии. Молекулярная генетика человека, 16(R2), R203-R208.
• Кумар, Н., Сингх, АК, и Ядав, П. (2012). Мужское бесплодие: обзор генетических аспектов. Журнал последипломной медицины, 58(3), 243–249.
• Локвуд, К.Дж. (2002). Механизмы эндометриального кровотечения. Менопауза, 9(6), 411-417.
• Метвалли, М. и др. (2008). Влияние ожирения на женскую репродуктивную функцию. Obesity Reviews, 9(5), 456-468.
• Нагаока, СИ, Хассолд, ТДж, и Хант, ПА (2012). Анеуплоидия у человека: механизмы и новый взгляд на извечную проблему. Nature Reviews Genetics, 13(7), 493–504.
• Практический комитет Американского общества репродуктивной медицины. (2012). Определения бесплодия и повторной потери беременности. Фертильность и бесплодие, 98(3), 1-2.
• Престон, Ф. Э. и др. (2002). Увеличение потери плода у женщин с тромбофилией. The Lancet, 356(9225), 270-273.
• Куэнби, С. и др. (2009). Лейкоциты эндометрия до имплантации у женщин с привычным невынашиванием беременности. Репродукция человека, 14(8), 2386-2391.
• Рай, Р. и др. (2005). Антифосфолипидные антитела при привычном выкидыше. Репродукция человека, 10(7), 1818-1823.
• Редди, UM, Пейдж, GP, и Сааде, GR (2012). Роль ДНК-микрочипов в оценке смерти плода. Американский журнал акушерства и гинекологии, 207(4), 279–288.
• Рей, Э., Кан, С. Р., Дэвид, М. и Шриер, И. (2003). Тромбофилические расстройства и потеря плода: метаанализ. Lancet, 361(9361), 901–908.
• Саравелос, С. Х. и др. (2008). Модель потери беременности при аномалиях матки. Reproductive BioMedicine Online, 17(1), 134-138.
• Стивенсон, МД, Авартани, КА, и Робинсон, ВП (2002). Цитогенетический анализ выкидышей у пар с повторными выкидышами: исследование случай-контроль. Репродукция человека, 17(2), 446–451.
• Тангаратинам, С. и др. (2011). Аутоантитела к щитовидной железе и риск выкидыша. British Medical Journal, 342, d2616.
• Сюй, И., Ли, Л., Чжан, Х. и др. (2020). Клиническое применение секвенирования всего экзома при привычной потере беременности. Журнал клинической медицины, 9(4), 1156.
Центр ЭКО на Северном Кипре
Центр ЭКО на Северном Кипре - это клиника по лечению бесплодия, ориентированная на пациентов, расположенная в «Элитный исследовательский и хирургический госпиталь» в Никосии, Кипр. Наша клиника является одной из самых передовых клиник по лечению бесплодия в мире, предлагающей более широкий выбор вариантов лечения по доступным ценам.
Главная
Телефон
Английский: +90 548 875 8000
Французский: +90 548 876 8000
Турецкий: +90 542 869 8000
Арабский: +90 548 875 8000
Немецкий: +90 548 830 1987
Русский: +90 548 828 9955
Электронная почта
info@northcyprusivf.net
© 2020 LowCostIVF - Все права защищены. политика конфиденциальности