- Di
- Blog
- Infertilità
- Trattamenti di fecondazione in vitro
- Nuovi progressi della fecondazione in vitro
- Trattamento di fecondazione in vitro a Cipro
- FIVET per donne oltre i 40 anni
- FIVET per donne over 50
- IUI
- Mini fecondazione in vitro
- FIVET + ICSI
- FIV citoplasmatica
- Ciclo tandem di fecondazione in vitro
- Donazione di ovuli
- Donazione di embrioni
- Donazione di sperma
- Genere – Selezione del sesso
- Maternità gestazionale
- Surrogazione gay dello stesso sesso
- Recupero chirurgico dello sperma
- Diagnosi genetica preimpianto PGD
- Congelamento delle uova
- Selezione di genere utilizzando ovociti donati
- Prevenzione dell'anemia falciforme
- FAQ
- Viaggio
- Di
- Blog
- Infertilità
- Trattamenti di fecondazione in vitro
- Nuovi progressi della fecondazione in vitro
- Trattamento di fecondazione in vitro a Cipro
- FIVET per donne oltre i 40 anni
- FIVET per donne over 50
- IUI
- Mini fecondazione in vitro
- FIVET + ICSI
- FIV citoplasmatica
- Ciclo tandem di fecondazione in vitro
- Donazione di ovuli
- Donazione di embrioni
- Donazione di sperma
- Genere – Selezione del sesso
- Maternità gestazionale
- Surrogazione gay dello stesso sesso
- Recupero chirurgico dello sperma
- Diagnosi genetica preimpianto PGD
- Congelamento delle uova
- Selezione di genere utilizzando ovociti donati
- Prevenzione dell'anemia falciforme
- FAQ
- Viaggio
FIVET per donne oltre i 40 anni
Fecondazione in vitro per donne over 40: percorsi realistici ma pieni di speranza
Comprendere il paesaggio:
Con l'avanzare dell'età, in particolare oltre i 40 anni, si osserva un netto calo della fertilità. Ciò è dovuto principalmente al fatto che le donne nascono con un numero finito di follicoli, e sia la quantità che la qualità diminuiscono nel tempo a causa dello stress ossidativo cumulativo, della disfunzione mitocondriale e degli errori meiotici (te Velde e Pearson, 2002).
Secondo ampi dati di registro, i tassi di natalità con ovociti non donati scendono da circa 26% tra i 38 e i 40 anni a circa 13% tra i 41 e i 42 anni, e a meno di 5% oltre i 42 anni (SART, 2023). Il diagramma seguente mostra una stima approssimativa delle riserve ovariche medie di una donna durante i suoi anni riproduttivi:
Figura 1: Età e riserva ovarica femminile
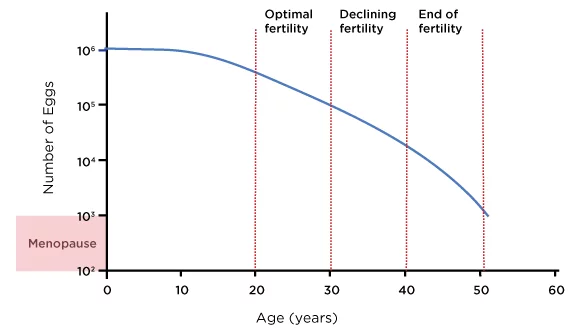
Fonte: Ozyigit, A. e Ozyigit, S., 2018. The IVF Guide: tutto ciò che devi sapere su fertilità, infertilità e opzioni di trattamento disponibili. 1a ed. Irvine, CA: Universal Publishers, figura 1.
Detto questo, la riserva ovarica e la risposta ovarica variano da individuo a individuo e alcune donne mantengono un potenziale riproduttivo più elevato fino ai quarant'anni. Questo rende essenziale una valutazione personalizzata tramite la conta dei follicoli antrali (AFC), il test dell'ormone antimulleriano (AMH) e i risultati dei precedenti cicli di fecondazione in vitro per selezionare la strategia più appropriata (Broer et al., 2014).
Conservazione degli ovociti o degli embrioni: costruire la propria “rete di sicurezza”
Un approccio pratico per migliorare i tassi di successo cumulativo è la conservazione degli ovociti o degli embrioni. Sottoponendosi a molteplici cicli di stimolazione e prelievo, è possibile accumulare un numero maggiore di ovociti (o embrioni), aumentando così la probabilità di una gravidanza di successo. È stato dimostrato che la vitrificazione degli ovociti produce tassi di sopravvivenza e fecondazione paragonabili a quelli degli ovociti freschi (Cobo et al., 2016) senza un aumento del rischio di anomalie congenite (Noyes et al., 2009). Pertanto, i prelievi multipli di ovociti possono offrire numeri che non sono possibili con una singola procedura di prelievo ovocitario.
Sebbene i tassi di gravidanza e di nati vivi per le donne di età pari o superiore a 40 anni in un singolo ciclo di trattamento siano relativamente modesti, è importante ricordare che questi dati sono calcolati per ciclo. Quando si eseguono più cicli e si combinano i risultati, la probabilità complessiva di ottenere una gravidanza e un nato vivo può aumentare considerevolmente. Questo approccio offre anche l'opportunità di eseguire test genetici preimpianto per aneuploidie (PGT-A), che possono aiutare a identificare gli embrioni con un corredo cromosomico normale e migliorare ulteriormente le possibilità di successo (Doyle et al., 2016).
La conservazione degli ovociti può essere ancora più efficace se abbinata ad altri progressi moderni nella medicina riproduttiva che hanno il potenziale per migliorare i risultati del ciclo. Tra questi: trattamento PRP ovarico e una moderna innovazione tecnologica nota come Terapia sostitutiva mitocondriale (MRT). L'integrazione di tali approcci con la conservazione degli ovociti può migliorare la qualità e il potenziale di sviluppo degli ovociti raccolti, aumentando così il numero di embrioni vitali disponibili per il trasferimento. Se utilizzati strategicamente, questi metodi possono integrare i benefici della conservazione non solo ampliando il pool di ovociti conservati, ma anche ottimizzandone il potenziale riproduttivo, offrendo in definitiva maggiori possibilità di ottenere una gravidanza di successo.
Plasma ricco di piastrine ovariche (PRP)
Il PRP ovarico prevede l'iniezione di concentrato piastrinico autologo nelle ovaie, con l'obiettivo di stimolare fattori di crescita locali che possono migliorare il reclutamento follicolare. Studi su pazienti con scarsa risposta, comprese donne in età riproduttiva avanzata, hanno riportato miglioramenti in termini di AMH, AFC e qualità delle blastocisti, con il raggiungimento di alcuni nati vivi (Sfakianoudis et al., 2019). Uno studio recente ha dimostrato aumenti significativi nella resa di blastocisti utilizzabili dopo PRP in donne con precedenti embrioni di scarsa qualità (Yu et al., 2025). Sebbene non sia ancora considerato lo standard di cura, il PRP è un valido supporto per pazienti selezionate che desiderano ottimizzare il proprio potenziale ovocitario.
La terapia ovarica con PRP è una procedura molto più sofisticata della semplice iniezione di plasma ricco di piastrine nelle ovaie e della speranza di un miglioramento. Il suo successo dipende da protocolli attentamente progettati che iniziano con un'adeguata preparazione piastrinica, inclusa l'inattivazione controllata per prevenire l'attivazione prematura e la deplezione dei fattori di crescita prima di raggiungere il tessuto bersaglio. La concentrazione e la densità delle piastrine devono essere ottimizzate per garantire una dose terapeuticamente significativa, poiché preparazioni subottimali o eccessivamente diluite potrebbero non fornire lo stimolo rigenerativo desiderato. Altrettanto fondamentale è la precisione dell'iniezione, mirata a specifiche regioni anatomiche all'interno dell'ovaio, dove lo sviluppo follicolare ha maggiori probabilità di beneficiare di una migliore vascolarizzazione, della segnalazione cellulare e del supporto microambientale. Dopo la procedura, un regime di integrazione personalizzato è essenziale per sostenere e supportare il processo di ovogenesi, garantendo che l'ambiente biochimico e ormonale sia favorevole al reclutamento, alla crescita e alla maturazione follicolare. Insieme, questi fattori trasformano la terapia PRP da una semplice iniezione in un intervento scientificamente fondato e potenzialmente trasformativo per la funzione ovarica.
Terapia sostitutiva mitocondriale (MRT)
La terapia sostitutiva mitocondriale (MRT) è una tecnica riproduttiva emergente volta a ripristinare la capacità bioenergetica degli ovociti integrandoli con mitocondri sani di donatori. Questo approccio affronta direttamente uno dei più significativi cambiamenti legati all'età nella riproduzione femminile: il progressivo declino della funzione mitocondriale, che è stato fortemente associato a una ridotta competenza ovocitaria e a un alterato sviluppo embrionale (St. John et al., 2019).
Introducendo mitocondri funzionali nell'ovocita, la MRT mira a migliorare la produzione di ATP, ottimizzare l'ambiente cellulare per la divisione meiotica e potenziare il potenziale di sviluppo degli embrioni risultanti. Sebbene la sua applicazione clinica sia relativamente nuova, e il North Cyprus IVF Center sia tra le pochissime strutture cliniche che offrono questo servizio, i primi studi sull'uomo e preclinici hanno dimostrato risultati incoraggianti, in particolare in pazienti con una storia di arresto ricorrente dello sviluppo embrionale o scarsa qualità embrionale (Zhang et al., 2017).
Il dott. Shoukhrat Mitalipov e i suoi colleghi sono stati in prima linea nella ricerca sulla MRT, dimostrando sia nei modelli animali che negli ovociti umani che il trasferimento di mitocondri sani può correggere carenze bioenergetiche e portare a risultati migliori in termini di fecondazione e sviluppo embrionale, supportando la logica del suo utilizzo mirato nei casi di insufficienza mitocondriale correlata all'età o a malattie (Kang et al., 2016).
Combinazione di strategie: conservazione degli ovociti, trattamento con PRP ovarico e MRT
Per alcune pazienti, in particolare quelle con una storia di cicli falliti a causa di uno scarso sviluppo embrionale, una strategia completa che combina la conservazione degli ovociti, il PRP ovarico e la terapia sostitutiva mitocondriale può offrire il massimo potenziale per migliorare i risultati. Questo approccio multiforme agisce sull'invecchiamento degli ovociti da diverse direzioni. La conservazione degli ovociti consente di ottenere ovociti soprannumerari, cosa che non sarebbe possibile con un singolo prelievo ovocitario in un ciclo di fecondazione in vitro. Il PRP ovarico mira a migliorare l'ambiente follicolare e a promuovere un reclutamento follicolare più sano con un ciclo di prelievo ovocitario, mentre la terapia sostitutiva mitocondriale agisce per ripristinare la bioenergetica ovocitaria ottimale e migliorare il potenziale di sviluppo embrionale. Insieme, questi interventi agiscono sia sulla produzione di energia cellulare che sul microambiente ovarico, due determinanti critici del successo riproduttivo nell'infertilità legata all'età (Labarta et al., 2019).
****
Queste strategie sono progettate per aumentare la probabilità di ottenere una gravidanza utilizzando il materiale genetico della donna, consentendo così di avere un figlio biologico. Sebbene tali interventi possano aumentare sostanzialmente le probabilità di successo rispetto a un ciclo di fecondazione in vitro standard, possono comunque comportare un costo finanziario significativo e non possono garantire un'elevata probabilità di successo, in particolare in caso di età materna avanzata o ridotta riserva ovarica. Per le coppie o le persone che non desiderano prendere in considerazione l'ovodonazione, questi approcci possono comunque offrire un miglioramento significativo delle probabilità di avere un figlio biologico. Tuttavia, se l'obiettivo primario è ottenere una gravidanza e dare il benvenuto a un bambino, indipendentemente dall'esistenza di un legame genetico con la madre desiderata, opzioni alternative come un ciclo di fecondazione in vitro in tandem o l'uso diretto di ovociti di una donatrice possono offrire tassi di successo sostanzialmente più elevati, soprattutto per le donne di età superiore ai 40 anni.
Ciclo tandem di fecondazione in vitro
Un ciclo di fecondazione in vitro in tandem è un approccio terapeutico in cui una paziente si sottopone a stimolazione ovarica per produrre i propri ovuli e, contemporaneamente, utilizza ovuli di una donatrice nello stesso ciclo di trattamento. Entrambi i gruppi di ovuli vengono fecondati separatamente e gli embrioni vengono creati da ciascuna fonte. Ciò consente agli aspiranti genitori di tentare il concepimento con il materiale genetico della paziente, disponendo al contempo di embrioni di donatrice di alta qualità disponibili nello stesso ciclo. Gli embrioni provenienti da entrambe le fonti possono essere coltivati fino allo stadio di blastocisti, sottoposti a test genetici, se desiderato, e conservati per un uso futuro. Questo approccio offre il vantaggio unico di massimizzare le possibilità di un esito positivo in un singolo ciclo di trattamento, preservando al contempo la possibilità di una connessione biologica con la madre aspirante.
Fecondazione in vitro di uova di donatore
Fecondazione in vitro di uova di donatore La fecondazione in vitro con ovociti di una donatrice sana e selezionata prevede l'utilizzo di ovociti provenienti da una donatrice sana e selezionata, che vengono fecondati con lo sperma del padre o con lo sperma di un donatore. Poiché la qualità degli ovociti dipende in larga misura dall'età e dalla salute riproduttiva della donatrice piuttosto che dalla madre, questo approccio aumenta significativamente la probabilità di produrre embrioni di alta qualità e di ottenere una gravidanza di successo. La fecondazione in vitro con ovociti di donatrice è particolarmente preziosa per le donne in età riproduttiva avanzata, quelle con una riserva ovarica gravemente ridotta o quelle i cui precedenti cicli di fecondazione in vitro con i propri ovociti sono falliti. Il bambino che nascerà condividerà una connessione genetica con la fonte di sperma ma non con la ricevente, sebbene l'esperienza della gravidanza e il legame materno-fetale rimangano completamente intatti.
Percorsi pratici per le donne over 40
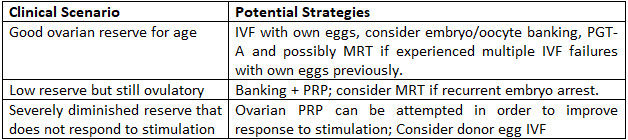
Punti chiave
- – Il successo con i propri ovuli dopo i 40 anni è possibile ma impegnativo; è importante avere aspettative realistiche.
- – La conservazione degli ovociti/embrioni può migliorare le possibilità cumulative e consentire lo screening genetico.
- – La MRT e il PRP sono terapie complementari promettenti per casi selezionati.
- – Gli ovuli donati offrono i tassi di successo più elevati e dovrebbero essere discussi tempestivamente se la prognosi è sfavorevole.
- Per favore Contattaci per maggiori informazioni e consigli personalizzati.
Riferimenti
- Broer, SL, Broekmans, FJ, Laven, JS e Fauser, BC, 2014. Ormone antimulleriano: test di riserva ovarica e potenziali implicazioni cliniche. Human Reproduction Update, 20(5), pp.688–701.
- Cobo, A., García-Velasco, J., Coello, A., Domingo, J., Pellicer, A. e Remohí, J., 2016. La vitrificazione degli ovociti come opzione efficiente per la preservazione elettiva della fertilità. Fertility and Sterility, 105(3), pp.755–764.
- Devroey, P., Fauser, BC e Diedrich, K., 2011. Approcci per migliorare la diagnosi e la gestione dell'infertilità. Human Reproduction Update, 17(5), pp.455–467.
- Doyle, JO, Richter, KS, Lim, J., Stillman, RJ, Graham, JR e Tucker, MJ, 2016. Vitrificazione e riscaldamento degli ovociti elettivi e medicalmente indicati per la fecondazione autologa in vitro, con probabilità di nascita previste per la preservazione della fertilità in base al numero di ovociti crioconservati e all'età al momento del prelievo. Fertilità e sterilità, 105(2), pp.459–466.
- Labarta, E., de los Santos, MJ, Escribá, MJ, Pellicer, A. e Herraiz, S., 2019. Mitocondri come strumento per il ringiovanimento degli ovociti. Fertilità e sterilità, 111(2), pp.219–226.
- Noyes, N., Porcu, E. e Borini, A., 2009. Oltre 900 bambini nati tramite crioconservazione degli ovociti senza apparente aumento delle anomalie congenite. Reproductive BioMedicine Online, 18(6), pp.769–776.
- Paulson, RJ, Hatch, IE, Lobo, RA e Sauer, MV, 2002. Percentuali cumulative di successo della gravidanza dopo donazione di ovociti: implicazioni riguardanti la ricettività endometriale. Riproduzione umana, 17(5), pp.1411–1416.
- Sauer, MV, 1990. Un rapporto preliminare sulla donazione di ovociti che estende il potenziale riproduttivo alle donne di età superiore ai 40 anni. New England Journal of Medicine, 323(17), pp.1157–1160.
- Sfakianoudis, K., Simopoulou, M., Nitsos, N., et al., 2019. Il trattamento con plasma ricco di piastrine autologo consente la gravidanza in una donna in menopausa precoce. Case Reports in Women's Health, 23, e00129.
- Sills, ES, Rickers, NS, Li, X. e Palermo, GD, 2020. Primi dati sulla fecondazione in vitro dopo iniezione intraovarica di plasma ricco di piastrine autologo attivato con gluconato di calcio. Gynecological Endocrinology, 36(6), pp.479–482.
- St. John, JC, Facucho-Oliveira, J., Jiang, Y., Kelly, R. e Salah, R., 2019. Trasmissione, replicazione ed ereditarietà del DNA mitocondriale: un viaggio dal gamete attraverso l'embrione fino alla prole e alle cellule staminali embrionali. Human Reproduction Update, 26(1), pp.1–35.
- Yu, TN, Wang, HY, Lee, TH, et al., 2025. L'iniezione intraovarica di plasma ricco di piastrine migliora significativamente la resa di blastocisti nelle pazienti sottoposte a fecondazione in vitro con precedente scarsa qualità embrionale. Scientific Reports, 15, 81234.
- Zhang, J., Liu, H., Luo, S., et al., 2017. Nascite vive derivate dal trasferimento del fuso ovocitario per prevenire le malattie mitocondriali. Reproductive BioMedicine Online, 34(4), pp.361–368.
Centro FIVET di Cipro del Nord
North Cyprus IVF Center è una clinica per la fertilità incentrata sul paziente, situata all'interno di "Elite Research and Surgical Hospital” a Nicosia, Cipro. La nostra clinica è una delle cliniche per la fertilità più avanzate al mondo e offre una più ampia scelta di opzioni di trattamento a prezzi convenienti.
Contattaci
Telefono
Inglese: +90 548 875 8000
Francese: +90 548 876 8000
Turco: +90 542 869 8000
Arabo: +90 548 875 8000
Tedesco: +90 548 830 1987
Russo: +90 548 828 9955
info@northcyprusivf.net
© 2020 LowCostIVF - Tutti i diritti riservati. politica sulla riservatezza


