- Di
- Blog
- Infertilità
- Trattamenti di fecondazione in vitro
- Nuovi progressi della fecondazione in vitro
- Terapia sostitutiva mitocondriale!
- Trattamento di fecondazione in vitro a Cipro
- FIVET per donne oltre i 40 anni
- FIVET per donne over 50
- IUI
- Mini fecondazione in vitro
- FIVET + ICSI
- FIV citoplasmatica
- Ciclo tandem di fecondazione in vitro
- Donazione di ovuli
- Donazione di embrioni
- Donazione di sperma
- Genere – Selezione del sesso
- Maternità gestazionale
- Surrogazione gay dello stesso sesso
- Recupero chirurgico dello sperma
- Diagnosi genetica preimpianto PGD
- Congelamento delle uova
- Selezione di genere utilizzando ovociti donati
- Prevenzione dell'anemia falciforme
- FAQ
- Viaggio
- Di
- Blog
- Infertilità
- Trattamenti di fecondazione in vitro
- Nuovi progressi della fecondazione in vitro
- Terapia sostitutiva mitocondriale!
- Trattamento di fecondazione in vitro a Cipro
- FIVET per donne oltre i 40 anni
- FIVET per donne over 50
- IUI
- Mini fecondazione in vitro
- FIVET + ICSI
- FIV citoplasmatica
- Ciclo tandem di fecondazione in vitro
- Donazione di ovuli
- Donazione di embrioni
- Donazione di sperma
- Genere – Selezione del sesso
- Maternità gestazionale
- Surrogazione gay dello stesso sesso
- Recupero chirurgico dello sperma
- Diagnosi genetica preimpianto PGD
- Congelamento delle uova
- Selezione di genere utilizzando ovociti donati
- Prevenzione dell'anemia falciforme
- FAQ
- Viaggio
Terapia sostitutiva mitocondriale
Una nuova tecnica medica rivoluzionaria
Terapia sostitutiva mitocondriale (MRT) presso il Centro di fecondazione in vitro di Cipro del Nord
In collaborazione con il Dott. Shoukhrat Mitalipov – Pioniere del futuro della fertilità
Presso il North Cyprus IVF Center, siamo orgogliosi di collaborare con il Dott. Shoukhrat Mitalipov, uno dei massimi esperti mondiali di genetica riproduttiva e biologia mitocondriale. Il Dott. Mitalipov è riconosciuto a livello internazionale per aver sviluppato la Terapia di Sostituzione Mitocondriale (TRM), una tecnica all'avanguardia originariamente progettata per prevenire la trasmissione delle malattie mitocondriali, che ora offre una nuova speranza alle donne con infertilità legata all'età e insuccessi ricorrenti della fecondazione in vitro.
Questa partnership ci consente di offrire la MRT come trattamento specializzato per la fertilità al di fuori di un contesto di sperimentazione clinica, combinando la competenza del team del Dott. Mitalipov con l'esperienza clinica del Dott. Savas Ozyigit, del Dott. Ahmet Ozyigit e del team di embriologia del North Cyprus IVF Center, situato presso l'Elite Hospital.
Cosa sono i mitocondri?
I mitocondri sono organelli che producono energia presenti in quasi tutte le cellule del corpo, compresi gli ovociti (cellule uovo). Con l'invecchiamento, il numero e la funzione dei mitocondri diminuiscono, compromettendo la capacità dell'ovocita di supportare la normale fecondazione, lo sviluppo embrionale e l'impianto. Questo declino è uno dei principali fattori che contribuiscono all'infertilità legata all'età.
TIl ruolo dei mitocondri nella salute cellulare e riproduttiva
I mitocondri sono organelli a doppia membrana, meglio conosciuti come le "centrali energetiche" della cellula perché producono adenosina trifosfato (ATP), la principale valuta energetica utilizzata per alimentare quasi tutti i processi cellulari. Tuttavia, i mitocondri svolgono anche ruoli cruciali in:
• Regolazione dell'apoptosi (morte cellulare programmata)
• Omeostasi del calcio
• Gestione delle specie reattive dell'ossigeno (ROS)
• Steroidogenesi e segnalazione cellulare
• Maturazione dell'oocita, formazione del fuso e sviluppo embrionale precoce
Negli ovociti umani, ogni cellula contiene tra 100.000 e 600.000 mitocondri, molti di più rispetto alle tipiche cellule somatiche, il che sottolinea il loro ruolo centrale nella competenza riproduttiva (May-Panloup et al., 2005).
Con l'avanzare dell'età nelle donne, in particolare dopo i 35 anni, la funzione mitocondriale degli ovociti subisce un progressivo deterioramento:
1. Numero di copie di mtDNA ridotto
I mitocondri degli ovociti dipendono da un numero sufficiente di copie di DNA mitocondriale (mtDNA) per mantenere la produzione di ATP durante la maturazione e la fecondazione. Studi dimostrano una significativa riduzione del numero di copie di mtDNA con l'età, compromettendo la disponibilità di energia necessaria per la normale formazione del fuso e la segregazione cromosomica (Fragouli et al., 2015).
2. Aumento delle mutazioni del DNA mitocondriale
Il mtDNA è privo di istoni protettivi e ha meccanismi di riparazione limitati, il che lo rende altamente suscettibile al danno ossidativo. Con l'età, l'esposizione cumulativa ai ROS porta a un aumento delle mutazioni del mtDNA, che compromettono la respirazione mitocondriale e aggravano ulteriormente lo stress ossidativo (Barritt et al., 2002; Wallace, 2013).
3. Produzione di ATP compromessa
I mitocondri invecchiati generano meno ATP attraverso la fosforilazione ossidativa, con conseguente carenza di energia negli ovociti che hanno difficoltà a completare la divisione meiotica o a supportare l'embriogenesi precoce (Bentov & Casper, 2013).
4. Potenziale di membrana alterato e frammentazione
I mitocondri invecchiati presentano perdita di potenziale di membrana, aumentata frammentazione e morfologia alterata, con conseguente compromissione del metabolismo cellulare e suscettibilità all'apoptosi (Wilding et al., 2001).
5. Associazione con aneuploidia e scarsa qualità embrionale
La disfunzione mitocondriale negli ovociti è stata correlata ad anomalie del fuso, asimmetria cromosomica e tassi di formazione di blastocisti inferiori (Santos et al., 2006). È stato dimostrato che la disfunzione mitocondriale negli ovociti compromette l'assemblaggio del fuso e la segregazione cromosomica, causando errori meiotici e compromettendo lo sviluppo embrionale, un fenomeno dimostrato in modelli di primati sia umani che non umani dal Dott. Shoukhrat Mitalipov e colleghi (Tachibana et al., 2009, Nature).
Come si inserisce la terapia sostitutiva mitocondriale?
La salute mitocondriale non è solo un indicatore della vitalità dell'ovocita, ma anche un fattore limitante per il successo riproduttivo. La terapia sostitutiva mitocondriale mira a ripristinare un citoplasma bioenergeticamente competente, consentendo al DNA nucleare della paziente di funzionare in un ambiente cellulare ringiovanito.
Sostituendo i mitocondri invecchiati e disfunzionali con mitocondri sani di donatori, la MRT affronta una delle cause principali dell'infertilità legata all'età a livello cellulare, un problema che la fecondazione in vitro tradizionale non riesce a risolvere quando l'ambiente citoplasmatico dell'ovulo è compromesso.
La MRT è una tecnica rivoluzionaria che sostituisce i mitocondri disfunzionali presenti nell'ovulo di una donna con mitocondri sani provenienti da un ovulo di una donatrice, creando un ambiente più favorevole allo sviluppo dell'embrione e preservando al contempo il materiale genetico nucleare della donna.
Come funziona la MRT?
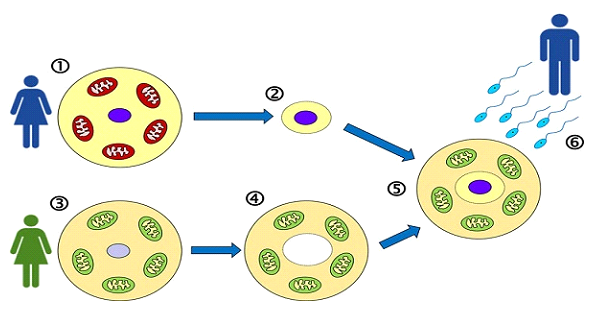
A differenza del trasferimento citoplasmatico, in cui una piccola quantità di citoplasma dell'ovulo donato viene iniettata nell'ovulo di una paziente, la MRT prevede il trasferimento completo del DNA nucleare materno in un ovulo donato enucleato che conserva i propri mitocondri sani. Questa tecnica è nota come Trasferimento del Fuso Materno (MST) e consente la visualizzazione e la manipolazione precise del materiale genetico.
Fasi del processo MRT:
• Prelievo degli ovociti: la paziente viene sottoposta a stimolazione ovarica e prelievo degli ovociti. A causa della minore produzione di ovociti nelle donne over 40, potrebbero essere necessari più cicli di prelievo. Per la procedura di MRT sono necessari almeno 3 ovociti di grado M2. Più ovociti ha una paziente, maggiori sono le probabilità di successo. Gli ovociti della paziente vengono congelati fino a quando non viene trovata una donatrice idonea e i suoi ovociti sono pronti per il prelievo.
• Preparazione degli ovociti della donatrice: viene prelevato un ovocita e il suo nucleo viene rimosso con cura, lasciando il citoplasma con mitocondri intatti e sani. Questa procedura viene eseguita su ovociti freschi. Pertanto, il protocollo di TRM viene eseguito esclusivamente con ovociti freschi di donatrice.
• Trasferimento del fuso: il DNA nucleare (materiale genetico) del paziente viene estratto e trasferito nell'ovulo enucleato della donatrice.
• Fecondazione: l'ovulo ricostruito, ora contenente il materiale genetico del paziente e i mitocondri sani del donatore, viene fecondato mediante ICSI (iniezione intracitoplasmatica dello spermatozoo). Nella maggior parte dei casi, fornire un campione di sperma fresco potrebbe non essere possibile se i pazienti provengono dall'estero. Pertanto, chiediamo di fornire in anticipo un campione di sperma e di conservarlo congelato in preparazione di un ciclo di TRM.
• Sviluppo embrionale: gli embrioni risultanti vengono coltivati fino allo stadio di blastocisti e poi vitrificati (congelati) per il futuro trasferimento. Poiché gli ovociti della donatrice vengono utilizzati freschi, tecnicamente si tratterebbe del primo tentativo di congelamento (anche se gli ovociti della paziente erano già stati congelati).
• Trasferimento dell'embrione: in un ciclo successivo, la paziente viene sottoposta alla preparazione dell'endometrio per il trasferimento dell'embrione.
La terapia sostitutiva mitocondriale (MRT) prevede il trasferimento di materiale genetico nucleare dall'ovulo di una donna a un ovulo di una donatrice con mitocondri sani. L'obiettivo è preservare il DNA nucleare della paziente, fornendo al contempo un citoplasma bioenergeticamente competente. Esistono due tecniche principali utilizzate per raggiungere questo obiettivo:
1. Trasferimento del fuso materno (MST): il metodo utilizzato presso la nostra unità di fecondazione in vitro.
Il MST viene eseguito allo stadio di ovocita in metafase II (MII), prima della fecondazione. Il complesso del fuso meiotico materno (contenente cromosomi) viene accuratamente rimosso dall'ovulo non fecondato della paziente e trasferito in un ovulo donato a cui è stato rimosso il proprio fuso. L'ovulo ricostruito viene quindi fecondato con lo spermatozoo.
Questo metodo è ideale per il trattamento dell'infertilità e delle disfunzioni ovocitarie legate all'età, poiché evita la manipolazione post-fecondazione. Il rischio di carry-over mitocondriale è in genere <1%, riducendo al minimo il rischio di recidiva di malattia mitocondriale se l'indicazione alla MRT è la malattia mitocondriale. In caso contrario, questo è piuttosto irrilevante.
2. Trasferimento pronucleare (PNT)
La PNT viene eseguita allo stadio di zigote, dopo la fecondazione. I pronuclei (maschile e femminile) vengono rimossi da un ovulo fecondato e trasferiti in uno zigote donatore enucleato. Questo metodo è studiato principalmente per prevenire le malattie mitocondriali ereditarie. Tuttavia, il rischio di carryover mitocondriale è maggiore rispetto alla MST (~2–5%), a seconda della tecnica utilizzata.
Perché il trasferimento del fuso è superiore nelle applicazioni per la fertilità?
Considerazioni etiche e legali
La MST evita la creazione e la distruzione di embrioni, poiché avviene prima della fecondazione. Questo l'ha resa più accettabile eticamente e legalmente in molte giurisdizioni rispetto alla PNT. La PNT comporta la manipolazione di uno zigote fecondato, sollevando preoccupazioni bioetiche più significative.
Minore trasporto mitocondriale
L'MST dimostra costantemente un minore carryover di mtDNA, riducendo il rischio di trasmissione di mutazioni mitocondriali alla prole. Mitalipov et al. (2009, 2016) hanno dimostrato che l'MST ha prodotto mtDNA non rilevabile o trascurabile dall'ovocita originale, mentre il PNT può contenere quantità maggiori di mtDNA difettoso a causa del mescolamento citoplasmatico.
Rischio ridotto di problemi di riprogrammazione epigenetica
Poiché l'MST si verifica prima della fecondazione, il rimodellamento epigenetico avviene all'interno di un singolo ambiente citoplasmatico, con conseguente potenziale espressione genica più stabile durante l'embriogenesi. Al contrario, il PNT combina nuclei già fecondati con un citoplasma estraneo, il che può portare a discordanza epigenetica o a riprogrammazione ritardata.
Migliori risultati nello sviluppo dell'embrione
In studi su ovociti ed embrioni umani, inclusi quelli di Tachibana et al. (2013) e Zhang et al. (2017), gli embrioni MST hanno mostrato una maggiore competenza di sviluppo e tassi di frammentazione inferiori rispetto agli embrioni derivati da PNT. L'MST è stato inoltre più facilmente trasposto in applicazioni per la fertilità, come dimostrato dal primo parto tramite MST in Grecia (2019), in una paziente con ripetuti fallimenti di fecondazione in vitro.
Chi è un candidato per la MRT?
La MRT viene presa in considerazione nei seguenti scenari clinici:
• Donne con disfunzione mitocondriale documentata o marcatori suggestivi di scarsa qualità citoplasmatica degli ovociti
• Pazienti in età materna avanzata (tipicamente >40) con ripetuti fallimenti di fecondazione in vitro dovuti a fattori correlati agli ovociti
• Donne con riserva ovarica normale ma scarso sviluppo embrionale o tassi di fecondazione suggestivi di insufficienza citoplasmatica
• Individui che cercano un figlio biologicamente imparentato ma a cui è stato precedentemente consigliato di prendere in considerazione la donazione di ovuli a causa della scarsa qualità degli ovociti
Contesto scientifico e risultati clinici:
Nel 2019, la TRM è stata utilizzata con successo per ottenere la nascita di un bambino sano in Grecia grazie a una collaborazione guidata dal Dott. Mitalipov. La madre aveva subito diversi cicli di fecondazione in vitro falliti a causa della scarsa qualità degli ovociti. Questo caso ha segnato uno dei primi nati vivi con il trasferimento del fuso materno per l'infertilità, anziché per la prevenzione delle malattie genetiche.
In questa coorte è stato osservato un tasso di successo di 25%, il che significa che 1 donna su 4 che in precedenza aveva fallito la fecondazione in vitro ha ottenuto una gravidanza tramite TRM. Sebbene questo numero possa sembrare modesto, è significativo per le donne precedentemente considerate non responder ai protocolli standard di fecondazione in vitro.
È importante tenere presente che, sebbene le donne che hanno partecipato a questo studio abbiano subito diversi cicli di fecondazione in vitro (FIVET) falliti, avevano un'età pari o inferiore a 40 anni. Il tasso di 25% potrebbe non essere applicabile alle donne in fasce di età più avanzate. Tuttavia, le donne coinvolte nello studio in Grecia si sono sottoposte a una singola procedura di prelievo di ovociti e, nella maggior parte dei casi, ne hanno ottenuto un numero molto limitato. Presso il Centro FIVET di Cipro Nord, di solito miriamo a ottenere il maggior numero possibile di ovociti attraverso più prelievi, soprattutto nelle pazienti di età superiore ai 43 anni, per migliorare le probabilità di successo.
Il processo di trattamento presso il Centro di fecondazione in vitro di Cipro del Nord
Poiché la quantità e la qualità degli ovociti tendono a diminuire contemporaneamente nelle donne in età avanzata, la maggior parte delle candidate richiederà due o più cicli di prelievo degli ovociti per accumulare un numero sufficiente di ovociti maturi per la MRT. Ecco come si svolge il processo:
1. Stimolazione ovarica e congelamento degli ovociti
EOgni ciclo di prelievo prevede la stimolazione e il prelievo degli ovociti, seguiti dalla loro vitrificazione. Questo può essere ripetuto secondo necessità (in genere 2-3 volte) a seconda della risposta ovarica. Abbiamo pazienti che ottengono 9-10 ovociti in un ciclo e altre che si sottopongono a 4-5 prelievi prima di ottenere il numero ideale di ovociti. Alcune pazienti preferiscono avere fino a 15-16 ovociti per avere più embrioni che potrebbero potenzialmente consentire un futuro progetto di gemellaggio.
2. Coordinamento delle donazioni di ovuli freschi
Una volta congelato un numero sufficiente di ovociti della paziente, vengono preparati ovociti freschi della donatrice in concomitanza con la procedura di risonanza magnetica. Gli ovociti freschi sono essenziali poiché l'integrità mitocondriale e l'attività citoplasmatica si degradano con il congelamento.
3. MRT e creazione dell'embrione
La procedura di Risonanza Magnetica (MRT) viene eseguita utilizzando la tecnica del trasferimento del fuso materno, seguita da ICSI per la fecondazione degli ovociti ricostruiti. Gli embrioni vengono coltivati fino allo stadio di blastocisti e congelati per il futuro trasferimento. Il Dott. Shoukhrat Mitalipov si reca solitamente a Cipro due volte all'anno (una a luglio e una a dicembre) ed è in questo periodo che si prevede che le procedure vengano eseguite. A seconda del volume di pazienti, è possibile aggiungere una terza procedura di MRT al programma.
4. Preparazione dell'endometrio e trasferimento dell'embrione
In un ciclo separato, l'utero della paziente viene preparato ormonalmente per ricevere l'embrione. Una volta confermati lo spessore e la ricettività dell'endometrio, viene quindi eseguito un trasferimento di embrioni congelati (FET).
Tempistiche e logistica per i pazienti internazionali
La maggior parte dei nostri pazienti sottoposti a MRT proviene dall'estero e noi ci adattiamo a orari flessibili coordinando la preparazione iniziale da remoto:
• La stimolazione ovarica e il monitoraggio preliminare (ormoni, scansioni) possono essere effettuati localmente sotto la nostra guida.
• Sarà necessario recarsi a Cipro solo per ogni prelievo degli ovociti, con una permanenza solitamente di 3-5 giorni.
• Una volta completata la MRT e congelati gli embrioni, è necessario un viaggio separato di 2 giorni per il trasferimento finale degli embrioni.
Costi e pianificazione
Il costo totale del trattamento con MRT dipende dal numero di cicli di prelievo degli ovociti necessari. In media, le pazienti si sottopongono a due prelievi ovociti, portando il costo complessivo a circa 14.000 euro. Questo include:
• Due prelievi di ovociti e protocolli di medicazione
• Vitrificazione e conservazione degli ovociti
• Approvvigionamento di ovuli freschi da donatrice
• Procedura MRT (trasferimento del fuso e creazione dell'embrione)
• Coltura e congelamento della blastocisti
• Trasferimento finale dell'embrione congelato con preparazione dell'endometrio
Ogni ulteriore procedura di prelievo degli ovociti ha un costo di 2.500 euro. In alcuni casi, le pazienti spesso scelgono di sottoporsi al trattamento con PRP ovarico e esosomi tra un ciclo e l'altro per migliorare la conta e la qualità degli ovociti in vista del successivo prelievo.
La corrispondenza degli aplogruppi è un problema?
Attualmente, non eseguiamo la selezione dei donatori mitocondriali basata sulla compatibilità aplogruppi materni. Sebbene il concetto di compatibilità aplogruppi sia stato discusso nella letteratura scientifica, la rilevanza clinica della discrepanza mito-nucleare rimane teorica e non è stato dimostrato che abbia un impatto sullo sviluppo embrionale, sull'impianto o sulla salute postnatale precoce nei casi di trapianto di midollo osseo umano. Nei modelli di primati umani e non umani, inclusi quelli eseguiti dal team del Dr. Mitalipov, la discrepanza aplogruppi non ha comportato esiti negativi sullo sviluppo (Tachibana et al., 2009, Nature; Zhang et al., 2017). Sebbene il monitoraggio multigenerazionale a lungo termine delle interazioni mito-nucleari negli esseri umani sia ancora in corso, le evidenze attuali suggeriscono che gli esiti dello sviluppo a breve e medio termine non siano compromessi dalla discrepanza aplogruppi (Mitalipov & Wolf, Nat Rev Mol Cell Biol, 2014).
Inoltre, il test dell'aplogruppo non è un test di screening standard e validato nei programmi di donazione di ovociti e non è disponibile di routine per l'applicazione clinica. Il nostro obiettivo principale è selezionare donatrici con un'eccellente qualità ovocitaria, una sana funzione mitocondriale e screening clinico per malattie genetiche e infettive, che hanno un impatto maggiore sui risultati del trattamento.
Studi, compresi quelli condotti dal Dott. Mitalipov, hanno dimostrato che gli embrioni creati utilizzando aplogruppi mitocondriali non compatibili (ad esempio provenienti da contesti etnici o linee di discendenza diverse) possono svilupparsi normalmente e dare origine a nascite sane.
Perché scegliere la MRT rispetto alla donazione di ovuli?
La MRT offre alle donne un'opportunità unica di concepire utilizzando il proprio patrimonio genetico, anche quando la qualità degli ovociti è significativamente diminuita a causa dell'età. A differenza della donazione di ovociti, che dà origine a un figlio geneticamente non imparentato, la MRT conserva il DNA nucleare materno, il che significa che il bambino porta con sé il patrimonio genetico del nascituro.
Cosa succede se la TRM non funziona? Posso sottopormi a un ciclo di fecondazione in vitro in tandem?
Sì, assolutamente, è possibile sottoporsi a un ciclo di fecondazione in vitro tandem parallelamente al trattamento di terapia di risonanza magnetica; in effetti, è qualcosa che consigliamo vivamente in determinate situazioni cliniche.
Nella terapia sostitutiva mitocondriale (MRT), viene utilizzata solo la componente citoplasmatica (mitocondri) dell'ovulo donato, mentre il materiale genetico nucleare del donatore viene mantenuto. Poiché il bambino che nascerà sarà geneticamente suo, la compatibilità fenotipica con la donatrice non è necessaria nei cicli di MRT. I mitocondri del donatore sono puramente funzionali e non contribuiscono alle caratteristiche fisiche o di personalità.
Tuttavia, nei casi in cui prevediamo una minore probabilità di successo, ad esempio a causa di una produzione di ovociti molto bassa o di una qualità ovocitaria notevolmente ridotta, un ciclo di FIVET in tandem può essere considerato un piano di riserva. Ciò significa che eseguiamo un ciclo di FIVET simultaneo utilizzando ovociti di donatrice insieme al vostro ciclo di trapianto di midollo osseo (MRT). Questo offre il vantaggio di creare due gruppi separati di embrioni:
• Un gruppo derivato dal tuo materiale genetico tramite MRT
• Un altro gruppo deriva da ovuli di donatrici.
Come funziona la fecondazione in vitro in tandem insieme alla terapia di rimbalzo?
• La stimolazione ovarica e il prelievo vengono effettuati per ottenere gli ovociti da sottoporre a MRT.
• Parallelamente, ci coordiniamo con una donatrice idonea per un ciclo di donazione di ovociti freschi.
• Gli ovociti vengono sottoposti al trasferimento del fuso materno (MST) e fecondati tramite ICSI.
• Gli ovociti della donatrice vengono fecondati con lo sperma del tuo partner (o del donatore selezionato) per creare un secondo set di embrioni.
• Tutti gli embrioni vengono coltivati fino allo stadio di blastocisti, momento in cui:
• È possibile selezionare uno o più embrioni, provenienti da MRT o da fecondazione in vitro con donatrice, per il trasferimento immediato.
• Gli embrioni rimanenti di entrambi i gruppi possono essere vitrificati (congelati) e conservati per un uso futuro.
Un vantaggio importante dell'approccio tandem è la totale flessibilità. A seconda della qualità dell'embrione e delle preferenze di trattamento, è possibile:
• Scegli di trasferire solo il tuo embrione (derivato da MRT)
• Scegliere di trasferire un embrione di ovulo donato
• Oppure optare per il trasferimento di due embrioni, uno da ciascun gruppo, anche se in questo caso si aumentano le probabilità di avere gemelli.
Tutti gli embrioni rimanenti possono essere congelati in tutta sicurezza per cicli futuri, offrendoti altre opzioni in futuro senza dover ripetere la stimolazione o cercare un donatore compatibile.
Tandem IVF offre:
• Rassicurazione e supporto nel caso in cui gli embrioni MRT non si sviluppino in modo ottimale
• Maggiori tassi di gravidanza cumulativi aumentando il numero di embrioni vitali o semplicemente la tranquillità di avere embrioni disponibili per il trasferimento qualora gli ovuli propri non funzionassero.
• Efficienza temporale, poiché entrambe le strategie vengono eseguite in un'unica finestra di trattamento
• Efficienza finanziaria, poiché non sarebbe necessario sottoporsi a un ulteriore ciclo di fecondazione in vitro separato utilizzando ovociti donati, il che comporterebbe costi più elevati.
Pronti a saperne di più?
Se ti è stato detto che le tue possibilità di successo con i tuoi ovuli sono troppo basse, o se hai avuto ripetuti fallimenti con la fecondazione in vitro, la TRM potrebbe offrirti un nuovo percorso verso la genitorialità. Contattaci per fissare una consulenza o per iniziare la tua valutazione.
Centro FIVET di Cipro del Nord
North Cyprus IVF Center è una clinica per la fertilità incentrata sul paziente, situata all'interno di "Elite Research and Surgical Hospital” a Nicosia, Cipro. La nostra clinica è una delle cliniche per la fertilità più avanzate al mondo e offre una più ampia scelta di opzioni di trattamento a prezzi convenienti.
Contattaci
Telefono
Inglese: +90 548 875 8000
Francese: +90 548 876 8000
Turco: +90 542 869 8000
Arabo: +90 548 875 8000
Tedesco: +90 548 830 1987
Russo: +90 548 828 9955
info@northcyprusivf.net
© 2020 LowCostIVF - Tutti i diritti riservati. politica sulla riservatezza