- Über Uns
- Blog
- Unfruchtbarkeit
- IVF-Behandlungen
- Neue IVF-Fortschritte
- IVF-Behandlung in Zypern
- IVF für Frauen über 40
- IVF für Frauen über 50
- IUI
- Mini-IVF
- IVF + ICSI
- Zytoplasmatische IVF
- Tandem-IVF-Zyklus
- Eizellspende
- Embryonenspende
- Samenspende
- Geschlecht – Geschlechtsauswahl
- Schwangerschafts-Leihmutterschaft
- Gleichgeschlechtliche Leihmutterschaft für Schwule
- Chirurgische Spermienentnahme
- Genetische Diagnostik vor der Implantation, PID
- Einfrieren von Eiern
- Geschlechtsauswahl mithilfe von Spendereizellen
- Prävention von Sichelzellanämie
- FAQ
- Reisen
- Über Uns
- Blog
- Unfruchtbarkeit
- IVF-Behandlungen
- Neue IVF-Fortschritte
- IVF-Behandlung in Zypern
- IVF für Frauen über 40
- IVF für Frauen über 50
- IUI
- Mini-IVF
- IVF + ICSI
- Zytoplasmatische IVF
- Tandem-IVF-Zyklus
- Eizellspende
- Embryonenspende
- Samenspende
- Geschlecht – Geschlechtsauswahl
- Schwangerschafts-Leihmutterschaft
- Gleichgeschlechtliche Leihmutterschaft für Schwule
- Chirurgische Spermienentnahme
- Genetische Diagnostik vor der Implantation, PID
- Einfrieren von Eiern
- Geschlechtsauswahl mithilfe von Spendereizellen
- Prävention von Sichelzellanämie
- FAQ
- Reisen
IVF für Frauen über 40
IVF für Frauen über 40: Realistische und dennoch hoffnungsvolle Wege nach vorn
Die Landschaft verstehen:
Mit zunehmendem Alter der Frau, insbesondere über 40 Jahre, ist ein deutlicher Rückgang der Fruchtbarkeit zu beobachten. Dies liegt vor allem daran, dass Frauen mit einer begrenzten Anzahl von Follikeln geboren werden und sowohl deren Quantität als auch ihre Qualität mit der Zeit aufgrund von kumulativem oxidativem Stress, mitochondrialen Dysfunktionen und meiotischen Fehlern abnehmen (te Velde und Pearson, 2002).
Laut umfangreichen Registerdaten sinkt die Lebendgeburtenrate mit Eizellen von Nichtspenderinnen von etwa 261 TP3T im Alter von 38–40 Jahren auf etwa 131 TP3T im Alter von 41–42 Jahren und auf unter 51 TP3T nach 42 Jahren (SART, 2023). Das folgende Diagramm zeigt eine grobe Schätzung der ovariellen Reserven einer durchschnittlichen Frau während ihrer reproduktiven Jahre:
Abbildung 1: Alter und weibliche Eierstockreserve
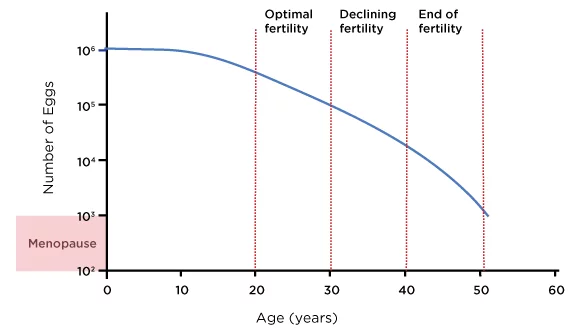
Quelle: Ozyigit, A. und Ozyigit, S., 2018. Der IVF-Leitfaden: Was Sie über Fruchtbarkeit, Unfruchtbarkeit und verfügbare Behandlungsmöglichkeiten wissen müssen. 1. Auflage. Irvine, CA: Universal Publishers, Abbildung 1.
Allerdings sind die ovarielle Reserve und Reaktion von Frau zu Frau unterschiedlich, und manche Frauen verfügen bis in ihre frühen oder mittleren Vierziger über ein höheres reproduktives Potenzial. Daher ist eine individuelle Beurteilung mittels Antralfollikelzählung (AFC), Anti-Müller-Hormon (AMH)-Test und Ergebnissen früherer IVF-Zyklen für die Auswahl der am besten geeigneten Strategie unerlässlich (Broer et al., 2014).
Eizellen- oder Embryonenbank: Bauen Sie Ihr eigenes „Sicherheitsnetz“ auf
Ein praktischer Ansatz zur Verbesserung der kumulativen Erfolgsraten ist die Eizellen- oder Embryonenbank. Durch mehrere Stimulations- und Entnahmezyklen ist es möglich, eine größere Anzahl von Eizellen (oder Embryonen) zu sammeln und so die Wahrscheinlichkeit einer erfolgreichen Schwangerschaft zu erhöhen. Die Vitrifikation von Eizellen führt nachweislich zu Überlebens- und Befruchtungsraten, die mit denen frischer Eizellen vergleichbar sind (Cobo et al., 2016), ohne dass das Risiko angeborener Anomalien steigt (Noyes et al., 2009). Daher können durch mehrere Eizellentnahmen Ergebnisse erzielt werden, die mit einer einzigen Eizellentnahme nicht möglich sind.
Obwohl die Schwangerschafts- und Lebendgeburtenraten bei Frauen ab 40 Jahren in einem einzigen Behandlungszyklus relativ niedrig sind, ist es wichtig zu bedenken, dass diese Zahlen pro Zyklus berechnet werden. Durch die Durchführung mehrerer Zyklen und die Kombination der Ergebnisse kann die Gesamtwahrscheinlichkeit für eine Schwangerschaft und eine Lebendgeburt erheblich steigen. Dieser Ansatz bietet auch die Möglichkeit, einen Präimplantationsdiagnostiktest auf Aneuploidie (PGT-A) durchzuführen, der dazu beitragen kann, Embryonen mit normalem Chromosomensatz zu identifizieren und die Erfolgschancen weiter zu verbessern (Doyle et al., 2016).
Die Eizellenbank kann noch effektiver sein, wenn sie mit anderen modernen Fortschritten in der Reproduktionsmedizin kombiniert wird, die das Potenzial haben, den Zyklusverlauf zu verbessern. Dazu gehören Eierstock-PRP-Behandlung und eine moderne technologische Innovation, bekannt als Mitochondriale Ersatztherapie (MRT). Die Einbeziehung solcher Ansätze in die Eizellenbank kann die Qualität und das Entwicklungspotenzial der entnommenen Eizellen verbessern und so die Anzahl lebensfähiger Embryonen für den Transfer erhöhen. Strategisch eingesetzt können diese Methoden die Vorteile der Eizellenbank ergänzen, indem sie nicht nur den Pool gelagerter Eizellen erweitern, sondern auch deren Reproduktionspotenzial optimieren und so letztendlich die Chance auf eine erfolgreiche Schwangerschaft erhöhen.
Plättchenreiches Plasma (PRP) der Eierstöcke
Bei der ovariellen PRP wird autologes Thrombozytenkonzentrat in die Eierstöcke injiziert, um lokale Wachstumsfaktoren zu stimulieren und so die Follikelrekrutierung zu verbessern. Studien mit Patientinnen mit geringem Ansprechen, darunter Frauen im fortgeschrittenen reproduktiven Alter, berichteten von Verbesserungen bei AMH, AFC und Blastozystenqualität, wobei einige Lebendgeburten erzielt wurden (Sfakianoudis et al., 2019). Eine aktuelle Studie zeigte signifikante Steigerungen der nutzbaren Blastozystenausbeute nach PRP bei Frauen mit zuvor minderwertigen Embryonen (Yu et al., 2025). Obwohl PRP noch kein Behandlungsstandard ist, ist es eine sinnvolle Ergänzung für ausgewählte Patientinnen, die ihr eigenes Eizellpotenzial optimieren möchten.
Die ovarielle PRP-Therapie ist ein weitaus anspruchsvolleres Verfahren als die bloße Injektion von plättchenreichem Plasma in die Eierstöcke und die Hoffnung auf eine Verbesserung. Ihr Erfolg hängt von sorgfältig ausgearbeiteten Protokollen ab, die mit der richtigen Thrombozytenpräparation beginnen, einschließlich einer kontrollierten Inaktivierung, um eine vorzeitige Aktivierung und Erschöpfung der Wachstumsfaktoren vor Erreichen des Zielgewebes zu verhindern. Konzentration und Dichte der Thrombozyten müssen optimiert werden, um eine therapeutisch sinnvolle Dosis zu gewährleisten, da suboptimale oder zu verdünnte Präparate möglicherweise nicht den gewünschten regenerativen Reiz liefern. Ebenso wichtig ist die Präzision der Injektion mit gezielten Injektionen in bestimmte anatomische Regionen des Eierstocks, wo die Follikelentwicklung am ehesten von einer verbesserten Vaskularisierung, zellulären Signalgebung und mikroökonomischen Unterstützung profitiert. Nach dem Eingriff ist eine maßgeschneiderte Supplementierung unerlässlich, um den Oogeneseprozess aufrechtzuerhalten und zu unterstützen und sicherzustellen, dass das biochemische und hormonelle Umfeld die Follikelrekrutierung, das Wachstum und die Reifung fördert. Zusammen machen diese Faktoren die PRP-Therapie von einer einfachen Injektion zu einer wissenschaftlich fundierten und potenziell transformativen Intervention für die Eierstockfunktion.
Mitochondriale Ersatztherapie (MRT)
Die Mitochondrienersatztherapie (MRT) ist eine neue Reproduktionstechnik, die darauf abzielt, die bioenergetische Kapazität von Eizellen durch die Ergänzung mit gesunden Spendermitochondrien wiederherzustellen. Dieser Ansatz befasst sich direkt mit einer der bedeutendsten altersbedingten Veränderungen der weiblichen Fortpflanzung: dem fortschreitenden Rückgang der Mitochondrienfunktion, der eng mit einer verminderten Eizellkompetenz und einer beeinträchtigten Embryonalentwicklung verbunden ist (St. John et al., 2019).
Durch die Einführung funktioneller Mitochondrien in die Eizelle soll die MRT die ATP-Produktion verbessern, die zelluläre Umgebung für die meiotische Teilung optimieren und das Entwicklungspotenzial der entstehenden Embryonen steigern. Obwohl die klinische Anwendung relativ neu ist und das North Cyprus IVF Center zu den wenigen klinischen Einrichtungen gehört, die diesen Service anbieten, haben frühe Human- und präklinische Studien ermutigende Ergebnisse gezeigt, insbesondere bei Patientinnen mit wiederkehrenden embryonalen Entwicklungsstörungen oder schlechter Embryoqualität (Zhang et al., 2017).
Dr. Shoukhrat Mitalipov und seine Kollegen haben in der MRT-Forschung eine Vorreiterrolle eingenommen und sowohl in Tiermodellen als auch in menschlichen Eizellen gezeigt, dass die Übertragung gesunder Mitochondrien bioenergetische Defizite korrigieren und zu verbesserten Ergebnissen bei der Befruchtung und Embryonalentwicklung führen kann. Dies stützt die Begründung für ihren gezielten Einsatz bei alters- oder krankheitsbedingter mitochondrialer Insuffizienz (Kang et al., 2016).
Kombinationsstrategien: Eizellenbank, ovarielle PRP-Behandlung und MRT
Für bestimmte Patientinnen, insbesondere bei Patienten mit einer Vorgeschichte fehlgeschlagener Zyklen aufgrund schlechter Embryonalentwicklung, bietet eine umfassende Strategie, die Eizellenbanken, ovarielles PRP und eine mitochondriale Ersatztherapie kombiniert, möglicherweise das größte Potenzial zur Verbesserung der Ergebnisse. Dieser vielschichtige Ansatz zielt von mehreren Seiten auf die Alterung der Eizellen ab. Durch die Eizellenbanken können überzählige Eizellen gewonnen werden, was mit einer einzigen Eizellentnahme in einem IVF-Zyklus nicht möglich wäre. Ovarielles PRP zielt darauf ab, das Follikelmilieu zu verbessern und eine gesündere Follikelrekrutierung mit einem Eizellentnahmezyklus zu fördern, während die mitochondriale Ersatztherapie die optimale Bioenergetik der Eizellen wiederherstellt und das Entwicklungspotenzial des Embryos verbessert. Zusammen adressieren diese Interventionen sowohl die zelluläre Energieproduktion als auch das ovarielle Mikromilieu, zwei entscheidende Faktoren für den Fortpflanzungserfolg bei altersbedingter Unfruchtbarkeit (Labarta et al., 2019).
****
Diese Strategien sollen die Wahrscheinlichkeit einer Schwangerschaft mithilfe des eigenen genetischen Materials der Frau und damit die Geburt eines leiblichen Kindes erhöhen. Solche Eingriffe können die Erfolgschancen im Vergleich zu einem Standard-IVF-Zyklus zwar deutlich erhöhen, sind jedoch dennoch mit erheblichen Kosten verbunden und können keine hohe Erfolgswahrscheinlichkeit garantieren, insbesondere bei fortgeschrittenem Alter der Mutter oder verminderter ovarieller Reserve. Für Paare oder Einzelpersonen, die keine Spendereizellen in Betracht ziehen möchten, können diese Ansätze die Chancen auf ein leibliches Kind dennoch deutlich verbessern. Wenn jedoch das Hauptziel eine Schwangerschaft und die Wunschgeburt ist, unabhängig davon, ob eine genetische Verbindung zur Wunschmutter besteht, können alternative Optionen wie ein Tandem-IVF-Zyklus oder die direkte Verwendung von Spendereizellen wesentlich höhere Erfolgsraten bieten, insbesondere für Frauen über 40.
Tandem-IVF-Zyklus
Ein Tandem-IVF-Zyklus ist ein Behandlungsansatz, bei dem eine Patientin eine ovarielle Stimulation zur Produktion eigener Eizellen durchläuft und gleichzeitig im selben Behandlungszyklus Spendereizellen verwendet. Beide Eizellensätze werden separat befruchtet, und aus beiden Quellen werden Embryonen erzeugt. Dies ermöglicht den Wunscheltern, mit dem eigenen genetischen Material der Patientin eine Empfängnis zu versuchen und gleichzeitig im selben Zyklus hochwertige Spenderembryonen zur Verfügung zu haben. Embryonen aus beiden Quellen können bis zum Blastozystenstadium kultiviert, auf Wunsch genetisch getestet und für die spätere Verwendung aufbewahrt werden. Dieser Ansatz bietet den einzigartigen Vorteil, die Erfolgschancen innerhalb eines einzigen Behandlungszyklus zu maximieren und gleichzeitig die Möglichkeit einer biologischen Verbindung zur Wunschmutter zu erhalten.
IVF mit gespendeter Eizelle
IVF mit gespendeter Eizelle Bei dieser Methode werden Eizellen einer gesunden, untersuchten Spenderin verwendet und mit dem Sperma des Wunschvaters oder einer Spenderin befruchtet. Da die Qualität der Eizellen maßgeblich vom Alter und der reproduktiven Gesundheit der Spenderin und nicht von der Wunschmutter abhängt, erhöht dieser Ansatz die Wahrscheinlichkeit für die Produktion hochwertiger Embryonen und eine erfolgreiche Schwangerschaft erheblich. Die IVF mit gespendeten Eizellen ist besonders wertvoll für Frauen im fortgeschrittenen gebärfähigen Alter, mit stark verminderter ovarieller Reserve oder für Frauen, deren vorherige IVF-Zyklen mit eigenen Eizellen fehlgeschlagen sind. Das entstehende Kind hat eine genetische Verbindung zur Samenquelle, nicht jedoch zur Eizellenempfängerin, obwohl die Schwangerschaft und die mütterlich-fötale Bindung vollständig erhalten bleiben.
Praktische Wege für Frauen über 40
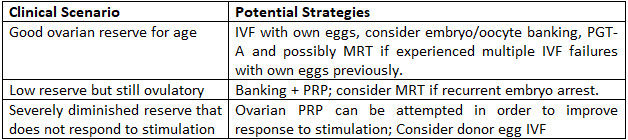
Die wichtigsten Erkenntnisse
- – Erfolg mit eigenen Eizellen über 40 ist möglich, aber schwierig; realistische Erwartungen sind wichtig.
- – Die Einlagerung von Eizellen/Embryonen kann die kumulativen Chancen verbessern und ein genetisches Screening ermöglichen.
- – MRT und PRP sind in ausgewählten Fällen vielversprechende Ergänzungen.
- – Spendereizellen bieten die höchsten Erfolgsraten und sollten bei schlechter Prognose frühzeitig besprochen werden.
- Bitte kontaktiere uns für weitere Informationen und individuelle Empfehlungen.
Verweise
- Broer, SL, Broekmans, FJ, Laven, JS und Fauser, BC, 2014. Anti-Müller-Hormon: Untersuchung der ovariellen Reserve und ihre möglichen klinischen Auswirkungen. Human Reproduction Update, 20(5), S. 688–701.
- Cobo, A., García-Velasco, J., Coello, A., Domingo, J., Pellicer, A. und Remohí, J., 2016. Vitrifizierung von Eizellen als effiziente Option zur elektiven Fertilitätserhaltung. Fertility and Sterility, 105(3), S. 755–764.
- Devroey, P., Fauser, BC und Diedrich, K., 2011. Ansätze zur Verbesserung der Diagnose und Behandlung von Unfruchtbarkeit. Human Reproduction Update, 17(5), S. 455–467.
- Doyle, JO, Richter, KS, Lim, J., Stillman, RJ, Graham, JR und Tucker, MJ, 2016. Erfolgreiche elektive und medizinisch indizierte Vitrifizierung und Erwärmung von Eizellen für die autologe In-vitro-Fertilisation mit prognostizierten Geburtswahrscheinlichkeiten zur Fertilitätserhaltung in Abhängigkeit von der Anzahl der kryokonservierten Eizellen und dem Alter bei der Entnahme. Fertility and Sterility, 105(2), S. 459–466.
- Labarta, E., de los Santos, MJ, Escribá, MJ, Pellicer, A. und Herraiz, S., 2019. Mitochondrien als Werkzeug zur Eizellenverjüngung. Fruchtbarkeit und Sterilität, 111(2), S. 219–226.
- Noyes, N., Porcu, E. und Borini, A., 2009. Über 900 durch Kryokonservierung von Eizellen geborene Babys zeigten keine erkennbare Zunahme angeborener Anomalien. Reproductive BioMedicine Online, 18(6), S. 769–776.
- Paulson, RJ, Hatch, IE, Lobo, RA und Sauer, MV, 2002. Kumulative Schwangerschaftserfolgsraten nach Eizellspende: Auswirkungen auf die Empfänglichkeit des Endometriums. Human Reproduction, 17(5), S. 1411–1416.
- Sauer, MV, 1990. Ein vorläufiger Bericht über die Eizellspende zur Erweiterung des Fortpflanzungspotenzials von Frauen über 40. New England Journal of Medicine, 323(17), S. 1157–1160.
- Sfakianoudis, K., Simopoulou, M., Nitsos, N., et al., 2019. Eine autologe Behandlung mit plättchenreichem Plasma ermöglicht einer Frau in vorzeitiger Menopause eine Schwangerschaft. Fallberichte in der Frauengesundheit, 23, e00129.
- Sills, ES, Rickers, NS, Li, X. und Palermo, GD, 2020. Erste Daten zur In-vitro-Fertilisation nach intraovarieller Injektion von Calciumgluconat-aktiviertem autologem plättchenreichem Plasma. Gynäkologische Endokrinologie, 36(6), S. 479–482.
- St. John, JC, Facucho-Oliveira, J., Jiang, Y., Kelly, R. und Salah, R., 2019. Mitochondriale DNA-Übertragung, Replikation und Vererbung: eine Reise vom Gameten durch den Embryo bis hin zu Nachkommen und embryonalen Stammzellen. Human Reproduction Update, 26(1), S. 1–35.
- Yu, TN, Wang, HY, Lee, TH, et al., 2025. Die intraovarielle Injektion von plättchenreichem Plasma verbessert die Blastozystenausbeute bei IVF-Patienten mit zuvor schlechter Embryoqualität signifikant. Scientific Reports, 15, 81234.
- Zhang, J., Liu, H., Luo, S., et al., 2017. Lebendgeburt durch Eizellspindeltransfer zur Vorbeugung mitochondrialer Erkrankungen. Reproductive BioMedicine Online, 34(4), S. 361–368.
IVF-Zentrum Nordzypern
Das IVF-Zentrum Nordzypern ist eine patientenorientierte Fruchtbarkeitsklinik mit Sitz in „Elite-Forschungs- und Chirurgiekrankenhaus“ in Nikosia, Zypern. Unsere Klinik ist eine der fortschrittlichsten Fruchtbarkeitskliniken der Welt und bietet eine größere Auswahl an Behandlungsmöglichkeiten zu erschwinglichen Preisen.
Kontakt
Telefon
Englisch: +90 548 875 8000
Französisch: +90 548 876 8000
Türkisch: +90 542 869 8000
Arabisch: +90 548 875 8000
Deutsch: +90 548 830 1987
Russisch: +90 548 828 9955
info@northcyprusivf.net
© 2020 LowCostIVF – Alle Rechte vorbehalten. Datenschutz-Bestimmungen


