- О нас
- Блог
- Бесплодие
- ЭКО лечение
- Новые достижения ЭКО
- Митохондриальная заместительная терапия!
- Лечение ЭКО на Кипре
- ЭКО для женщин старше 40 лет
- ЭКО для женщин старше 50 лет
- ВМИ
- Мини ЭКО
- ЭКО + ИКСИ
- Цитоплазматическое ЭКО
- Тандемный цикл ЭКО
- Пожертвование яйцеклеток
- Донорство эмбрионов
- Донорство спермы
- Пол – Выбор пола
- Гестационное суррогатное материнство
- Суррогатное материнство однополых геев
- Хирургическое извлечение спермы
- Преимплантационная генетическая диагностика ПГД
- Заморозка яиц
- Выбор пола с использованием донорских яйцеклеток
- Профилактика серповидноклеточной анемии
- Часто задаваемые вопросы
- Путешествовать
- О нас
- Блог
- Бесплодие
- ЭКО лечение
- Новые достижения ЭКО
- Митохондриальная заместительная терапия!
- Лечение ЭКО на Кипре
- ЭКО для женщин старше 40 лет
- ЭКО для женщин старше 50 лет
- ВМИ
- Мини ЭКО
- ЭКО + ИКСИ
- Цитоплазматическое ЭКО
- Тандемный цикл ЭКО
- Пожертвование яйцеклеток
- Донорство эмбрионов
- Донорство спермы
- Пол – Выбор пола
- Гестационное суррогатное материнство
- Суррогатное материнство однополых геев
- Хирургическое извлечение спермы
- Преимплантационная генетическая диагностика ПГД
- Заморозка яиц
- Выбор пола с использованием донорских яйцеклеток
- Профилактика серповидноклеточной анемии
- Часто задаваемые вопросы
- Путешествовать
Митохондриальная заместительная терапия
Революционная новая медицинская техника
Митохондриальная заместительная терапия (МЗТ) в Центре ЭКО на Северном Кипре
В сотрудничестве с доктором Шухратом Миталиповым – пионер будущего фертильности
В Центре ЭКО на Северном Кипре мы гордимся сотрудничеством с доктором Шухратом Миталиповым, одним из ведущих мировых экспертов в области репродуктивной генетики и митохондриальной биологии. Доктор Миталипов получил международное признание за разработку митохондриальной заместительной терапии (МЗТ) – передовой методики, изначально разработанной для предотвращения передачи митохондриальных заболеваний. Теперь она дарит новую надежду женщинам с возрастным бесплодием и рецидивирующими неудачами ЭКО.
Благодаря этому партнерству мы можем предложить МРТ как специализированное лечение бесплодия за пределами рамок клинических испытаний, объединив экспертизу команды доктора Миталипова с клиническим опытом доктора Саваса Озйигита, доктора Ахмета Озйигита и команды эмбриологов Северо-Кипрского центра ЭКО, расположенного в госпитале Elite Hospital.
Что такое митохондрии?
Митохондрии – это органеллы, вырабатывающие энергию, которые присутствуют практически в каждой клетке организма, включая ооциты (яйцеклетки). С возрастом количество и функция митохондрий снижаются, что снижает способность ооцита поддерживать нормальное оплодотворение, развитие эмбриона и имплантацию. Это снижение является одним из основных факторов возрастного бесплодия.
ТРоль митохондрий в клеточном и репродуктивном здоровье
Митохондрии — это двухмембранные органеллы, наиболее известные как «электростанции» клетки, поскольку они вырабатывают аденозинтрифосфат (АТФ) — основную энергетическую валюту, используемую практически для всех клеточных процессов. Однако митохондрии также играют важную роль в:
• Регулирование апоптоза (запрограммированной гибели клеток)
• Гомеостаз кальция
• Управление активными формами кислорода (АФК)
• Стероидогенез и клеточная сигнализация
• Созревание ооцитов, формирование веретена и раннее эмбриональное развитие
В человеческих ооцитах каждая клетка содержит от 100 000 до 600 000 митохондрий, что намного больше, чем в типичных соматических клетках, что подчеркивает их центральную роль в репродуктивной способности (May-Panloup et al., 2005).
С возрастом у женщин, особенно после 35 лет, функция митохондрий в ооцитах постепенно ухудшается:
1. Уменьшение количества копий мтДНК
Митохондрии ооцитов нуждаются в достаточном количестве копий митохондриальной ДНК (мтДНК) для поддержания продукции АТФ во время созревания и оплодотворения. Исследования показывают значительное снижение числа копий мтДНК с возрастом, что снижает доступность энергии, необходимой для нормального формирования веретена деления и сегрегации хромосом (Fragouli et al., 2015).
2. Увеличение мутаций митохондриальной ДНК
В мтДНК отсутствуют защитные гистоны, а механизмы репарации ограничены, что делает её крайне уязвимой к окислительному повреждению. С возрастом кумулятивное воздействие активных форм кислорода (АФК) приводит к увеличению числа мутаций в мтДНК, что нарушает митохондриальное дыхание и ещё больше усугубляет окислительный стресс (Barritt et al., 2002; Wallace, 2013).
3. Нарушение производства АТФ
Старые митохондрии вырабатывают меньше АТФ посредством окислительного фосфорилирования, что приводит к образованию энергетически дефицитных ооцитов, которым трудно завершить мейотическое деление или поддержать ранний эмбриогенез (Бентов и Каспер, 2013).
4. Измененный мембранный потенциал и фрагментация
Стареющие митохондрии демонстрируют потерю мембранного потенциала, повышенную фрагментацию и измененную морфологию, что приводит к нарушению клеточного метаболизма и восприимчивости к апоптозу (Wilding et al., 2001).
5. Связь с анеуплоидией и низким качеством эмбрионов
Дисфункция митохондрий в ооцитах коррелирует с аномалиями веретена деления, неправильной сегрегацией хромосом и снижением скорости формирования бластоцист (Santos et al., 2006). Было показано, что дисфункция митохондрий в ооцитах нарушает сборку веретена деления и сегрегацию хромосом, что приводит к мейотическим ошибкам и нарушению развития эмбриона. Этот феномен был продемонстрирован доктором Шухратом Миталиповым и его коллегами как на моделях человека, так и на моделях нечеловекообразных приматов (Tachibana et al., 2009, Nature).
Какую роль здесь играет митохондриальная заместительная терапия?
Здоровье митохондрий — это не просто показатель жизнеспособности ооцитов, но и фактор, ограничивающий репродуктивный успех. Заместительная митохондриальная терапия направлена на восстановление биоэнергетической полноценности цитоплазмы, позволяя ядерной ДНК пациента функционировать в обновлённой клеточной среде.
Заменяя старые, нефункционирующие митохондрии здоровыми донорскими митохондриями, МРТ устраняет основную причину возрастного бесплодия на клеточном уровне, которую традиционное ЭКО не может преодолеть, если нарушена цитоплазматическая среда яйцеклетки.
МРТ — это революционная технология, которая заменяет дисфункциональные митохондрии в яйцеклетке женщины здоровыми митохондриями из донорской яйцеклетки, создавая более жизнеспособную среду для развития эмбриона, при этом сохраняя ядерный генетический материал женщины.
Как работает МРТ?
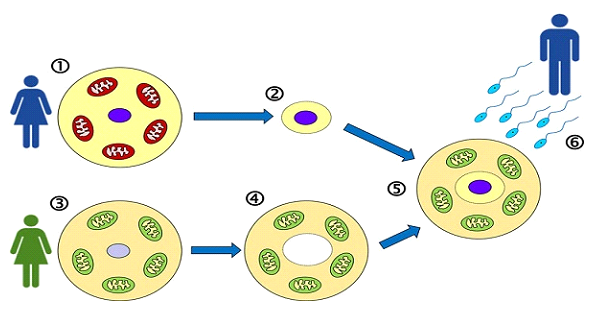
В отличие от цитоплазматического переноса, при котором небольшое количество цитоплазмы донорской яйцеклетки вводится в яйцеклетку пациента, МРТ предполагает полный перенос ядерной ДНК матери в энуклеированную донорскую яйцеклетку, сохраняющую собственные здоровые митохондрии. Этот метод известен как перенос материнского веретена (МСТ) и позволяет точно визуализировать и манипулировать генетическим материалом.
Этапы процесса МРТ:
• Забор яйцеклеток: пациентка проходит стимуляцию яичников и забор яйцеклеток. В связи с более низким выходом яйцеклеток у женщин старше 40 лет может потребоваться несколько циклов забора яйцеклеток. Для проведения МРТ требуется минимум 3 ооцита категории M2. Чем больше ооцитов у пациентки, тем выше шансы на успех. Яйцеклетки пациентки замораживаются до тех пор, пока не будет найден подходящий донор яйцеклеток и яйцеклетки не будут готовы к забору.
• Подготовка донорской яйцеклетки: извлекается донорская яйцеклетка, и её ядро аккуратно удаляется, оставляя цитоплазму с неповреждёнными, здоровыми митохондриями. Эта процедура выполняется на свежих ооцитах. Поэтому протокол МРТ применяется только к свежим ооцитам донорской яйцеклетки.
• Перенос веретена: ядерная ДНК пациента (генетический материал) извлекается и переносится в энуклеированную донорскую яйцеклетку.
• Оплодотворение: реконструированная яйцеклетка, теперь содержащая генетический материал пациента и здоровые митохондрии донора, оплодотворяется методом ИКСИ (интрацитоплазматической инъекции сперматозоида). В большинстве случаев предоставление свежего образца спермы может быть невозможным, если пациенты приезжают из-за границы. Поэтому мы просим предоставить образец спермы заранее и заморозить его для подготовки к циклу МРТ.
• Развитие эмбриона: полученные эмбрионы культивируются до стадии бластоцисты, а затем витрифицируются (замораживаются) для последующего переноса. Поскольку донорские ооциты используются в свежем виде, технически это будет первая попытка заморозки (даже несмотря на то, что ооциты пациента были ранее заморожены).
• Перенос эмбрионов: в последующем цикле пациентка проходит подготовку эндометрия к переносу эмбрионов.
Заместительная митохондриальная терапия (ЗМТ) предполагает перенос ядерного генетического материала из яйцеклетки женщины в яйцеклетку донора со здоровыми митохондриями. Целью является сохранение ядерной ДНК пациента и обеспечение биоэнергетически полноценной цитоплазмы. Для достижения этой цели используются два основных метода:
1. Перенос веретена деления от матери (MST) — метод, используемый в нашем отделении ЭКО.
МСТ проводится на стадии метафазы II (MII) ооцита, до оплодотворения. Материнский комплекс мейотического веретена (содержащий хромосомы) бережно извлекается из неоплодотворенной яйцеклетки пациентки и переносится в донорскую яйцеклетку, у которой удалено собственное веретено. Затем реконструированная яйцеклетка оплодотворяется спермой.
Этот метод идеально подходит для лечения бесплодия и возрастной дисфункции ооцитов, поскольку позволяет избежать манипуляций после оплодотворения. Риск митохондриального переноса обычно <1%, что минимизирует риск рецидива митохондриального заболевания, если показанием к МРТ является митохондриальное заболевание. В противном случае это не имеет значения.
2. Пронуклеарный перенос (ПНТ)
ПНТ проводится на стадии зиготы, после оплодотворения. Пронуклеусы (мужской и женский) извлекаются из оплодотворенной яйцеклетки и переносятся в энуклеированную донорскую зиготу. Этот метод в основном изучается для профилактики наследственных митохондриальных заболеваний. Однако риск переноса митохондрий выше, чем при МСТ (~2–5%), в зависимости от техники.
Почему перенос веретена является лучшим методом в лечении фертильности?
Этические и правовые соображения
Метод MST позволяет избежать создания и разрушения эмбрионов, поскольку он осуществляется до оплодотворения. Это сделало его более приемлемым с этической и юридической точки зрения во многих юрисдикциях по сравнению с методом PNT. PNT предполагает манипуляции с оплодотворенной зиготой, что вызывает более серьёзные биоэтические проблемы.
Нижний митохондриальный перенос
MST стабильно демонстрирует более низкий уровень переноса мтДНК, что снижает риск передачи митохондриальных мутаций потомству. Миталипов и др. (2009, 2016) показали, что MST приводит к неопределяемому или незначительному количеству мтДНК из исходного ооцита, в то время как PNT может нести большее количество дефектной мтДНК из-за цитоплазматического смешивания.
Снижение риска проблем эпигенетического перепрограммирования
Поскольку MST происходит до оплодотворения, эпигенетическое ремоделирование происходит в единой цитоплазматической среде, что потенциально приводит к более стабильной экспрессии генов в процессе эмбриогенеза. В отличие от этого, PNT объединяет уже оплодотворённые ядра с чужеродной цитоплазмой, что может привести к эпигенетическому расхождению или задержке репрограммирования.
Лучшие результаты развития эмбриона
В исследованиях ооцитов и эмбрионов человека, в том числе проведенных Тачибаной и соавторами (2013) и Чжаном и соавторами (2017), эмбрионы MST демонстрировали более высокую степень развития и более низкую частоту фрагментации, чем эмбрионы, полученные методом ПНТ. Кроме того, MST легче переносился в сферу репродуктивной медицины, как это было продемонстрировано в случае первого живорождения с помощью MST в Греции (2019) у пациентки с неоднократными неудачными попытками ЭКО.
Кто является кандидатом на MRT?
МРТ рассматривается в следующих клинических сценариях:
• Женщины с подтвержденной митохондриальной дисфункцией или маркерами, указывающими на плохое качество цитоплазмы ооцитов
• Пациенты в пожилом возрасте (обычно >40 лет) с повторными неудачами ЭКО из-за факторов, связанных с ооцитами
• Женщины с нормальным овариальным резервом, но низким уровнем развития эмбриона или оплодотворения, что указывает на цитоплазматическую недостаточность
• Лица, желающие завести биологически родственного ребенка, которым ранее рекомендовали рассмотреть возможность донорства яйцеклеток из-за низкого качества ооцитов
Научное обоснование и клинические результаты:
В 2019 году в Греции благодаря сотрудничеству под руководством доктора Миталипова метод МРТ был успешно использован для рождения здорового ребёнка. У матери было несколько неудачных попыток ЭКО из-за низкого качества яйцеклеток. Этот случай стал одним из первых случаев рождения живого ребёнка с использованием переноса материнского веретена деления для лечения бесплодия, а не для профилактики генетических заболеваний.
В этой когорте зарегистрирован показатель успешности 25%, что означает, что каждая четвёртая женщина, ранее не имевшая успеха в ЭКО, забеременела с помощью МРТ. Хотя этот показатель может показаться скромным, он имеет значение для женщин, ранее считавшихся невосприимчивыми к стандартным протоколам ЭКО.
Следует учитывать, что, хотя у женщин, участвовавших в данном исследовании, было несколько неудачных циклов ЭКО, их возраст не превышал 40 лет. Показатель 25% может быть не применим к женщинам более старшего возраста. Однако женщины, участвовавшие в исследовании в Греции, прошли однократную процедуру забора ооцитов, и в большинстве случаев их количество было очень ограниченным. В Центре ЭКО Северного Кипра мы обычно стремимся получить как можно больше ооцитов посредством нескольких заборов яйцеклеток, особенно у пациенток старше 43 лет, чтобы повысить шансы на успех.
Процесс лечения в Центре ЭКО на Северном Кипре
Поскольку у женщин пожилого возраста количество и качество яйцеклеток, как правило, снижаются одновременно, большинству кандидатов потребуется два или более цикла забора яйцеклеток, чтобы накопить достаточное количество зрелых ооцитов для МРТ. Вот как происходит этот процесс:
1. Стимуляция яичников и заморозка яйцеклеток
ЭКаждый цикл забора яйцеклеток включает стимуляцию и забор яйцеклеток, а затем их витрификацию. Процедуру можно повторять по мере необходимости (обычно 2–3 раза) в зависимости от реакции яичников. У нас есть пациентки, которые получают 9–10 ооцитов за один цикл, а есть и те, которым требуется 4–5 заборов ооцитов, прежде чем будет получено оптимальное количество. Некоторые пациентки предпочитают получить до 15–16 ооцитов, чтобы получить несколько эмбрионов, которые потенциально могут стать основой для будущего проекта по созданию семьи.
2. Координация свежей донорской яйцеклетки
После заморозки достаточного количества яйцеклеток пациента свежие донорские ооциты подготавливаются к процедуре МРТ. Наличие свежих яйцеклеток крайне важно, поскольку при замораживании ухудшается целостность митохондрий и цитоплазматическая активность.
3. МРТ и создание эмбрионов
Процедура МРТ проводится методом переноса материнского веретена деления с последующим ИКСИ для оплодотворения реконструированных ооцитов. Эмбрионы культивируются до стадии бластоцисты и замораживаются для последующего переноса. Доктор Шухрат Миталипов обычно посещает Кипр два раза в год (один раз в июле и один раз в декабре), и именно в это время, как ожидается, будут проводиться процедуры. В зависимости от количества пациентов, в график может быть добавлена третья процедура МРТ.
4. Подготовка эндометрия и перенос эмбрионов
В отдельном цикле матка пациентки гормонально подготавливается к имплантации эмбриона. После подтверждения толщины эндометрия и его восприимчивости проводится перенос замороженного эмбриона (ПЗЭ).
Сроки и логистика для иностранных пациентов
Большинство наших пациентов, проходящих МРТ, приезжают из-за границы, и мы обеспечиваем гибкий график, координируя первоначальное обследование удаленно:
• Стимуляция яичников и предварительный мониторинг (гормоны, сканирование) могут проводиться на месте под нашим руководством.
• Для каждого забора яйцеклеток вам нужно будет только приезжать на Кипр, обычно требуя пребывания в течение 3–5 дней.
• После завершения МРТ и заморозки эмбрионов необходима отдельная поездка продолжительностью 2 дня для окончательного переноса эмбрионов.
Стоимость и планирование
Общая стоимость МРТ-терапии зависит от количества необходимых циклов забора яйцеклеток. В среднем пациенты проходят два забора яйцеклеток, что составляет около 14 000 евро. Стоимость включает:
• Два протокола забора яйцеклеток и приема лекарств
• Витрификация и хранение ооцитов
• Закупка свежих донорских яйцеклеток
• Процедура МРТ (перенос веретена и создание эмбриона)
• Культивирование бластоцист и заморозка
• Окончательный перенос замороженного эмбриона с подготовкой эндометрия
Каждая дополнительная процедура забора ооцитов стоит 2500 евро. В некоторых случаях пациентки часто выбирают процедуру PRP-терапии яичников и экзосомной терапии между циклами, чтобы улучшить количество и качество ооцитов для последующего забора.
Является ли совпадение гаплогрупп проблемой?
В настоящее время мы не проводим отбор доноров митохондрий на основе соответствия материнской гаплогруппы. Хотя концепция совместимости гаплогрупп обсуждалась в научной литературе, клиническая значимость митоядерного несовпадения остается теоретической и не было доказано, что оно влияет на развитие эмбриона, имплантацию или раннее постнатальное здоровье в случаях МРТ у человека. Как в моделях на людях, так и на нечеловекообразных приматах, включая те, что были выполнены командой доктора Миталипова, несовпадение гаплогрупп не приводило к неблагоприятным последствиям развития (Tachibana et al., 2009, Nature; Zhang et al., 2017). Хотя долгосрочное, многопоколенное отслеживание митоядерных взаимодействий у людей все еще продолжается, современные данные свидетельствуют о том, что краткосрочные и среднесрочные результаты развития не страдают от несовпадения гаплогрупп (Mitalipov & Wolf, Nat Rev Mol Cell Biol, 2014).
Более того, определение гаплогруппы не является стандартным, валидированным скрининговым тестом в программах донорства яйцеклеток и недоступно для рутинного клинического применения. Наша основная задача — отбор доноров с отличным качеством ооцитов, здоровой функцией митохондрий и клиническим скринингом на генетические и инфекционные заболевания, которые оказывают наибольшее влияние на результаты лечения.
Исследования, в том числе проведенные под руководством доктора Миталипова, показали, что эмбрионы, созданные с использованием несовпадающих митохондриальных гаплогрупп (например, из разных этнических групп или родословных), могут нормально развиваться и приводить к здоровым родам.
Почему стоит выбрать МРТ вместо донорства яйцеклеток?
МРТ предоставляет женщинам уникальную возможность зачать ребёнка, используя собственный генетический материал, даже если качество яйцеклеток значительно снизилось с возрастом. В отличие от донорства яйцеклеток, которое приводит к рождению генетически неродственного ребёнка, МРТ сохраняет материнскую ядерную ДНК, то есть ваш ребёнок является носителем вашей генетической наследственности.
Что делать, если МРТ не поможет? Можно ли пройти тандемный цикл ЭКО?
Да, конечно, вы можете пройти тандемный цикл ЭКО параллельно с лечением МРТ, и на самом деле мы активно рекомендуем это в определенных клинических ситуациях.
При заместительной митохондриальной терапии (ЗМТ) используется только цитоплазматический компонент (митохондрии) донорской яйцеклетки, в то время как ваш собственный ядерный генетический материал сохраняется. Поскольку рожденный ребенок будет генетически вашим, фенотипическое соответствие с донором в циклах ЗМТ не требуется. Митохондрии донора выполняют исключительно функциональные функции и не влияют на физические черты или личностные характеристики.
Однако в случаях, когда мы ожидаем меньшей вероятности успеха, например, из-за очень низкого выхода яйцеклеток или значительного снижения качества ооцитов, тандемный цикл ЭКО можно рассматривать как запасной вариант. Это означает, что мы проводим одновременно цикл ЭКО с использованием донорских ооцитов и ваш цикл МРТ. Преимущество такого подхода заключается в создании двух отдельных групп эмбрионов:
• Одна группа, полученная из вашего собственного генетического материала с помощью МРТ
• Другая группа, полученная из донорских яйцеклеток.
Как тандемное ЭКО работает совместно с МРТ?
• Для получения ооцитов для МРТ проводится стимуляция и забор яичников.
• Параллельно мы координируемся с подходящим донором для цикла донорства свежих яйцеклеток.
• Ваши ооциты подвергаются переносу материнского веретена (MST) и оплодотворяются с помощью ИКСИ.
• Донорские ооциты оплодотворяются спермой вашего партнера (или выбранного донора) для создания второго набора эмбрионов.
• Все эмбрионы культивируются до стадии бластоцисты, на этом этапе:
• Для немедленного переноса можно выбрать один или несколько эмбрионов, полученных путем МРТ или ЭКО-донора.
• Оставшиеся эмбрионы из любой группы можно витрифицировать (заморозить) и сохранить для использования в будущем.
Главное преимущество тандемного подхода заключается в сохранении полной гибкости. В зависимости от качества эмбрионов и ваших предпочтений в отношении лечения вы можете:
• Выберите перенос только собственного эмбриона (полученного с помощью МРТ)
• Выберите перенос эмбриона донорской яйцеклетки
• Или выберите перенос двух эмбрионов, по одному из каждой группы, хотя в этом случае вероятность рождения близнецов выше.
Оставшиеся эмбрионы можно безопасно заморозить для будущих циклов, что даст вам возможность выбора в будущем без необходимости повторять стимуляцию или поиск подходящего донора.
Тандемное ЭКО обеспечивает:
• Гарантия и поддержка на случай, если эмбрионы МРТ не будут развиваться оптимально
• Более высокие совокупные показатели наступления беременности за счет увеличения пула жизнеспособных эмбрионов или просто душевного спокойствия, поскольку имеются эмбрионы, доступные для переноса, если собственные яйцеклетки не сработают.
• Эффективность времени, поскольку обе стратегии выполняются в одном окне лечения
• Финансовая эффективность, поскольку вам не придется проходить дополнительный отдельный цикл ЭКО с использованием донорских ооцитов, что повлечет за собой более высокие затраты.
Готовы узнать больше?
Если вам сказали, что ваши шансы на успех с собственными яйцеклетками слишком низки, или если у вас было несколько неудачных попыток ЭКО, МРТ может стать для вас новым шансом стать родителями. Свяжитесь с нами, чтобы записаться на консультацию или начать обследование.
Центр ЭКО на Северном Кипре
Центр ЭКО на Северном Кипре - это клиника по лечению бесплодия, ориентированная на пациентов, расположенная в «Элитный исследовательский и хирургический госпиталь» в Никосии, Кипр. Наша клиника является одной из самых передовых клиник по лечению бесплодия в мире, предлагающей более широкий выбор вариантов лечения по доступным ценам.
Главная
Телефон
Английский: +90 548 875 8000
Французский: +90 548 876 8000
Турецкий: +90 542 869 8000
Арабский: +90 548 875 8000
Немецкий: +90 548 830 1987
Русский: +90 548 828 9955
Электронная почта
info@northcyprusivf.net
© 2020 LowCostIVF - Все права защищены. политика конфиденциальности