- О нас
- Блог
- Бесплодие
- ЭКО лечение
- Новые достижения ЭКО
- Лечение ЭКО на Кипре
- ЭКО для женщин старше 40 лет
- ЭКО для женщин старше 50 лет
- ВМИ
- Мини ЭКО
- ЭКО + ИКСИ
- Цитоплазматическое ЭКО
- Тандемный цикл ЭКО
- Пожертвование яйцеклеток
- Донорство эмбрионов
- Донорство спермы
- Пол – Выбор пола
- Гестационное суррогатное материнство
- Суррогатное материнство однополых геев
- Хирургическое извлечение спермы
- Преимплантационная генетическая диагностика ПГД
- Заморозка яиц
- Выбор пола с использованием донорских яйцеклеток
- Профилактика серповидноклеточной анемии
- Часто задаваемые вопросы
- Путешествовать
- О нас
- Блог
- Бесплодие
- ЭКО лечение
- Новые достижения ЭКО
- Лечение ЭКО на Кипре
- ЭКО для женщин старше 40 лет
- ЭКО для женщин старше 50 лет
- ВМИ
- Мини ЭКО
- ЭКО + ИКСИ
- Цитоплазматическое ЭКО
- Тандемный цикл ЭКО
- Пожертвование яйцеклеток
- Донорство эмбрионов
- Донорство спермы
- Пол – Выбор пола
- Гестационное суррогатное материнство
- Суррогатное материнство однополых геев
- Хирургическое извлечение спермы
- Преимплантационная генетическая диагностика ПГД
- Заморозка яиц
- Выбор пола с использованием донорских яйцеклеток
- Профилактика серповидноклеточной анемии
- Часто задаваемые вопросы
- Путешествовать
ЭКО для женщин старше 40 лет
ЭКО для женщин старше 40 лет: реалистичные, но обнадеживающие пути вперед
Понимание ландшафта:
С возрастом у женщин, особенно после 40 лет, наблюдается заметное снижение фертильности. Это обусловлено главным образом тем, что женщины рождаются с ограниченным числом фолликулов, а их количество и качество со временем снижаются из-за кумулятивного окислительного стресса, митохондриальной дисфункции и мейотических нарушений (te Velde and Pearson, 2002).
Согласно данным крупных регистров, частота живорождения при использовании недонорских яйцеклеток снижается с примерно 26% в возрасте 38–40 лет до примерно 13% в возрасте 41–42 лет и до менее 5% после 42 лет (SART, 2023). Диаграмма ниже показывает приблизительную оценку резерва яичников у средней женщины на протяжении репродуктивного возраста:
Рисунок 1: Возраст и женский овариальный резерв
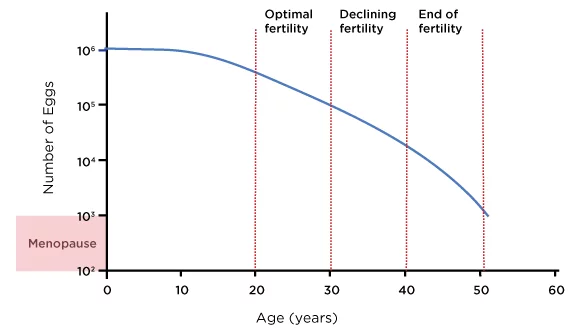
Источник: Озигит, А. и Озигит, С., 2018. Руководство по ЭКО: что вам нужно знать о фертильности, бесплодии и доступных вариантах лечения. 1-е изд. Ирвайн, Калифорния: Universal Publishers, рисунок 1.
Тем не менее, овариальный резерв и реакция яичников различаются у разных женщин, и некоторые женщины сохраняют более высокий репродуктивный потенциал до сорока с небольшим лет. Поэтому для выбора наиболее подходящей стратегии необходима индивидуальная оценка, включающая подсчет количества антральных фолликулов (АФ), анализ на антимюллеров гормон (АМГ) и анализ результатов предыдущих циклов ЭКО (Broer et al., 2014).
Банк ооцитов или эмбрионов: создание собственной «страховочной сети»
Одним из практических подходов к повышению совокупной успешности является банк ооцитов или эмбрионов. Многократное проведение циклов стимуляции и извлечения ооцитов позволяет накопить большее количество ооцитов (или эмбрионов), тем самым увеличивая вероятность успешной беременности. Было показано, что витрификация ооцитов обеспечивает показатели выживаемости и оплодотворения, сопоставимые со свежими ооцитами (Cobo et al., 2016), без повышения риска врожденных аномалий (Noyes et al., 2009). Таким образом, многократное извлечение ооцитов может обеспечить количество ооцитов, недостижимое при процедуре извлечения одной яйцеклетки.
Хотя частота наступления беременности и живорождения у женщин старше 40 лет в рамках одного цикла лечения относительно невысока, важно помнить, что эти показатели рассчитываются на каждый цикл. При проведении нескольких циклов и объединении результатов общая вероятность наступления беременности и живорождения может значительно увеличиться. Этот подход также позволяет провести преимплантационное генетическое тестирование на анеуплоидии (ПГТ-А), которое может помочь выявить эмбрионы с нормальным хромосомным набором и дополнительно повысить шансы на успех (Doyle et al., 2016).
Банк ооцитов может быть ещё более эффективным в сочетании с другими современными достижениями репродуктивной медицины, которые потенциально могут улучшить результаты цикла. Среди них: лечение PRP-терапией яичников и современная технологическая инновация, известная как Митохондриальная заместительная терапия (МРТ). Внедрение таких подходов в банк ооцитов может улучшить качество и потенциал развития собранных яйцеклеток, тем самым увеличивая количество жизнеспособных эмбрионов, доступных для переноса. При стратегическом применении эти методы могут дополнить преимущества банка ооцитов, не только расширяя пул хранимых ооцитов, но и оптимизируя их репродуктивный потенциал, что в конечном итоге повышает вероятность успешного наступления беременности.
Овариальная плазма, богатая тромбоцитами (PRP)
Овариальная PRP предполагает введение аутологичного тромбоцитарного концентрата в яичники с целью стимуляции локальных факторов роста, которые могут усилить привлечение фолликулов. Исследования, проведенные среди пациенток с низким ответом на терапию, включая женщин старшего репродуктивного возраста, показали улучшение показателей АМГ, ЧАФ и качества бластоцисты, а также несколько случаев живорождения (Sfakianoudis et al., 2019). Недавнее исследование продемонстрировало значительное увеличение выхода пригодных для использования бластоцист после PRP у женщин с предшествующими эмбрионами низкого качества (Yu et al., 2025). Хотя PRP пока не является стандартом лечения, она является разумным дополнением для отдельных пациенток, желающих оптимизировать потенциал собственных яйцеклеток.
Терапия PRP для яичников – гораздо более сложная процедура, чем простое введение богатой тромбоцитами плазмы в яичники в надежде на улучшение. Её успех зависит от тщательно разработанных протоколов, которые начинаются с правильной подготовки тромбоцитов, включая контролируемую инактивацию для предотвращения преждевременной активации и истощения факторов роста до достижения целевой ткани. Концентрация и плотность тромбоцитов должны быть оптимизированы для обеспечения терапевтически значимой дозы, поскольку субоптимальные или слишком разбавленные препараты могут не обеспечить желаемого регенеративного стимула. Не менее важна точность инъекции с целью нацеливания на конкретные анатомические области яичника, где развитие фолликулов, скорее всего, будет способствовать усилению васкуляризации, клеточной сигнализации и поддержке микросреды. После процедуры необходим индивидуальный режим приема добавок для поддержания и поддержки процесса оогенеза, обеспечивая благоприятную биохимическую и гормональную среду для набора, роста и созревания фолликулов. В совокупности эти факторы превращают PRP-терапию из простой инъекции в научно обоснованное и потенциально преобразующее вмешательство в функцию яичников.
Митохондриальная заместительная терапия (МРТ)
Заместительная митохондриальная терапия (ЗМТ) — это новая репродуктивная технология, направленная на восстановление биоэнергетической емкости ооцитов путем их дополнения здоровыми донорскими митохондриями. Этот подход напрямую решает одну из наиболее значимых возрастных проблем женской репродуктивной системы: прогрессирующее снижение функции митохондрий, которое тесно связано со снижением зрелости ооцитов и нарушением эмбрионального развития (St. John et al., 2019).
Вводя функциональные митохондрии в ооцит, МРТ направлена на улучшение продукции АТФ, оптимизацию клеточной среды для мейотического деления и повышение потенциала развития образующихся эмбрионов. Хотя клиническое применение метода относительно новое (Северокипрский центр ЭКО — одно из немногих клинических учреждений, предлагающих эту услугу), ранние исследования на людях и доклинические исследования продемонстрировали обнадеживающие результаты, особенно у пациентов с рецидивирующей задержкой развития эмбрионов в анамнезе или низким качеством эмбрионов (Zhang et al., 2017).
Доктор Шухрат Миталипов и его коллеги были на переднем крае исследований МРТ, продемонстрировав как на животных моделях, так и на человеческих ооцитах, что перенос здоровых митохондрий может исправить биоэнергетический дефицит и привести к улучшению результатов оплодотворения и развития эмбриона, поддерживая обоснование ее целевого использования в случаях митохондриальной недостаточности, связанной с возрастом или заболеванием (Kang et al., 2016).
Комбинированные стратегии: банк ооцитов, PRP-терапия яичников и МРТ
Для некоторых пациенток, особенно с анамнезом неудачных циклов из-за плохого развития эмбриона, комплексная стратегия, сочетающая банк ооцитов, овариальную PRP и заместительную терапию митохондриями, может обеспечить наибольший потенциал для улучшения результатов. Этот многогранный подход нацелен на старение ооцитов с нескольких направлений. Банк ооцитов позволяет получить избыточные ооциты, что было бы невозможно при заборе одной яйцеклетки в цикле ЭКО. Овариальная PRP направлена на улучшение фолликулярной среды и содействие более здоровому набору фолликулов в цикле забора яйцеклеток, в то время как заместительная терапия митохондриями работает над восстановлением оптимальной биоэнергетики ооцитов и улучшением потенциала развития эмбриона. В совокупности эти вмешательства влияют как на выработку клеточной энергии, так и на микросреду яичников, два важнейших фактора, определяющих репродуктивный успех при возрастном бесплодии (Labarta et al., 2019).
****
Эти стратегии разработаны для повышения вероятности наступления беременности с использованием собственного генетического материала женщины, что позволяет иметь биологического ребёнка. Хотя такие вмешательства могут существенно повысить шансы на успех по сравнению со стандартным циклом ЭКО, они всё же могут быть сопряжены со значительными финансовыми затратами и не могут гарантировать высокую вероятность успеха, особенно в случаях пожилого возраста матери или сниженного овариального резерва. Для пар или отдельных лиц, не желающих рассматривать возможность использования донорских яйцеклеток, эти подходы могут значительно повысить шансы на рождение биологического ребёнка. Однако, если главной целью является наступление беременности и рождение ребёнка независимо от наличия генетической связи с предполагаемой матерью, альтернативные варианты, такие как тандемный цикл ЭКО или прямое использование донорских яйцеклеток, могут обеспечить значительно более высокие показатели успеха, особенно для женщин старше 40 лет.
Тандемный цикл ЭКО
Тандемный цикл ЭКО Это подход к лечению, при котором пациентка проходит стимуляцию яичников для получения собственных яйцеклеток с одновременным использованием донорских яйцеклеток в одном цикле лечения. Оба набора яйцеклеток оплодотворяются отдельно, и из каждого источника создаются эмбрионы. Это позволяет будущим родителям попытаться зачать ребёнка, используя собственный генетический материал пациентки, одновременно получая высококачественные донорские эмбрионы в одном цикле. Эмбрионы из обоих источников можно культивировать до стадии бластоцисты, при необходимости провести генетическое тестирование и сохранить для дальнейшего использования. Этот подход даёт уникальное преимущество: максимально повышаются шансы на успешный исход в течение одного цикла лечения при сохранении биологической связи с будущей матерью.
Донорская яйцеклетка ЭКО
Донорская яйцеклетка ЭКО Метод предполагает использование ооцитов от здорового, проверенного донора, которые оплодотворяются спермой предполагаемого отца или донора. Поскольку качество яйцеклеток во многом зависит от возраста и репродуктивного здоровья донора, а не предполагаемой матери, такой подход значительно повышает вероятность получения высококачественных эмбрионов и успешного наступления беременности. ЭКО с использованием донорской яйцеклетки особенно ценно для женщин старшего репродуктивного возраста, женщин с существенно сниженным овариальным резервом или тех, чьи предыдущие циклы ЭКО с собственными яйцеклетками оказались неудачными. Полученный в результате ребенок будет иметь генетическую связь с источником спермы, но не с реципиентом яйцеклетки, хотя опыт беременности и связь матери и плода полностью сохраняются.
Практические советы для женщин старше 40 лет
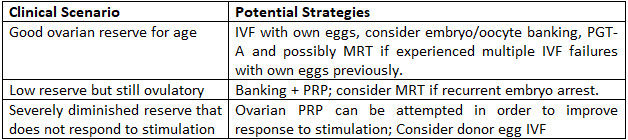
Ключевые выводы
- – Успех с собственными яйцами свыше 40 возможен, но сложен; важны реалистичные ожидания.
- – Банк ооцитов/эмбрионов может повысить совокупные шансы и позволить провести генетический скрининг.
- – МРТ и ПРП являются перспективными дополнительными методами в отдельных случаях.
- – Донорские яйцеклетки обеспечивают самые высокие показатели успеха, и их следует обсуждать как можно раньше, если прогноз неблагоприятный.
- Пожалуйста связаться с нами для получения дополнительной информации и индивидуальных рекомендаций.
Рекомендации
- Броер, С.Л., Брукманс, Ф.Дж., Лавен, Дж.С. и Фаузер, Б.К., 2014. Антимюллеров гормон: определение овариального резерва и его потенциальное клиническое значение. Human Reproduction Update, 20(5), стр. 688–701.
- Кобо, А., Гарсия-Веласко, Х., Коэльо, А., Доминго, Х., Пеллисер, А. и Ремохи, Х., 2016. Витрификация ооцитов как эффективный метод сохранения фертильности. Фертильность и стерильность, 105(3), стр. 755–764.
- Деврои, П., Фаузер, Б. К. и Дидрих, К., 2011. Подходы к улучшению диагностики и лечения бесплодия. Human Reproduction Update, 17(5), стр. 455–467.
- Дойл, Дж. О., Рихтер, К. С., Лим, Дж., Стиллман, Р. Дж., Грэм, Дж. Р. и Такер, М. Дж., 2016. Успешная плановая и медицински обоснованная витрификация и нагревание ооцитов для аутологичного экстракорпорального оплодотворения с прогнозируемой вероятностью рождения при сохранении фертильности в зависимости от количества криоконсервированных ооцитов и возраста на момент извлечения. Фертильность и бесплодие, 105(2), стр. 459–466.
- Лабарта Э., де лос Сантос М.Дж., Эскриба М.Дж., Пеллисер А. и Херрайс С., 2019. Митохондрии как инструмент омоложения ооцитов. Фертильность и бесплодие, 111(2), стр. 219–226.
- Нойес, Н., Порку, Э. и Борини, А., 2009. Более 900 младенцев, рожденных после криоконсервации ооцитов, не имели видимого увеличения числа врожденных аномалий. Reproductive BioMedicine Online, 18(6), стр. 769–776.
- Полсон, Р. Дж., Хэтч, И. Э., Лобо, Р. А. и Зауэр, М. В., 2002. Кумулятивные показатели успешности беременности после донорства ооцитов: влияние на восприимчивость эндометрия. Репродукция человека, 17(5), стр. 1411–1416.
- Зауэр, М.В., 1990. Предварительный отчет о донорстве ооцитов, расширяющем репродуктивный потенциал женщин старше 40 лет. New England Journal of Medicine, 323(17), стр.1157–1160.
- Сфакианудис, К., Симопулу, М., Ницос, Н. и др., 2019. Лечение аутологичной плазмой, богатой тромбоцитами, позволяет женщине забеременеть при преждевременной менопаузе. Клинические случаи в женском здоровье, 23, e00129.
- Силлс, Э.С., Рикерс, Н.С., Ли, Х. и Палермо, Г.Д., 2020. Первые данные об экстракорпоральном оплодотворении после интраовариальной инъекции активированной глюконатом кальция аутологичной богатой тромбоцитами плазмы. Гинекологическая эндокринология, 36(6), стр. 479–482.
- Сент-Джон, Дж. К., Факучо-Оливейра, Дж., Цзян, И., Келли, Р. и Салах, Р., 2019. Передача, репликация и наследование митохондриальной ДНК: путь от гаметы через эмбрион к потомству и эмбриональным стволовым клеткам. Human Reproduction Update, 26(1), стр. 1–35.
- Ю, Т.Н., Ван, Х.Й., Ли, Т.Х. и др., 2025. Интраовариальная инъекция богатой тромбоцитами плазмы значительно улучшает выход бластоцист у пациенток, проходящих ЭКО, с предшествующим низким качеством эмбрионов. Scientific Reports, 15, 81234.
- Чжан, Цз., Лю, Х., Ло, С. и др., 2017. Живорождение с помощью переноса веретена деления ооцита для профилактики митохондриальных заболеваний. Reproductive BioMedicine Online, 34(4), стр. 361–368.
Центр ЭКО на Северном Кипре
Центр ЭКО на Северном Кипре - это клиника по лечению бесплодия, ориентированная на пациентов, расположенная в «Элитный исследовательский и хирургический госпиталь» в Никосии, Кипр. Наша клиника является одной из самых передовых клиник по лечению бесплодия в мире, предлагающей более широкий выбор вариантов лечения по доступным ценам.
Главная
Телефон
Английский: +90 548 875 8000
Французский: +90 548 876 8000
Турецкий: +90 542 869 8000
Арабский: +90 548 875 8000
Немецкий: +90 548 830 1987
Русский: +90 548 828 9955
Электронная почта
info@northcyprusivf.net
© 2020 LowCostIVF - Все права защищены. политика конфиденциальности


