- معلومات عنا
- مدونة
- العقم
- علاجات أطفال الأنابيب
- التطورات الجديدة في عمليات التلقيح الصناعي
- العلاج باستبدال الميتوكوندريا!
- علاج أطفال الأنابيب في قبرص
- أطفال الأنابيب للنساء فوق سن الأربعين
- التلقيح الصناعي للنساء فوق سن الخمسين
- IUI
- التلقيح الاصطناعي المصغر
- أطفال الأنابيب + الحقن المجهري
- التلقيح الاصطناعي السيتوبلازمي
- دورة التلقيح الاصطناعي الترادفية
- التبرع بالبويضات
- التبرع بالجنين
- التبرع بالحيوانات المنوية
- الجنس - اختيار الجنس
- تأجير الأرحام الحملي
- تأجير الأرحام مثلي الجنس من نفس الجنس
- سحب الحيوانات المنوية جراحيًا
- التشخيص الجيني قبل الزرع PGD
- تجميد البويضات
- اختيار الجنس باستخدام بيض المتبرع
- الوقاية من مرض فقر الدم المنجلي
- التعليمات
- يسافر
- معلومات عنا
- مدونة
- العقم
- علاجات أطفال الأنابيب
- التطورات الجديدة في عمليات التلقيح الصناعي
- العلاج باستبدال الميتوكوندريا!
- علاج أطفال الأنابيب في قبرص
- أطفال الأنابيب للنساء فوق سن الأربعين
- التلقيح الصناعي للنساء فوق سن الخمسين
- IUI
- التلقيح الاصطناعي المصغر
- أطفال الأنابيب + الحقن المجهري
- التلقيح الاصطناعي السيتوبلازمي
- دورة التلقيح الاصطناعي الترادفية
- التبرع بالبويضات
- التبرع بالجنين
- التبرع بالحيوانات المنوية
- الجنس - اختيار الجنس
- تأجير الأرحام الحملي
- تأجير الأرحام مثلي الجنس من نفس الجنس
- سحب الحيوانات المنوية جراحيًا
- التشخيص الجيني قبل الزرع PGD
- تجميد البويضات
- اختيار الجنس باستخدام بيض المتبرع
- الوقاية من مرض فقر الدم المنجلي
- التعليمات
- يسافر
العلاج باستبدال الميتوكوندريا
تقنية طبية جديدة رائدة
العلاج باستبدال الميتوكوندريا (MRT) في مركز شمال قبرص لأطفال الأنابيب
بالتعاون مع الدكتور شوخرات ميتاليبوف – رواد مستقبل الخصوبة
في مركز شمال قبرص لأطفال الأنابيب، نفخر بالتعاون مع الدكتور شوخرات ميتاليبوف، أحد أبرز خبراء العالم في علم الوراثة الإنجابية وعلم أحياء الميتوكوندريا. يحظى الدكتور ميتاليبوف بتقدير عالمي لتطويره العلاج باستبدال الميتوكوندريا (MRT)، وهي تقنية متطورة صُممت في الأصل لمنع انتقال أمراض الميتوكوندريا، وتُقدم الآن أملًا جديدًا للنساء اللواتي يعانين من العقم المرتبط بالعمر وفشل التلقيح الصناعي المتكرر.
تسمح لنا هذه الشراكة بتقديم العلاج بالرنين المغناطيسي كعلاج متخصص للخصوبة خارج إطار التجارب السريرية، من خلال الجمع بين خبرة فريق الدكتور ميتاليبوف والخبرة السريرية للدكتور سافاس أوزيجيت والدكتور أحمد أوزيجيت وفريق علم الأجنة في مركز شمال قبرص للتلقيح الاصطناعي، الواقع في مستشفى النخبة.
ما هي الميتوكوندريا؟
الميتوكوندريا هي العضيات المُنتجة للطاقة، والموجودة في كل خلية تقريبًا في الجسم، بما في ذلك البويضات. مع تقدم المرأة في السن، ينخفض عدد الميتوكوندريا ووظائفها، مما يُضعف قدرة البويضة على دعم الإخصاب الطبيعي ونمو الجنين وانغراسه. يُعد هذا الانخفاض أحد الأسباب الرئيسية للعقم المرتبط بالعمر.
تدور الميتوكوندريا في الصحة الخلوية والإنجابية
الميتوكوندريا عضيات ثنائية الغشاء، تُعرف بأنها "مولدات الطاقة" للخلية، إذ تُنتج ثلاثي فوسفات الأدينوزين (ATP)، وهو مصدر الطاقة الأساسي المُستخدم في جميع العمليات الخلوية تقريبًا. ومع ذلك، تلعب الميتوكوندريا أيضًا أدوارًا حيوية في:
• تنظيم موت الخلايا المبرمج
• توازن الكالسيوم
• إدارة أنواع الأكسجين التفاعلية (ROS)
• تكوين الستيرويد وإشارات الخلايا
• نضوج البويضة وتكوين المغزل والتطور الجنيني المبكر
تحتوي كل خلية في البويضات البشرية على ما بين 100 ألف إلى 600 ألف ميتوكوندريا، وهو عدد أكبر بكثير من الخلايا الجسدية النموذجية، مما يؤكد دورها المركزي في الكفاءة الإنجابية (ماي بانلوب وآخرون، 2005).
مع تقدم النساء في العمر، وخاصة بعد سن 35 عامًا، تتعرض وظيفة الميتوكوندريا في البويضات للتدهور التدريجي:
1. انخفاض عدد نسخ الحمض النووي للميتوكوندريا
تعتمد ميتوكوندريا البويضة على نسخ كافية من الحمض النووي للميتوكوندريا (mtDNA) للحفاظ على إنتاج ATP أثناء النضج والإخصاب. تُظهر الدراسات انخفاضًا ملحوظًا في عدد نسخ mtDNA مع التقدم في السن، مما يُضعف توافر الطاقة اللازمة لتكوين المغزل الطبيعي وانفصال الكروموسومات (Fragouli et al., 2015).
2. زيادة طفرات الحمض النووي للميتوكوندريا
يفتقر الحمض النووي للميتوكوندريا إلى الهيستونات الواقية، كما أن آليات إصلاحه محدودة، مما يجعله شديد التأثر بالضرر التأكسدي. مع التقدم في السن، يؤدي التعرض التراكمي لأنواع الأكسجين التفاعلية (ROS) إلى زيادة طفرات الحمض النووي للميتوكوندريا، مما يُضعف التنفس الخلوي للميتوكوندريا ويزيد من تفاقم الإجهاد التأكسدي (Barritt et al., 2002; Wallace, 2013).
3. ضعف إنتاج ATP
تنتج الميتوكوندريا المتقدمة في السن كمية أقل من ATP من خلال الفسفرة التأكسدية، مما يؤدي إلى ظهور بويضات تفتقر إلى الطاقة وتكافح من أجل إكمال الانقسام المنصف أو دعم التكوين الجنيني المبكر (Bentov & Casper, 2013).
4. تغير جهد الغشاء والتجزئة
تظهر الميتوكوندريا المتقدمة في السن فقدانًا لإمكانات الغشاء، وزيادة في التفتت، وتغيرًا في الشكل، مما يؤدي إلى ضعف التمثيل الغذائي للخلايا واستعدادها للموت الخلوي (Wilding et al.، 2001).
5. الارتباط مع اختلال الصيغة الصبغية وضعف جودة الجنين
ارتبط خلل الميتوكوندريا في البويضات بتشوهات المغزل، وسوء انقسام الكروموسومات، وانخفاض معدلات تكوين الكيسة الأريمية (سانتوس وآخرون، 2006). وقد ثبت أن خلل الميتوكوندريا في البويضات يُضعف تجميع المغزل وانقسام الكروموسومات، مما يؤدي إلى أخطاء انقسامية وضعف نمو الجنين، وهي ظاهرة أثبتها الدكتور شوخرات ميتاليبوف وزملاؤه في نماذج الرئيسيات البشرية وغير البشرية (تاتشيبانا وآخرون، 2009، نيتشر).
كيف يتناسب العلاج باستبدال الميتوكوندريا مع هذا؟
صحة الميتوكوندريا ليست مجرد مؤشر على حيوية البويضة، بل هي عاملٌ مُقيّدٌ لنجاح الإنجاب. يهدف علاج استبدال الميتوكوندريا إلى استعادة سيتوبلازم ذي كفاءة حيوية، مما يسمح للحمض النووي النووي للمريضة بالعمل في بيئة خلوية مُجدَّدة.
من خلال استبدال الميتوكوندريا القديمة غير الوظيفية بميتوكوندريا متبرعة صحية، تعالج تقنية MRT السبب الجذري للعقم المرتبط بالعمر على المستوى الخلوي، وهو أمر لا تستطيع تقنية التلقيح الصناعي التقليدية التغلب عليه عندما تكون البيئة السيتوبلازمية للبويضة معرضة للخطر.
تعد تقنية MRT تقنية ثورية تعمل على استبدال الميتوكوندريا غير الطبيعية في بويضة المرأة بميتوكوندريا صحية من بويضة متبرعة، مما يخلق بيئة أكثر قابلية للحياة لتطور الجنين، مع الحفاظ على المادة الوراثية النووية للمرأة.
كيف يعمل MRT؟
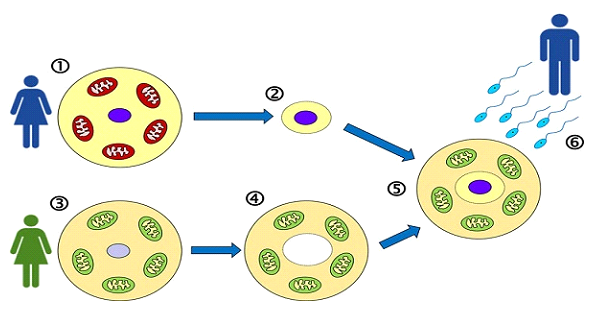
بخلاف النقل السيتوبلازمي، حيث تُحقن كمية صغيرة من سيتوبلازم بويضة المتبرعة في بويضة المريضة، يتضمن النقل بالرنين المغناطيسي نقل الحمض النووي للأم بالكامل إلى بويضة متبرعة منزوعة النواة مع الاحتفاظ بميتوكوندريا سليمة خاصة بها. تُعرف هذه التقنية باسم نقل المغزل الأمومي (MST)، وهي تتيح تصويرًا دقيقًا للمادة الوراثية والتحكم فيها.
خطوات عملية MRT:
• استرجاع البويضات: تخضع المريضة لتحفيز المبيض وجمع البويضات. نظرًا لانخفاض إنتاج البويضات لدى النساء فوق سن الأربعين، قد يلزم إجراء دورات استرجاع متعددة. يتطلب إجراء الرنين المغناطيسي ثلاث بويضات على الأقل من فئة M2. كلما زاد عدد البويضات لدى المريضة، زادت فرص النجاح. تُجمد بويضات المريضة حتى يتم العثور على متبرعة مناسبة وتكون بويضاتها جاهزة للاسترجاع.
• تحضير بويضة المتبرعة: يتم استخراج بويضة المتبرعة وإزالة نواتها بعناية، تاركةً السيتوبلازم مع الميتوكوندريا السليمة والسليمة. تُجرى هذه العملية على بويضات طازجة. لذلك، يُجرى بروتوكول الرنين المغناطيسي على بويضات متبرعة طازجة فقط.
• نقل المغزل: يتم استخراج الحمض النووي للمريضة (المادة الوراثية) ونقله إلى بويضة المتبرعة منزوعة النواة.
• الإخصاب: تُخصب البويضة المُعاد بناؤها، والتي تحتوي الآن على المادة الوراثية للمريضة والميتوكوندريا السليمة للمتبرعة، باستخدام تقنية الحقن المجهري (ICSI). في معظم الحالات، قد لا يكون من الممكن تقديم عينة جديدة من الحيوانات المنوية للمرضى القادمين من الخارج. لذلك، نطلب تقديم عينة من الحيوانات المنوية مسبقًا وحفظها مجمدة استعدادًا لدورة الرنين المغناطيسي.
• نمو الجنين: تُزرع الأجنة الناتجة حتى مرحلة الكيسة الأريمية، ثم تُجمّد (تُزجّج) لنقلها لاحقًا. ولأن بويضات المتبرعة تُستخدم طازجة، ستكون هذه أول محاولة تجميد (رغم أن بويضات المريضة كانت مُجمّدة سابقًا).
• نقل الأجنة: في دورة لاحقة، يخضع المريض لتحضير بطانة الرحم لنقل الأجنة.
يتضمن العلاج باستبدال الميتوكوندريا (MRT) نقل المادة الوراثية النووية من بويضة امرأة إلى بويضة متبرعة ذات ميتوكوندريا سليمة. الهدف هو الحفاظ على الحمض النووي النووي للمريضة مع توفير سيتوبلازم ذي كفاءة حيوية. تُستخدم تقنيتان رئيسيتان لتحقيق ذلك:
1. نقل المغزل الأمومي (MST) - الطريقة المستخدمة في وحدة التلقيح الصناعي لدينا.
يُجرى زرع المغزل المنتصف (MST) في مرحلة البويضة في الطور الاستوائي الثاني (MII)، قبل الإخصاب. يُزال المركب المغزلي الأمومي (المحتوي على الكروموسومات) بعناية من بويضة المريضة غير المخصبة، ويُنقل إلى بويضة متبرعة أُزيل مغزلها الخاص. ثم تُخصب البويضة المُعاد بناؤها بالحيوان المنوي.
هذه الطريقة مثالية لعلاج العقم واختلال وظيفة البويضة المرتبط بالعمر، إذ تتجنب التلاعب بعد الإخصاب. عادةً ما يكون خطر انتقال الميتوكوندريا أقل من 1%، مما يقلل من خطر تكرار أمراض الميتوكوندريا إذا كان مؤشر العلاج بالرنين المغناطيسي هو مرض الميتوكوندريا. أما إذا لم يكن كذلك، فهذا غير ذي صلة.
2. نقل النواة الأولية (PNT)
يُجرى زرع النوى الأولية (PNT) في مرحلة الزيجوت، بعد حدوث الإخصاب. تُزال النوى الأولية (الذكرية والأنثوية) من البويضة المخصبة وتُنقل إلى زيجوت متبرع مُزال منه النوى. تُدرس هذه الطريقة بشكل رئيسي للوقاية من أمراض الميتوكوندريا الوراثية. ومع ذلك، فإن خطر انتقال الميتوكوندريا أعلى من MST (~2–5%)، حسب التقنية.
لماذا يعتبر نقل المغزل متفوقًا في تطبيقات الخصوبة؟
الاعتبارات الأخلاقية والقانونية
يتجنب نقل الأجنة (MST) تكوين الأجنة وتدميرها، لأنه يحدث قبل الإخصاب. وهذا ما جعله أكثر قبولاً أخلاقياً وقانونياً في العديد من الولايات القضائية مقارنةً بنقل الأجنة (PNT). يتضمن نقل الأجنة (PNT) التلاعب بالزيجوت المخصب، مما يثير مخاوف أخلاقية حيوية أكثر جدية.
انتقال الميتوكوندريا السفلي
يُظهر MST باستمرار انخفاضًا في انتقال الحمض النووي للميتوكوندريا، مما يُقلل من خطر انتقال الطفرات الميتوكوندريا إلى النسل. أظهر ميتاليبوف وآخرون (2009، 2016) أن MST أدى إلى وجود الحمض النووي للميتوكوندريا غير القابل للكشف أو المهمل من البويضة الأصلية، بينما قد يحمل PNT كميات أكبر من الحمض النووي للميتوكوندريا المعيب بسبب الاختلاط السيتوبلازمي.
انخفاض خطر مشاكل إعادة البرمجة الجينية
لأن MST يحدث قبل الإخصاب، فإن إعادة التشكيل الجيني تحدث داخل بيئة سيتوبلازمية واحدة، مما قد يؤدي إلى تعبير جيني أكثر استقرارًا خلال مرحلة التخلق الجنيني. في المقابل، يجمع PNT بين النوى المخصبة مسبقًا وسيتوبلازم غريب، مما قد يؤدي إلى تنافر جيني أو تأخير إعادة البرمجة.
نتائج أفضل لنمو الجنين
في دراسات أُجريت على البويضات والأجنة البشرية، بما في ذلك دراسات تاتشيبانا وآخرون (2013) وتشانغ وآخرون (2017)، أظهرت أجنة MST كفاءة نمو أعلى ومعدلات تجزئة أقل من الأجنة المشتقة من PNT. كما استُخدمت MST بشكل أيسر في تطبيقات الخصوبة، كما هو الحال في أول ولادة حية باستخدام MST في اليونان (2019)، والتي شملت مريضة تعاني من فشل متكرر في التلقيح الاصطناعي.
من هو المرشح لعملية MRT؟
يتم أخذ العلاج بالرنين المغناطيسي في الاعتبار في السيناريوهات السريرية التالية:
• النساء اللاتي يعانين من خلل موثق في الميتوكوندريا أو علامات تشير إلى ضعف جودة سيتوبلازم البويضة
• المرضى في سن الأم المتقدمة (عادةً >40 عامًا) الذين يعانون من فشل متكرر في التلقيح الصناعي بسبب عوامل متعلقة بالبويضة
• النساء اللاتي لديهن احتياطي مبيض طبيعي ولكن لديهن ضعف في نمو الجنين أو معدلات الإخصاب مما يشير إلى قصور السيتوبلازم
• الأفراد الذين يبحثون عن طفل مرتبط بيولوجيًا ولكن تم نصحهم سابقًا بالتفكير في التبرع بالبويضات بسبب ضعف جودة البويضات
الخلفية العلمية والنتائج السريرية:
في عام ٢٠١٩، استُخدمت تقنية نقل المغزل الأمومي بنجاح لولادة طفل سليم في اليونان، وذلك من خلال تعاون قاده الدكتور ميتاليبوف. وكانت الأم قد عانت من فشل عدة دورات من التلقيح الصناعي بسبب سوء جودة البويضات. وتُعدّ هذه الحالة إحدى أولى حالات الولادات الحية التي تُستخدم فيها تقنية نقل المغزل الأمومي لعلاج العقم بدلاً من الوقاية من الأمراض الوراثية.
لوحظ معدل نجاح مُبلّغ عنه بلغ 25% في هذه المجموعة، ما يعني أن واحدة من كل أربع نساء فشلن سابقًا في التلقيح الاصطناعي نجحت في الحمل باستخدام العلاج بالرنين المغناطيسي. ورغم أن هذا العدد قد يبدو متواضعًا، إلا أنه مهم للنساء اللواتي كنّ يُعتبرن سابقًا غير مستجيبات لبروتوكولات التلقيح الاصطناعي القياسية.
يجب أن نضع في اعتبارنا أنه على الرغم من أن النساء المشاركات في هذه الدراسة خضعن لدورات إخصاب في المختبر فاشلة متعددة، إلا أن أعمارهن كانت 40 عامًا أو أقل. قد لا ينطبق معدل 25% على النساء في الفئات العمرية المتقدمة. مع ذلك، خضعت النساء في تجربة اليونان لعملية جمع بويضات واحدة، وفي معظم الحالات، كان لديهن عدد محدود جدًا من البويضات. في مركز شمال قبرص لأطفال الأنابيب، نهدف عادةً إلى الحصول على أكبر عدد ممكن من البويضات من خلال عمليات جمع بويضات متعددة، وخاصةً لدى المريضات فوق سن 43 عامًا لتحسين فرص الحمل.
عملية العلاج في مركز شمال قبرص لأطفال الأنابيب
لأن كمية وجودة البويضات تميلان إلى الانخفاض معًا لدى النساء المتقدمات في السن، ستحتاج معظم المرشحات إلى دورتين أو أكثر من عمليات استرجاع البويضات لتجميع عدد كافٍ من البويضات الناضجة لإجراء عملية الرنين المغناطيسي. إليكِ كيفية سير العملية:
1. تحفيز المبيض وتجميد البويضات
هـتتضمن كل دورة استرجاع بويضات تحفيزًا وجمعًا لها، يليه تجميدها. يمكن تكرار ذلك حسب الحاجة (عادةً مرتين إلى ثلاث مرات) حسب استجابة المبيض. لدينا مريضات يحصلن على 9-10 بويضات في دورة واحدة، ولدينا أيضًا مريضات يخضعن لـ 4-5 عمليات استرجاع بويضات قبل الحصول على العدد الأمثل. يفضل بعض المرضى الحصول على ما يصل إلى 15-16 بويضة للحصول على أجنة متعددة قد تسمح بمشروع أخوة مستقبلي.
2. تنسيق بويضات المتبرعة الطازجة
بعد تجميد عدد كافٍ من بويضات المريضة، تُجهّز بويضات جديدة من متبرعة لتتزامن مع إجراء التصوير بالرنين المغناطيسي. تُعد البويضات الطازجة ضروريةً نظرًا لتدهور سلامة الميتوكوندريا والنشاط السيتوبلازمي مع التجميد.
3. الرنين المغناطيسي وتكوين الجنين
يُجرى إجراء تصوير الرنين المغناطيسي باستخدام تقنية نقل المغزل الأمومي، يليه حقن البويضات المُعاد بناؤها بالحقن المجهري (ICSI). تُزرع الأجنة حتى مرحلة الكيسة الأريمية، وتُجمد لنقلها لاحقًا. عادةً ما يسافر الدكتور شوخرات ميتاليبوف إلى قبرص مرتين سنويًا (مرة في يوليو ومرة في ديسمبر)، وهذا هو الموعد المتوقع لإجراء العمليتين. بناءً على عدد المرضى، يمكن إضافة عملية تصوير رنين مغناطيسي ثالثة إلى الجدول.
4. تحضير بطانة الرحم ونقل الأجنة
في دورة منفصلة، يُهيأ رحم المريضة هرمونيًا لاستقبال الجنين. ثم تُجرى عملية نقل الأجنة المجمدة (FET) بعد التأكد من سُمك بطانة الرحم وقدرتها على التقبل.
الجدول الزمني والخدمات اللوجستية للمرضى الدوليين
يسافر معظم مرضانا الذين يخضعون للعلاج بالرنين المغناطيسي من الخارج، ونحن نوفر جدولًا مرنًا من خلال تنسيق الفحص الأولي عن بُعد:
• يمكن إجراء تحفيز المبيض والمراقبة الأولية (الهرمونات والمسح الضوئي) محليًا تحت إشرافنا.
• لن تحتاج إلى السفر إلى قبرص إلا لكل عملية استرجاع بويضة، وهو ما يتطلب عادةً الإقامة لمدة تتراوح من 3 إلى 5 أيام.
• بعد اكتمال عملية التصوير بالرنين المغناطيسي وتجميد الأجنة، يلزم القيام برحلة منفصلة لمدة يومين لنقل الأجنة النهائي.
التكلفة والتخطيط
تعتمد التكلفة الإجمالية لعلاج الرنين المغناطيسي على عدد دورات سحب البويضات المطلوبة. في المتوسط، تخضع المريضات لعمليتي سحب بويضات، مما يجعل التكلفة الإجمالية حوالي 14,000 يورو. ويشمل ذلك:
• استرجاع بويضتين وبروتوكولات العلاج
• تزجيج وتخزين البويضات
• الحصول على بويضات متبرعة طازجة
• إجراء التصوير بالرنين المغناطيسي (نقل المغزل وإنشاء الأجنة)
• زراعة الكيسة الأريمية وتجميدها
• نقل الأجنة المجمدة النهائية مع تحضير بطانة الرحم
تبلغ تكلفة كل عملية استرجاع بويضات إضافية 2500 يورو. في بعض الحالات، غالبًا ما تختار المريضات إجراء علاج البلازما الغنية بالصفائح الدموية (PRP) والإكسوزومات المبيضية بين الدورات لتحسين عدد البويضات وجودتها استعدادًا لعملية الاسترجاع اللاحقة.
هل تطابق المجموعة الوراثية أمر مثير للقلق؟
في الوقت الحالي، لا نُجري اختيارًا لمتبرعي الميتوكوندريا بناءً على مطابقة المجموعة الوراثية الأمومية. ورغم أن مفهوم توافق المجموعة الوراثية قد نوقش في الأدبيات العلمية، إلا أن الأهمية السريرية لعدم توافق الميتوكوندريا والنواة لا تزال نظرية، ولم يُثبت تأثيره على نمو الجنين أو انغراسه أو الصحة المبكرة بعد الولادة في حالات العلاج بالرنين المغناطيسي لدى البشر. في كل من نماذج الرئيسيات البشرية وغير البشرية، بما في ذلك تلك التي أجراها فريق الدكتور ميتاليبوف، لم يُسفر عدم توافق المجموعة الوراثية عن نتائج نمو سلبية (تاتشيبانا وآخرون، 2009، نيتشر؛ تشانغ وآخرون، 2017). وبينما لا يزال التتبع طويل الأمد ومتعدد الأجيال للتفاعلات الميتوكوندريا والنواة لدى البشر مستمرًا، تشير الأدلة الحالية إلى أن نتائج النمو قصيرة إلى متوسطة المدى لا تتأثر بعدم توافق المجموعة الوراثية (ميتاليبوف وولف، نات ريف مول سيل بيول، 2014).
علاوة على ذلك، لا يُعدّ اختبار المجموعة الفردانية اختبار فحص قياسيًا ومعتمدًا في برامج التبرع بالبويضات، ولا يتوفر بشكل روتيني للتطبيق السريري. ينصب تركيزنا الأساسي على اختيار المتبرعات اللاتي يتمتعن بجودة بويضات ممتازة، ووظائف ميتوكوندريا سليمة، والفحص السريري للأمراض الوراثية والمعدية، والتي لها تأثير أكبر على نتائج العلاج.
وقد أظهرت الدراسات، بما في ذلك تلك التي قادها الدكتور ميتاليبوف، أن الأجنة التي تم إنشاؤها باستخدام مجموعات هابلوجية غير متطابقة للميتوكوندريا (على سبيل المثال، من خلفيات أو سلالات عرقية مختلفة) يمكن أن تتطور بشكل طبيعي وتؤدي إلى ولادات صحية.
لماذا تختار MRT بدلاً من التبرع بالبويضات؟
يُتيح التلقيح الصناعي بالرنين المغناطيسي فرصةً فريدةً للنساء للحمل باستخدام جيناتهن الخاصة، حتى مع انخفاض جودة البويضات بشكل ملحوظ بسبب التقدم في السن. بخلاف التبرع بالبويضات، الذي يُنتج طفلًا لا تربطه صلة وراثية، يحتفظ التلقيح الصناعي بالحمض النووي النووي للأم، مما يعني أن طفلكِ يحمل جيناتكِ.
ماذا لو لم ينجح العلاج بالرنين المغناطيسي؟ هل يُمكنني الخضوع لدورة إخصاب في المختبر (IVF) مزدوجة؟
نعم، بالتأكيد، يمكنك الخضوع لدورة التلقيح الاصطناعي المزدوج جنبًا إلى جنب مع علاج الرنين المغناطيسي، وفي الواقع، هذا شيء نوصي به بنشاط في بعض الحالات السريرية.
في العلاج باستبدال الميتوكوندريا (MRT)، يُستخدم المكون السيتوبلازمي (الميتوكوندريا) من بويضة المتبرع فقط، مع الاحتفاظ بمادتكِ النووية الوراثية. ولأن الطفل الناتج سيكون منكِ وراثيًا، فإن التطابق الظاهري مع المتبرع ليس ضروريًا في دورات العلاج باستبدال الميتوكوندريا. ميتوكوندريا المتبرع وظيفية بحتة، ولا تؤثر على السمات الجسدية أو الشخصية.
مع ذلك، في الحالات التي نتوقع فيها انخفاض احتمالية النجاح، على سبيل المثال، بسبب انخفاض إنتاج البويضات أو انخفاض جودة البويضات بشكل كبير، يمكن اعتبار دورة التلقيح الاصطناعي المزدوج كخطة احتياطية. هذا يعني أننا نجري دورة تلقيح اصطناعي متزامنة باستخدام بويضات متبرعة إلى جانب دورة التلقيح الصناعي بالرنين المغناطيسي. هذا يوفر ميزة إنشاء مجموعتين منفصلتين من الأجنة:
• مجموعة واحدة مستمدة من المادة الوراثية الخاصة بك عبر MRT
• مجموعة أخرى مستمدة من بويضات متبرعة.
كيف تعمل تقنية التلقيح الاصطناعي الترادفية جنبًا إلى جنب مع تقنية الرنين المغناطيسي؟
• يتم تحفيز المبيض واسترجاعه للحصول على البويضات لإجراء التصوير بالرنين المغناطيسي.
• وبالتوازي مع ذلك، نقوم بالتنسيق مع متبرعة مناسبة لدورة التبرع بالبويضات الطازجة.
• تخضع بويضاتك لعملية نقل المغزل الأمومي (MST) ويتم تخصيبها عن طريق الحقن المجهري.
• يتم تخصيب بويضات المتبرعة بالحيوانات المنوية لشريكتك (أو المتبرع المختار) لإنشاء مجموعة ثانية من الأجنة.
• يتم تربية جميع الأجنة حتى مرحلة الكيسة الأريمية، وفي هذه المرحلة:
• يمكن اختيار جنين واحد أو أكثر، إما من الرنين المغناطيسي أو التلقيح الصناعي من متبرع، للنقل الفوري.
• يمكن تجميد الأجنة المتبقية من أي من المجموعتين وتخزينها لاستخدامها في المستقبل.
من أهم فوائد العلاج الثنائي الحفاظ على مرونة كاملة. بناءً على جودة الجنين وتفضيلاتكِ العلاجية، يمكنكِ:
• اختر نقل جنينك فقط (المشتق من تقنية الرنين المغناطيسي)
• اختيار نقل جنين بويضة متبرعة
• أو اختيار نقل الأجنة المزدوجة، واحد من كل مجموعة، على الرغم من أن هذا يحمل فرصة أكبر لإنجاب توأم.
يمكن تجميد أي أجنة متبقية بأمان لاستخدامها في دورات مستقبلية، مما يمنحك خيارات في المستقبل دون الحاجة إلى تكرار التحفيز أو مطابقة المتبرع.
يوفر Tandem IVF ما يلي:
• الطمأنينة والمساندة في حالة عدم تطور أجنة الرنين المغناطيسي بشكل مثالي
• ارتفاع معدلات الحمل التراكمية من خلال زيادة مجموعة الأجنة القابلة للحياة أو مجرد راحة البال من وجود الأجنة المتاحة للنقل في حالة عدم نجاح بويضاتنا.
• كفاءة الوقت، حيث يتم تنفيذ كلتا الاستراتيجيتين في نافذة علاج واحدة
• الكفاءة المالية حيث أنك لن تحتاج إلى الخضوع لدورة إضافية منفصلة من التلقيح الاصطناعي باستخدام بويضات متبرعة، وهو ما من شأنه أن يفرض تكلفة أعلى.
هل أنت مستعد لمعرفة المزيد؟
إذا قيل لكِ إن فرص نجاحكِ في الإنجاب باستخدام بويضاتك منخفضة جدًا، أو إذا كنتِ قد عانيتِ من فشل متكرر في التلقيح الصناعي، فقد يوفر لكِ العلاج بالرنين المغناطيسي طريقًا جديدًا للأبوة. تواصلي معنا لحجز استشارة أو لبدء تقييم حالتكِ.
مركز شمال قبرص لأطفال الأنابيب
مركز شمال قبرص لأطفال الأنابيب هو عيادة خصوبة تركز على المريض ، ويقع ضمن “مستشفى النخبة للأبحاث والجراحة"في نيقوسيا، قبرص. تعد عيادتنا واحدة من عيادات الخصوبة الأكثر تقدمًا في العالم، حيث تقدم مجموعة واسعة من خيارات العلاج بأسعار معقولة.
اتصل-بنا
هاتف
إنجليزي: +90 548 875 8000
فرنسي: +90 548 876 8000
اللغة التركية: +90 542 869 8000
عربي: +90 548 875 8000
ألمانية: +90 548 830 1987
الروسية: +90 548 828 9955
بريد إلكتروني
info@northcyprusivf.net
© 2020 LowCostIVF - جميع الحقوق محفوظة. سياسة الخصوصية