- À propos
- Blog
- Infertilité
- Traitements de FIV
- Nouvelles avancées FIV
- Traitement de FIV à Chypre
- FIV pour les femmes de plus de 40 ans
- FIV pour les femmes de plus de 50 ans
- IUI
- Mini FIV
- FIV + ICSI
- FIV cytoplasmique
- Cycle de FIV en tandem
- Don d'ovules
- Don d'embryons
- Don de sperme
- Genre – Sélection du sexe
- GPA gestationnelle
- Gestation pour autrui gay de même sexe
- Récupération chirurgicale de sperme
- Diagnostic Génétique Pré Implantation PGD
- Congélation d'oeufs
- Sélection du sexe à l'aide d'ovules de donneur
- Prévention de la drépanocytose
- FAQ
- Voyage
- À propos
- Blog
- Infertilité
- Traitements de FIV
- Nouvelles avancées FIV
- Traitement de FIV à Chypre
- FIV pour les femmes de plus de 40 ans
- FIV pour les femmes de plus de 50 ans
- IUI
- Mini FIV
- FIV + ICSI
- FIV cytoplasmique
- Cycle de FIV en tandem
- Don d'ovules
- Don d'embryons
- Don de sperme
- Genre – Sélection du sexe
- GPA gestationnelle
- Gestation pour autrui gay de même sexe
- Récupération chirurgicale de sperme
- Diagnostic Génétique Pré Implantation PGD
- Congélation d'oeufs
- Sélection du sexe à l'aide d'ovules de donneur
- Prévention de la drépanocytose
- FAQ
- Voyage
FIV pour les femmes de plus de 40 ans
FIV pour les femmes de plus de 40 ans : des pistes réalistes et prometteuses
Comprendre le paysage :
À mesure que les femmes avancent en âge, notamment au-delà de 40 ans, on observe une baisse marquée de leur fertilité. Cela s'explique principalement par le fait que les femmes naissent avec un nombre limité de follicules, dont la quantité et la qualité diminuent avec le temps en raison du stress oxydatif cumulatif, du dysfonctionnement mitochondrial et des erreurs méiotiques (Velde et Pearson, 2002).
Selon les données d'un important registre, le taux de naissances vivantes issues d'ovules non issus de dons d'ovules passe d'environ 261 TP3T entre 38 et 40 ans à environ 131 TP3T entre 41 et 42 ans, et à moins de 51 TP3T au-delà de 42 ans (SART, 2023). Le diagramme ci-dessous présente une estimation approximative des réserves ovariennes moyennes d'une femme tout au long de sa vie reproductive :
Figure 1 : Âge et réserve ovarienne féminine
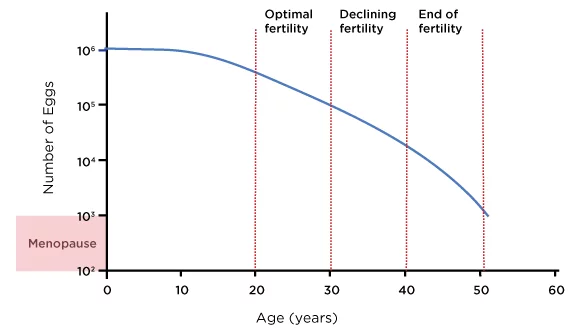
Source: Ozyigit, A. et Ozyigit, S., 2018. Le guide de la FIV : ce que vous devez savoir sur la fertilité, l’infertilité et les options de traitement disponibles. 1re éd. Irvine, Californie : Universal Publishers, figure 1.
Cela dit, la réserve et la réponse ovariennes varient d'une personne à l'autre, et certaines femmes conservent un potentiel reproductif plus élevé jusqu'au début ou au milieu de la quarantaine. Il est donc essentiel de procéder à une évaluation personnalisée par numération des follicules antraux (AFC), dosage de l'hormone antimüllérienne (AMH) et analyse des résultats des cycles de FIV antérieurs pour choisir la stratégie la plus adaptée (Broer et al., 2014).
Banque d'ovocytes ou d'embryons : créez votre propre « filet de sécurité »
Une approche pratique pour améliorer les taux de réussite cumulés est la conservation d'ovocytes ou d'embryons. En effectuant plusieurs cycles de stimulation et de prélèvement, il est possible d'accumuler un plus grand nombre d'ovocytes (ou d'embryons), augmentant ainsi les chances de réussite d'une grossesse. Il a été démontré que la vitrification des ovocytes permet d'obtenir des taux de survie et de fécondation comparables à ceux des ovocytes frais (Cobo et al., 2016), sans risque accru d'anomalies congénitales (Noyes et al., 2009). Par conséquent, les prélèvements multiples d'ovocytes peuvent offrir des résultats impossibles avec un seul prélèvement d'ovocytes.
Bien que les taux de grossesse et de naissance vivante chez les femmes de 40 ans et plus au cours d'un seul cycle de traitement soient relativement modestes, il est important de rappeler que ces chiffres sont calculés par cycle. Lorsque plusieurs cycles sont réalisés et que les résultats sont combinés, la probabilité globale d'obtenir une grossesse et une naissance vivante peut augmenter considérablement. Cette approche offre également la possibilité de réaliser un test génétique préimplantatoire pour l'aneuploïdie (PGT-A), qui peut aider à identifier les embryons présentant un complément chromosomique normal et à améliorer encore les chances de succès (Doyle et al., 2016).
La conservation des ovocytes peut être encore plus efficace lorsqu'elle est associée à d'autres avancées modernes en médecine reproductive susceptibles d'améliorer les résultats du cycle. Parmi celles-ci, on peut citer traitement PRP ovarien et une innovation technologique moderne connue sous le nom de Thérapie de remplacement mitochondrial (MRT). L'intégration de ces approches aux banques d'ovocytes peut améliorer la qualité et le potentiel de développement des ovules collectés, augmentant ainsi le nombre d'embryons viables disponibles pour le transfert. Utilisées de manière stratégique, ces méthodes peuvent compléter les avantages des banques d'ovocytes en élargissant non seulement le nombre d'ovocytes stockés, mais aussi en optimisant leur potentiel reproductif, offrant ainsi de meilleures chances de réussite de grossesse.
Plasma riche en plaquettes ovariennes (PRP)
Le PRP ovarien consiste à injecter un concentré plaquettaire autologue dans les ovaires afin de stimuler les facteurs de croissance locaux susceptibles d'améliorer le recrutement folliculaire. Des études menées auprès de patientes peu répondeuses, notamment des femmes en âge de procréer avancé, ont montré des améliorations de l'AMH, de l'AFC et de la qualité des blastocystes, avec quelques naissances vivantes obtenues (Sfakianoudis et al., 2019). Une étude récente a démontré une augmentation significative du rendement en blastocystes utilisables après PRP chez des femmes ayant déjà eu des embryons de mauvaise qualité (Yu et al., 2025). Bien qu'il ne soit pas encore la norme de soins, le PRP constitue un complément judicieux pour certaines patientes souhaitant optimiser leur potentiel ovarien.
Le traitement ovarien par PRP est une procédure bien plus sophistiquée que la simple injection de plasma riche en plaquettes dans les ovaires en espérant une amélioration. Son succès repose sur des protocoles soigneusement conçus, commençant par une préparation plaquettaire adéquate, incluant une inactivation contrôlée pour prévenir l'activation et la déplétion prématurées des facteurs de croissance avant qu'ils n'atteignent le tissu cible. La concentration et la densité plaquettaires doivent être optimisées pour garantir une dose thérapeutiquement efficace, car des préparations sous-optimales ou trop diluées peuvent ne pas fournir le stimulus régénérateur escompté. La précision de l'injection, ciblant des zones anatomiques spécifiques de l'ovaire où le développement folliculaire est le plus susceptible de bénéficier d'une vascularisation, d'une signalisation cellulaire et d'un soutien microenvironnemental améliorés, est tout aussi cruciale. Après la procédure, une supplémentation sur mesure est essentielle pour soutenir le processus d'ovogenèse, en veillant à ce que l'environnement biochimique et hormonal soit propice au recrutement, à la croissance et à la maturation folliculaires. Ensemble, ces facteurs transforment le traitement par PRP d'une simple injection en une intervention scientifiquement fondée et potentiellement transformatrice pour la fonction ovarienne.
Thérapie de remplacement mitochondrial (TRM)
La thérapie de remplacement mitochondrial (TRM) est une technique de reproduction émergente visant à restaurer la capacité bioénergétique des ovocytes en les supplémentant avec des mitochondries saines de donneurs. Cette approche s'attaque directement à l'un des changements les plus importants liés à l'âge dans la reproduction féminine : le déclin progressif de la fonction mitochondriale, fortement associé à une diminution de la compétence ovocytaire et à un retard de développement embryonnaire (St. John et al., 2019).
En introduisant des mitochondries fonctionnelles dans l'ovocyte, la MRT vise à améliorer la production d'ATP, à optimiser l'environnement cellulaire pour la division méiotique et à optimiser le potentiel de développement des embryons obtenus. Bien que son application clinique soit relativement récente, le Centre de FIV de Chypre du Nord étant l'un des rares établissements cliniques à proposer ce service, les premières études humaines et précliniques ont montré des résultats encourageants, notamment chez les patientes présentant des antécédents d'arrêts récurrents du développement embryonnaire ou de mauvaise qualité embryonnaire (Zhang et al., 2017).
Le Dr Shoukhrat Mitalipov et ses collègues ont été à l'avant-garde de la recherche sur la MRT, démontrant à la fois dans des modèles animaux et des ovocytes humains que le transfert de mitochondries saines peut corriger les déficiences bioénergétiques et conduire à de meilleurs résultats de fécondation et de développement embryonnaire, soutenant la justification de son utilisation ciblée dans les cas d'insuffisance mitochondriale liée à l'âge ou à la maladie (Kang et al., 2016).
Combinaison de stratégies : banque d'ovocytes, traitement ovarien par PRP et MRT
Pour certaines patientes, notamment celles présentant des antécédents d'échecs de cycles dus à un mauvais développement embryonnaire, une stratégie globale associant la conservation d'ovocytes, le PRP ovarien et le traitement de remplacement mitochondrial pourrait offrir le meilleur potentiel d'amélioration des résultats. Cette approche multidimensionnelle cible le vieillissement ovocytaire sous plusieurs angles. La conservation d'ovocytes permet d'obtenir des ovocytes surnuméraires, ce qui serait impossible avec un seul prélèvement d'ovocytes lors d'un cycle de FIV. Le PRP ovarien vise à améliorer l'environnement folliculaire et à favoriser un recrutement folliculaire plus sain lors d'un cycle de prélèvement d'ovocytes, tandis que le traitement de remplacement mitochondrial vise à restaurer une bioénergétique ovocytaire optimale et à améliorer le potentiel de développement embryonnaire. Ensemble, ces interventions agissent sur la production d'énergie cellulaire et le microenvironnement ovarien, deux déterminants essentiels du succès reproductif en cas d'infertilité liée à l'âge (Labarta et al., 2019).
****
Ces stratégies visent à améliorer les chances de grossesse grâce au matériel génétique de la femme, permettant ainsi la naissance d'un enfant biologique. Si ces interventions peuvent considérablement augmenter les chances de réussite par rapport à un cycle de FIV standard, elles peuvent néanmoins entraîner un coût financier important et ne peuvent garantir une probabilité de succès élevée, notamment en cas d'âge maternel avancé ou de réserve ovarienne réduite. Pour les couples ou les personnes qui ne souhaitent pas recourir au don d'ovules, ces approches peuvent néanmoins améliorer significativement les chances d'avoir un enfant biologique. Cependant, si l'objectif principal est de concevoir et d'accueillir un enfant, qu'il existe ou non un lien génétique avec la mère d'intention, d'autres options, comme un cycle de FIV en tandem ou le recours direct au don d'ovules, peuvent offrir des taux de réussite nettement supérieurs, en particulier pour les femmes de plus de 40 ans.
Cycle de FIV en tandem
Un cycle de FIV en tandem Il s'agit d'une approche thérapeutique dans laquelle une patiente subit une stimulation ovarienne pour produire ses propres ovules tout en utilisant simultanément des ovules de donneuse au cours du même cycle de traitement. Les deux groupes d'ovules sont fécondés séparément et des embryons sont créés à partir de chaque source. Cela permet aux futurs parents de tenter une conception avec le matériel génétique de la patiente tout en disposant d'embryons de donneuse de haute qualité au cours du même cycle. Les embryons des deux sources peuvent être cultivés jusqu'au stade blastocyste, soumis à des tests génétiques si nécessaire, et conservés pour une utilisation ultérieure. Cette approche offre l'avantage unique de maximiser les chances de succès au cours d'un seul cycle de traitement tout en préservant la possibilité d'un lien biologique avec la mère d'intention.
Oeuf de donneur FIV
Oeuf de donneur FIV La FIV avec don d'ovocytes implique l'utilisation d'ovocytes provenant d'une donneuse saine et sélectionnée, fécondés avec le sperme du père d'intention ou celui d'un donneur. La qualité des ovules dépendant largement de l'âge et de la santé reproductive de la donneuse plutôt que de la mère d'intention, cette approche augmente significativement les chances de produire des embryons de qualité et de mener à bien une grossesse. La FIV avec don d'ovocytes est particulièrement intéressante pour les femmes en âge de procréer avancé, celles dont la réserve ovarienne est fortement diminuée ou celles dont les cycles précédents de FIV avec leurs propres ovules ont échoué. L'enfant ainsi obtenu partagera un lien génétique avec le sperme source, mais pas avec la receveuse d'ovocytes, bien que l'expérience de la grossesse et le lien materno-fœtal restent pleinement intacts.
Parcours pratiques pour les femmes de plus de 40 ans
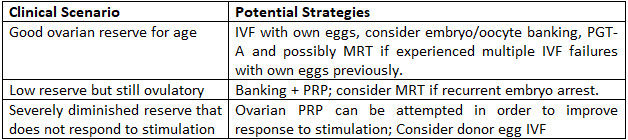
Points clés à retenir
- – Réussir avec ses propres ovules de plus de 40 ans est possible mais difficile ; des attentes réalistes sont importantes.
- – La conservation des ovocytes/embryons peut améliorer les chances cumulatives et permettre un dépistage génétique.
- – L’IRM et le PRP sont des compléments prometteurs pour certains cas.
- – Les ovules de donneuse offrent les taux de réussite les plus élevés et doivent être discutés tôt si le pronostic est mauvais.
- S'il te plaît Contactez-nous pour plus d'informations et des recommandations personnalisées.
Les références
- Broer, SL, Broekmans, FJ, Laven, JS et Fauser, BC, 2014. Hormone antimüllérienne : test de réserve ovarienne et implications cliniques potentielles. Human Reproduction Update, 20(5), pp.688–701.
- Cobo, A., García-Velasco, J., Coello, A., Domingo, J., Pellicer, A. et Remohí, J., 2016. La vitrification des ovocytes comme option efficace pour la préservation élective de la fertilité. Fertilité et stérilité, 105(3), pp.755–764.
- Devroey, P., Fauser, BC et Diedrich, K., 2011. Approches pour améliorer le diagnostic et la prise en charge de l'infertilité. Human Reproduction Update, 17(5), pp. 455–467.
- Doyle, JO, Richter, KS, Lim, J., Stillman, RJ, Graham, JR et Tucker, MJ, 2016. Réussite de la vitrification et du réchauffement des ovocytes, électifs et médicalement indiqués, pour la fécondation in vitro autologue, avec probabilités de naissance prédites pour la préservation de la fertilité en fonction du nombre d'ovocytes cryoconservés et de l'âge au moment du prélèvement. Fertility and Sterility, 105(2), pp.459–466.
- Labarta, E., de los Santos, MJ, Escribá, MJ, Pellicer, A. et Herraiz, S., 2019. Les mitochondries comme outil de rajeunissement des ovules. Fertilité et stérilité, 111(2), pp.219-226.
- Noyes, N., Porcu, E. et Borini, A., 2009. Plus de 900 bébés nés par cryoconservation d'ovocytes sans augmentation apparente des anomalies congénitales. Reproductive BioMedicine Online, 18(6), pp. 769–776.
- Paulson, RJ, Hatch, IE, Lobo, RA et Sauer, MV, 2002. Taux cumulés de grossesses réussies après don d'ovocytes : implications pour la réceptivité endométriale. Human Reproduction, 17(5), pp.1411–1416.
- Sauer, MV, 1990. Un rapport préliminaire sur le don d'ovocytes étendant le potentiel reproductif aux femmes de plus de 40 ans. New England Journal of Medicine, 323(17), pp.1157–1160.
- Sfakianoudis, K., Simopoulou, M., Nitsos, N., et al., 2019. Le traitement par plasma riche en plaquettes autologue permet une grossesse chez une femme en ménopause prématurée. Case Reports in Women's Health, 23, e00129.
- Sills, ES, Rickers, NS, Li, X. et Palermo, GD, 2020. Premières données sur la fécondation in vitro après injection intraovarienne de plasma riche en plaquettes autologue activé par le gluconate de calcium. Endocrinologie gynécologique, 36(6), pp.479–482.
- St. John, JC, Facucho-Oliveira, J., Jiang, Y., Kelly, R. et Salah, R., 2019. Transmission, réplication et hérédité de l'ADN mitochondrial : un parcours du gamète à l'embryon, jusqu'à la progéniture et aux cellules souches embryonnaires. Human Reproduction Update, 26(1), pp.1–35.
- Yu, TN, Wang, HY, Lee, TH, et al., 2025. L'injection intraovarienne de plasma riche en plaquettes améliore significativement le rendement en blastocystes chez les patientes ayant bénéficié d'une FIV et présentant des antécédents embryonnaires de mauvaise qualité. Scientific Reports, 15, 81234.
- Zhang, J., Liu, H., Luo, S., et al., 2017. Naissance vivante issue du transfert de fuseau ovocytaire pour prévenir les maladies mitochondriales. Reproductive BioMedicine Online, 34(4), pp.361–368.
Centre de FIV de Chypre du Nord
Le centre de FIV de Chypre du Nord est une clinique de fertilité axée sur le patient, située dans "Hôpital de recherche et de chirurgie d'élite» à Nicosie, Chypre. Notre clinique est l’une des cliniques de fertilité les plus avancées au monde, offrant une plus large sélection d’options de traitement à des prix abordables.
Nous Contacter
Téléphone
Anglais: +90 548 875 8000
Français: +90 548 876 8000
Turc: +90 542 869 8000
Arabe: +90 548 875 8000
Allemand: +90 548 830 1987
Russe: +90 548 828 9955
info@northcyprusivf.net
© 2020 LowCostIVF - Tous droits réservés. politique de confidentialité


