- Nosotros
- Blog
- Esterilidad
- Tratamientos de FIV
- Nuevos avances en FIV
- Tratamiento de FIV en Chipre
- FIV para mujeres mayores de 40
- FIV para mujeres mayores de 50 años
- IUI
- Mini FIV
- FIV + IICE
- FIV citoplasmática
- Ciclo de FIV en tándem
- donación de óvulos
- Donación de embriones
- Donación de esperma
- Género - Selección de sexo
- Subrogación gestacional
- Subrogación gay del mismo sexo
- Recuperación quirúrgica de espermatozoides
- Diagnóstico Genético Pre Implantación DGP
- Congelación de óvulos
- Selección de género utilizando óvulos de donantes
- Prevención de la enfermedad de células falciformes
- Preguntas Frecuentes
- Viajar
- Nosotros
- Blog
- Esterilidad
- Tratamientos de FIV
- Nuevos avances en FIV
- Tratamiento de FIV en Chipre
- FIV para mujeres mayores de 40
- FIV para mujeres mayores de 50 años
- IUI
- Mini FIV
- FIV + IICE
- FIV citoplasmática
- Ciclo de FIV en tándem
- donación de óvulos
- Donación de embriones
- Donación de esperma
- Género - Selección de sexo
- Subrogación gestacional
- Subrogación gay del mismo sexo
- Recuperación quirúrgica de espermatozoides
- Diagnóstico Genético Pre Implantación DGP
- Congelación de óvulos
- Selección de género utilizando óvulos de donantes
- Prevención de la enfermedad de células falciformes
- Preguntas Frecuentes
- Viajar
FIV para mujeres mayores de 40
FIV para mujeres mayores de 40 años: caminos realistas y esperanzadores para el futuro
Entendiendo el paisaje:
A medida que las mujeres envejecen, especialmente después de los 40 años, se observa una marcada disminución de la fertilidad. Esto se debe principalmente a que nacen con un número finito de folículos, y tanto la cantidad como la calidad disminuyen con el tiempo debido al estrés oxidativo acumulativo, la disfunción mitocondrial y los errores meióticos (te Velde y Pearson, 2002).
Según amplios datos de registros, las tasas de nacidos vivos con óvulos no donados disminuyen de aproximadamente 261 TP3T entre los 38 y los 40 años a aproximadamente 131 TP3T entre los 41 y los 42 años, y a menos de 51 TP3T después de los 42 años (SART, 2023). El siguiente diagrama muestra una estimación aproximada de la reserva ovárica de una mujer promedio a lo largo de su edad reproductiva:
Figura 1: Edad y reserva ovárica femenina
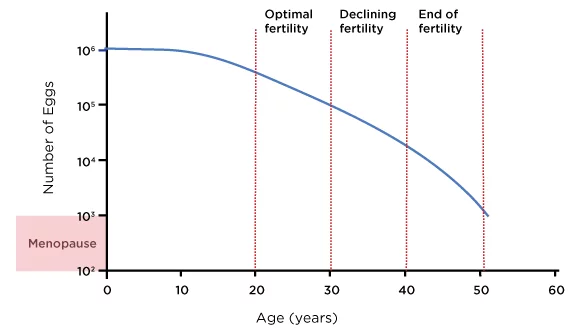
Fuente: Ozyigit, A. y Ozyigit, S., 2018. Guía de FIV: Lo que necesita saber sobre fertilidad, infertilidad y opciones de tratamiento disponibles. 1.ª ed. Irvine, CA: Universal Publishers, figura 1.
Dicho esto, la reserva y la respuesta ováricas varían entre personas, y algunas mujeres mantienen un mayor potencial reproductivo hasta principios de los cuarenta o mediados de los cuarenta. Por ello, la evaluación personalizada mediante el recuento de folículos antrales (RFA), la prueba de la hormona antimülleriana (AMH) y los resultados de ciclos previos de FIV es esencial para seleccionar la estrategia más adecuada (Broer et al., 2014).
Bancos de ovocitos o embriones: Construyendo su propia red de seguridad
Un enfoque práctico para mejorar las tasas de éxito acumulativo es el almacenamiento de ovocitos o embriones. Mediante múltiples ciclos de estimulación y recuperación, es posible acumular un mayor número de ovocitos (o embriones), aumentando así la probabilidad de un embarazo exitoso. Se ha demostrado que la vitrificación de ovocitos produce tasas de supervivencia y fecundación comparables a las de los ovocitos en fresco (Cobo et al., 2016), sin un mayor riesgo de anomalías congénitas (Noyes et al., 2009). Por lo tanto, la recuperación múltiple de ovocitos puede ofrecer cifras que no son posibles con un único procedimiento de recuperación de óvulos.
Si bien las tasas de embarazo y de nacimientos vivos en mujeres mayores de 40 años en un solo ciclo de tratamiento son relativamente bajas, es importante recordar que estas cifras se calculan por ciclo. Cuando se realizan varios ciclos y se combinan los resultados, la probabilidad general de lograr un embarazo y un nacimiento vivo puede aumentar considerablemente. Este enfoque también brinda la oportunidad de realizar pruebas genéticas preimplantacionales para aneuploidías (PGT-A), que pueden ayudar a identificar embriones con un complemento cromosómico normal y aumentar aún más las probabilidades de éxito (Doyle et al., 2016).
El almacenamiento de ovocitos puede ser aún más eficaz cuando se combina con otros avances modernos en medicina reproductiva que tienen el potencial de mejorar los resultados del ciclo. Entre ellos se encuentran tratamiento con PRP ovárico y una innovación tecnológica moderna conocida como Terapia de reemplazo mitocondrial (MRT). La incorporación de estos enfoques junto con el almacenamiento de ovocitos puede mejorar la calidad y el potencial de desarrollo de los óvulos recolectados, aumentando así el número de embriones viables disponibles para la transferencia. Utilizados estratégicamente, estos métodos pueden complementar los beneficios del almacenamiento, no solo ampliando el conjunto de ovocitos almacenados, sino también optimizando su potencial reproductivo, lo que, en última instancia, ofrece una mayor probabilidad de lograr un embarazo exitoso.
Plasma rico en plaquetas ováricas (PRP)
El PRP ovárico consiste en inyectar concentrado de plaquetas autólogas en los ovarios para estimular los factores de crecimiento locales que pueden mejorar el reclutamiento folicular. Estudios en pacientes con baja respuesta, incluyendo mujeres en edad reproductiva avanzada, han reportado mejoras en la AMH, el AFC y la calidad del blastocisto, con algunos nacimientos vivos (Sfakianoudis et al., 2019). Un estudio reciente demostró aumentos significativos en la producción de blastocistos utilizables tras el PRP en mujeres con embriones de baja calidad (Yu et al., 2025). Si bien aún no es el tratamiento estándar, el PRP es un complemento adecuado para pacientes seleccionadas que desean optimizar su potencial de ovulación.
La terapia con PRP ovárico es un procedimiento mucho más sofisticado que la simple inyección de plasma rico en plaquetas en los ovarios y esperar una mejoría. Su éxito depende de protocolos cuidadosamente diseñados que comienzan con una preparación plaquetaria adecuada, incluyendo la inactivación controlada para prevenir la activación prematura y el agotamiento de los factores de crecimiento antes de llegar al tejido diana. La concentración y la densidad de plaquetas deben optimizarse para garantizar una dosis terapéuticamente significativa, ya que las preparaciones subóptimas o excesivamente diluidas pueden no proporcionar el estímulo regenerativo deseado. Igualmente crucial es la precisión de la inyección, dirigida a regiones anatómicas específicas dentro del ovario donde el desarrollo folicular tiene más probabilidades de beneficiarse de una mayor vascularización, señalización celular y apoyo microambiental. Tras el procedimiento, un régimen de suplementación personalizado es esencial para sostener y apoyar el proceso de ovogénesis, asegurando que el entorno bioquímico y hormonal sea propicio para el reclutamiento, crecimiento y maduración folicular. En conjunto, estos factores transforman la terapia con PRP de una simple inyección en una intervención con base científica y potencialmente transformadora para la función ovárica.
Terapia de reemplazo mitocondrial (TRM)
La Terapia de Reemplazo Mitocondrial (TRM) es una técnica reproductiva emergente que busca restaurar la capacidad bioenergética de los ovocitos mediante la suplementación con mitocondrias sanas de donantes. Este enfoque aborda directamente uno de los cambios más significativos relacionados con la edad en la reproducción femenina: el deterioro progresivo de la función mitocondrial, que se ha asociado estrechamente con una menor competencia ovocitaria y un desarrollo embrionario deficiente (St. John et al., 2019).
Al introducir mitocondrias funcionales en el ovocito, la TRM busca mejorar la producción de ATP, optimizar el entorno celular para la división meiótica y aumentar el potencial de desarrollo de los embriones resultantes. Si bien su aplicación clínica es relativamente reciente, y el Centro de FIV North Cyprus es uno de los pocos centros clínicos que ofrece este servicio, los primeros estudios preclínicos y en humanos han mostrado resultados alentadores, especialmente en pacientes con antecedentes de detención recurrente del desarrollo embrionario o mala calidad embrionaria (Zhang et al., 2017).
El Dr. Shoukhrat Mitalipov y sus colegas han estado a la vanguardia de la investigación de MRT, demostrando tanto en modelos animales como en ovocitos humanos que la transferencia de mitocondrias sanas puede corregir deficiencias bioenergéticas y conducir a mejores resultados de fertilización y desarrollo embrionario, lo que respalda la justificación de su uso específico en casos de insuficiencia mitocondrial relacionada con la edad o la enfermedad (Kang et al., 2016).
Combinación de estrategias: Banco de ovocitos, tratamiento con PRP ovárico y TRM
Para ciertas pacientes, en particular aquellas con antecedentes de ciclos fallidos debido a un desarrollo embrionario deficiente, una estrategia integral que combine el almacenamiento de ovocitos, el PRP ovárico y la terapia de reemplazo mitocondrial puede ofrecer el mayor potencial para mejorar los resultados. Este enfoque multifacético aborda el envejecimiento ovocitario desde varias direcciones. El almacenamiento de ovocitos permite obtener ovocitos supernumerarios que no serían posibles con una sola recuperación de óvulos en un ciclo de FIV. El PRP ovárico tiene como objetivo mejorar el entorno folicular y promover un reclutamiento folicular más saludable con un ciclo de recuperación de óvulos, mientras que la terapia de reemplazo mitocondrial trabaja para restaurar la bioenergética óptima de los ovocitos y mejorar el potencial de desarrollo embrionario. En conjunto, estas intervenciones abordan tanto la producción de energía celular como el microambiente ovárico, dos determinantes críticos del éxito reproductivo en la infertilidad relacionada con la edad (Labarta et al., 2019).
****
Estas estrategias están diseñadas para mejorar la probabilidad de lograr un embarazo utilizando el material genético de la propia mujer, permitiendo así tener un hijo biológico. Si bien estas intervenciones pueden aumentar sustancialmente las probabilidades de éxito en comparación con un ciclo estándar de FIV, aún pueden conllevar un costo financiero significativo y no pueden garantizar una alta probabilidad de éxito, especialmente en casos de edad materna avanzada o reserva ovárica reducida. Para las parejas o personas que no desean considerar la donación de óvulos, estos enfoques aún pueden proporcionar una mejora significativa en las probabilidades de tener un hijo biológico. Sin embargo, si el objetivo principal es lograr un embarazo y dar la bienvenida a un hijo, independientemente de si existe un vínculo genético con la madre de intención, opciones alternativas como un ciclo de FIV en tándem o el uso directo de óvulos de donante pueden ofrecer tasas de éxito sustancialmente mayores, especialmente para mujeres mayores de 40 años.
Ciclo de FIV en tándem
Un ciclo de FIV en tándem Es un enfoque de tratamiento en el que la paciente se somete a estimulación ovárica para producir sus propios óvulos, utilizando simultáneamente óvulos de donante en el mismo ciclo de tratamiento. Ambos conjuntos de óvulos se fecundan por separado y se crean embriones de cada origen. Esto permite a los futuros padres intentar la concepción con el material genético de la paciente, a la vez que disponen de embriones de donante de alta calidad en el mismo ciclo. Los embriones de ambas fuentes pueden cultivarse hasta el estadio de blastocisto, someterse a pruebas genéticas si se desea y almacenarse para su uso futuro. Este enfoque ofrece la ventaja única de maximizar las probabilidades de éxito en un solo ciclo de tratamiento, preservando al mismo tiempo la posibilidad de una conexión biológica con la futura madre.
FIV de óvulos de donante
FIV de óvulos de donante Implica el uso de ovocitos de una donante sana y examinada, que se fecundan con el esperma del futuro padre o de un donante. Dado que la calidad de los óvulos depende en gran medida de la edad y la salud reproductiva de la donante, más que de la futura madre, este método aumenta significativamente la probabilidad de producir embriones de alta calidad y lograr un embarazo exitoso. La FIV con óvulos de donante es especialmente valiosa para mujeres en edad reproductiva avanzada, aquellas con reserva ovárica gravemente reducida o aquellas cuyos ciclos previos de FIV con sus propios óvulos han fracasado. El niño resultante compartirá una conexión genética con la fuente de esperma, pero no con la receptora de óvulos, aunque la experiencia del embarazo y el vínculo materno-fetal se mantienen intactos.
Caminos prácticos para mujeres mayores de 40 años
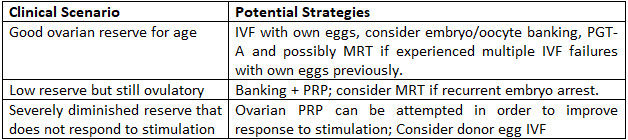
Conclusiones clave
- – El éxito con óvulos propios mayores de 40 años es posible, pero desafiante; es importante tener expectativas realistas.
- – Los bancos de ovocitos y embriones pueden mejorar las posibilidades acumuladas y permitir la detección genética.
- – La MRT y el PRP son complementos prometedores para casos selectos.
- – Los óvulos de donante ofrecen las mayores tasas de éxito y se debe hablar de ellos de forma temprana si el pronóstico es malo.
- Por favor Contáctenos Para más información y recomendaciones personalizadas.
Referencias
- Broer, SL, Broekmans, FJ, Laven, JS y Fauser, BC, 2014. Hormona antimülleriana: evaluación de la reserva ovárica y sus posibles implicaciones clínicas. Human Reproduction Update, 20(5), pp. 688–701.
- Cobo, A., García-Velasco, J., Coello, A., Domingo, J., Pellicer, A. y Remohí, J., 2016. La vitrificación de ovocitos como una opción eficaz para la preservación electiva de la fertilidad. Fertilidad y Esterilidad, 105(3), pp.755–764.
- Devroey, P., Fauser, BC y Diedrich, K., 2011. Enfoques para mejorar el diagnóstico y el tratamiento de la infertilidad. Human Reproduction Update, 17(5), pp. 455–467.
- Doyle, JO, Richter, KS, Lim, J., Stillman, RJ, Graham, JR y Tucker, MJ, 2016. Vitrificación y calentamiento de ovocitos, electiva y médicamente indicada, para fertilización in vitro autóloga, con predicción de probabilidades de nacimiento para la preservación de la fertilidad según el número de ovocitos criopreservados y la edad en el momento de la extracción. Fertilidad y Esterilidad, 105(2), págs. 459-466.
- Labarta, E., de los Santos, MJ, Escribá, MJ, Pellicer, A. y Herraiz, S., 2019. Las mitocondrias como herramienta para el rejuvenecimiento de los ovocitos. Fertilidad y esterilidad, 111 (2), págs.219–226.
- Noyes, N., Porcu, E. y Borini, A., 2009. Más de 900 bebés criopreservados de ovocitos nacieron sin un aumento aparente de anomalías congénitas. Reproductive BioMedicine Online, 18(6), pp. 769–776.
- Paulson, RJ, Hatch, IE, Lobo, RA y Sauer, MV, 2002. Tasas acumuladas de éxito de embarazo tras la donación de ovocitos: implicaciones para la receptividad endometrial. Reproducción Humana, 17(5), págs. 1411-1416.
- Sauer, MV, 1990. Un informe preliminar sobre la donación de ovocitos que amplía el potencial reproductivo de las mujeres mayores de 40 años. New England Journal of Medicine, 323(17), págs. 1157-1160.
- Sfakianoudis, K., Simopoulou, M., Nitsos, N., et al., 2019. El tratamiento con plasma rico en plaquetas autólogo permite el embarazo en una mujer con menopausia prematura. Informes de casos en salud femenina, 23, e00129.
- Sills, ES, Rickers, NS, Li, X. y Palermo, GD, 2020. Primeros datos sobre fertilización in vitro tras la inyección intraovárica de plasma rico en plaquetas autólogo activado con gluconato de calcio. Endocrinología Ginecológica, 36(6), pp. 479-482.
- St. John, JC, Facucho-Oliveira, J., Jiang, Y., Kelly, R. y Salah, R., 2019. Transmisión, replicación y herencia del ADN mitocondrial: un recorrido desde el gameto, a través del embrión, hasta la descendencia y las células madre embrionarias. Human Reproduction Update, 26(1), pp. 1–35.
- Yu, TN, Wang, HY, Lee, TH, et al., 2025. La inyección intraovárica de plasma rico en plaquetas mejora significativamente la producción de blastocistos en pacientes de FIV con baja calidad embrionaria previa. Scientific Reports, 15, 81234.
- Zhang, J., Liu, H., Luo, S., et al., 2017. Nacido vivo derivado de la transferencia del huso ovocitario para la prevención de enfermedades mitocondriales. Reproductive BioMedicine Online, 34(4), pp. 361–368.
Centro de FIV del norte de Chipre
North Cyprus IVF Center es una clínica de fertilidad centrada en el paciente, ubicada dentro de "Hospital Quirúrgico y de Investigación Elite”En Nicosia, Chipre. Nuestra clínica es una de las clínicas de fertilidad más avanzadas del mundo y ofrece una selección más amplia de opciones de tratamiento a precios asequibles.
Contáctanos
Teléfono
Inglés: +90 548 875 8000
Francés: +90 548 876 8000
Turco: +90 542 869 8000
Arábica: +90 548 875 8000
Alemán: +90 548 830 1987
Ruso: +90 548 828 9955
Correo electrónico
info@northcyprusivf.net
© 2020 LowCostIVF - Todos los derechos reservados. política de privacidad


