- À propos
- Blog
- Infertilité
- Traitements de FIV
- Nouvelles avancées FIV
- Thérapie de remplacement mitochondrial!
- Traitement de FIV à Chypre
- FIV pour les femmes de plus de 40 ans
- FIV pour les femmes de plus de 50 ans
- IUI
- Mini FIV
- FIV + ICSI
- FIV cytoplasmique
- Cycle de FIV en tandem
- Don d'ovules
- Don d'embryons
- Don de sperme
- Genre – Sélection du sexe
- GPA gestationnelle
- Gestation pour autrui gay de même sexe
- Récupération chirurgicale de sperme
- Diagnostic Génétique Pré Implantation PGD
- Congélation d'oeufs
- Sélection du sexe à l'aide d'ovules de donneur
- Prévention de la drépanocytose
- FAQ
- Voyage
- À propos
- Blog
- Infertilité
- Traitements de FIV
- Nouvelles avancées FIV
- Thérapie de remplacement mitochondrial!
- Traitement de FIV à Chypre
- FIV pour les femmes de plus de 40 ans
- FIV pour les femmes de plus de 50 ans
- IUI
- Mini FIV
- FIV + ICSI
- FIV cytoplasmique
- Cycle de FIV en tandem
- Don d'ovules
- Don d'embryons
- Don de sperme
- Genre – Sélection du sexe
- GPA gestationnelle
- Gestation pour autrui gay de même sexe
- Récupération chirurgicale de sperme
- Diagnostic Génétique Pré Implantation PGD
- Congélation d'oeufs
- Sélection du sexe à l'aide d'ovules de donneur
- Prévention de la drépanocytose
- FAQ
- Voyage
Thérapie de remplacement mitochondrial
Une nouvelle technique médicale révolutionnaire
Thérapie de remplacement mitochondrial (TRM) au centre de FIV de Chypre du Nord
En collaboration avec le Dr Shoukhrat Mitalipov – Pionnier de l'avenir de la fertilité
Au Centre de FIV de Chypre du Nord, nous sommes fiers de collaborer avec le Dr Shoukhrat Mitalipov, l'un des plus grands experts mondiaux en génétique de la reproduction et en biologie mitochondriale. Le Dr Mitalipov est reconnu internationalement pour avoir développé la thérapie de remplacement mitochondrial (TRM), une technique de pointe initialement conçue pour prévenir la transmission des maladies mitochondriales, qui offre aujourd'hui un nouvel espoir aux femmes souffrant d'infertilité liée à l'âge et d'échecs récurrents de FIV.
Ce partenariat nous permet d'offrir la MRT comme traitement de fertilité spécialisé en dehors d'un cadre d'essai clinique, combinant l'expertise de l'équipe du Dr Mitalipov avec l'expérience clinique du Dr Savas Ozyigit, du Dr Ahmet Ozyigit et de l'équipe d'embryologie du North Cyprus IVF Center, situé à l'hôpital Elite.
Que sont les mitochondries ?
Les mitochondries sont les organites producteurs d'énergie présents dans presque toutes les cellules du corps, y compris les ovocytes (ovules). Avec l'âge, le nombre et la fonction des mitochondries diminuent, ce qui altère la capacité de l'ovocyte à assurer une fécondation, un développement embryonnaire et une implantation normaux. Ce déclin est l'un des principaux facteurs d'infertilité liée à l'âge.
TLe rôle des mitochondries dans la santé cellulaire et reproductive
Les mitochondries sont des organites à double membrane, mieux connus comme les « centrales énergétiques » de la cellule, car elles produisent de l'adénosine triphosphate (ATP), la principale source d'énergie utilisée pour alimenter la quasi-totalité des processus cellulaires. Cependant, les mitochondries jouent également des rôles cruciaux dans :
• Régulation de l'apoptose (mort cellulaire programmée)
• Homéostasie du calcium
• Gestion des espèces réactives de l'oxygène (ROS)
• Stéroïdogenèse et signalisation cellulaire
• Maturation des ovocytes, formation du fuseau et développement embryonnaire précoce
Dans les ovocytes humains, chaque cellule contient entre 100 000 et 600 000 mitochondries, soit bien plus que les cellules somatiques typiques, soulignant leur rôle central dans la compétence reproductive (May-Panloup et al., 2005).
À mesure que les femmes vieillissent, en particulier après 35 ans, la fonction mitochondriale des ovocytes subit une détérioration progressive :
1. Nombre réduit de copies d'ADNmt
Les mitochondries des ovocytes dépendent d'un nombre suffisant de copies d'ADN mitochondrial (ADNmt) pour maintenir la production d'ATP pendant la maturation et la fécondation. Des études montrent une diminution significative du nombre de copies d'ADNmt avec l'âge, compromettant la disponibilité énergétique nécessaire à la formation normale du fuseau et à la ségrégation chromosomique (Fragouli et al., 2015).
2. Augmentation des mutations de l'ADN mitochondrial
L'ADNmt est dépourvu d'histones protectrices et possède des mécanismes de réparation limités, ce qui le rend très vulnérable aux dommages oxydatifs. Avec l'âge, l'exposition cumulative aux ROS entraîne une augmentation des mutations de l'ADNmt, qui altèrent la respiration mitochondriale et aggravent encore le stress oxydatif (Barritt et al., 2002 ; Wallace, 2013).
3. Production d'ATP altérée
Les mitochondries vieillissantes génèrent moins d'ATP par phosphorylation oxydative, ce qui entraîne des ovocytes déficients en énergie qui ont du mal à terminer la division méiotique ou à soutenir l'embryogenèse précoce (Bentov & Casper, 2013).
4. Potentiel membranaire altéré et fragmentation
Les mitochondries vieillissantes présentent une perte de potentiel membranaire, une fragmentation accrue et une morphologie altérée, entraînant une altération du métabolisme cellulaire et une susceptibilité à l'apoptose (Wilding et al., 2001).
5. Association avec l'aneuploïdie et la mauvaise qualité des embryons
Le dysfonctionnement mitochondrial des ovocytes a été corrélé à des anomalies du fuseau, à une mauvaise ségrégation chromosomique et à des taux de formation de blastocystes plus faibles (Santos et al., 2006). Il a été démontré que le dysfonctionnement mitochondrial des ovocytes altère l'assemblage du fuseau et la ségrégation chromosomique, conduisant à des erreurs méiotiques et à un développement embryonnaire compromis, un phénomène démontré dans des modèles de primates humains et non humains par le Dr Shoukhrat Mitalipov et ses collègues (Tachibana et al., 2009, Nature).
Comment s’intègre la thérapie de remplacement mitochondrial ?
La santé mitochondriale n'est pas seulement un indicateur de la vitalité des ovocytes, c'est aussi un facteur limitant du succès reproductif. Le traitement de remplacement mitochondrial vise à restaurer un cytoplasme bioénergétiquement compétent, permettant ainsi à l'ADN nucléaire de la patiente de fonctionner dans un environnement cellulaire rajeuni.
En remplaçant les mitochondries âgées et dysfonctionnelles par des mitochondries de donneurs sains, la MRT s'attaque à une cause fondamentale de l'infertilité liée à l'âge au niveau cellulaire, quelque chose que la FIV traditionnelle ne peut pas surmonter lorsque l'environnement cytoplasmique de l'ovule est compromis.
La MRT est une technique révolutionnaire qui remplace les mitochondries dysfonctionnelles de l'ovule d'une femme par des mitochondries saines provenant d'un ovule de donneuse, créant ainsi un environnement plus viable pour le développement de l'embryon, tout en préservant le matériel génétique nucléaire de la femme.
Comment fonctionne le MRT ?
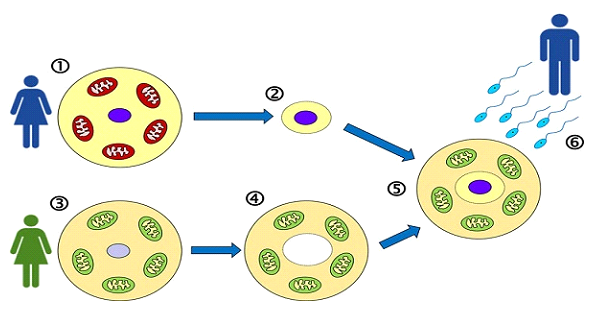
Contrairement au transfert cytoplasmique, où une petite quantité de cytoplasme d'ovule de donneuse est injectée dans l'ovule de la patiente, la TRM implique le transfert complet de l'ADN nucléaire de la mère dans un ovule de donneuse énucléé qui conserve ses propres mitochondries saines. Cette technique, appelée transfert de fuseau maternel (TMM), permet une visualisation et une manipulation précises du matériel génétique.
Étapes du processus MRT :
• Ponction d'ovules : La patiente subit une stimulation ovarienne et un prélèvement d'ovules. En raison d'une production d'ovules plus faible chez les femmes de plus de 40 ans, plusieurs cycles de prélèvement peuvent être nécessaires. Un minimum de trois ovocytes de grade M2 est requis pour une TRM. Plus le nombre d'ovocytes est élevé, plus les chances de succès sont élevées. Les ovocytes de la patiente sont congelés jusqu'à ce qu'une donneuse compatible soit trouvée et que ses ovocytes soient prêts à être prélevés.
Préparation de l'ovule de la donneuse : L'ovule de la donneuse est prélevé et son noyau est soigneusement retiré, laissant derrière lui un cytoplasme contenant des mitochondries intactes et saines. Cette procédure est réalisée sur des ovocytes frais. Par conséquent, le protocole de TRM est réalisé uniquement avec des ovocytes frais de la donneuse.
• Transfert de fuseau : l’ADN nucléaire du patient (matériel génétique) est extrait et transféré dans l’ovule énucléé du donneur.
• Fécondation : L’ovule reconstitué, contenant désormais le matériel génétique de la patiente et les mitochondries saines du donneur, est fécondé par ICSI (injection intracytoplasmique de spermatozoïdes). Dans la plupart des cas, il n’est pas possible de fournir un échantillon de sperme frais si les patients viennent de l’étranger. Par conséquent, nous demandons qu’un échantillon de sperme soit fourni au préalable et conservé congelé en prévision d’un cycle de TRM.
• Développement embryonnaire : Les embryons obtenus sont cultivés jusqu'au stade blastocyste, puis vitrifiés (congelés) en vue d'un transfert ultérieur. Les ovocytes de la donneuse étant utilisés frais, il s'agirait techniquement de la première tentative de congélation (même si les ovocytes de la patiente avaient été préalablement congelés).
• Transfert d’embryons : Lors d’un cycle ultérieur, la patiente subit une préparation endométriale pour le transfert d’embryons.
La thérapie de remplacement mitochondrial (TRM) consiste à transférer le matériel génétique nucléaire d'un ovule d'une femme vers un ovule de donneuse contenant des mitochondries saines. L'objectif est de préserver l'ADN nucléaire de la patiente tout en lui fournissant un cytoplasme bioénergétiquement compétent. Deux techniques principales sont utilisées pour y parvenir :
1. Transfert de fuseau maternel (MST) - La méthode utilisée dans notre unité de FIV.
La MST est réalisée au stade ovocytaire métaphase II (MII), avant la fécondation. Le complexe méiotique maternel (contenant les chromosomes) est soigneusement prélevé de l'ovule non fécondé de la patiente et transféré dans un ovule de donneuse dont le fuseau méiotique a été retiré. L'ovule reconstitué est ensuite fécondé par un spermatozoïde.
Cette méthode est idéale pour le traitement de l'infertilité et des dysfonctionnements ovocytaires liés à l'âge, car elle évite les manipulations post-fécondation. Le risque de transmission mitochondriale est généralement inférieur à 1%, ce qui minimise le risque de récidive de la maladie mitochondriale si l'indication de la TRM est une maladie mitochondriale. Dans le cas contraire, cela n'a aucune importance.
2. Transfert pronucléaire (PNT)
Le PNT est réalisé au stade zygote, après fécondation. Les pronuclei (mâles et femelles) sont prélevés sur un ovule fécondé et transférés dans un zygote donneur énucléé. Cette méthode est principalement étudiée pour la prévention des maladies mitochondriales héréditaires. Cependant, le risque de contamination mitochondriale est plus élevé que celui du MST (~2–5%), selon la technique.
Pourquoi le transfert de broche est-il supérieur dans les applications de fertilité ?
Considérations éthiques et juridiques
La MST évite la création et la destruction d'embryons, puisqu'elle intervient avant la fécondation. Cela la rend plus acceptable sur le plan éthique et juridique dans de nombreuses juridictions que la PNT. Cette dernière implique la manipulation d'un zygote fécondé, ce qui soulève des préoccupations bioéthiques plus importantes.
Transfert mitochondrial inférieur
Le MST présente systématiquement un faible taux de transfert d'ADNmt, réduisant ainsi le risque de transmission de mutations mitochondriales à la descendance. Mitalipov et al. (2009, 2016) ont montré que le MST produisait une quantité indétectable ou négligeable d'ADNmt provenant de l'ovocyte d'origine, tandis que le PNT pouvait contenir des quantités plus importantes d'ADNmt défectueux en raison du mélange cytoplasmique.
Risque réduit de problèmes de reprogrammation épigénétique
Comme la MST survient avant la fécondation, le remodelage épigénétique s'effectue dans un environnement cytoplasmique unique, ce qui pourrait entraîner une expression génique plus stable pendant l'embryogenèse. En revanche, la PNT combine des noyaux déjà fécondés avec un cytoplasme étranger, ce qui peut entraîner une discordance épigénétique ou un retard de reprogrammation.
Meilleurs résultats de développement des embryons
Dans les études sur les ovocytes et les embryons humains, notamment celles de Tachibana et al. (2013) et Zhang et al. (2017), les embryons MST ont montré une compétence développementale supérieure et des taux de fragmentation inférieurs à ceux des embryons dérivés du PNT. Le MST a également été plus facilement transposé dans les applications de fertilité, comme l'a montré la première naissance vivante par MST en Grèce (2019), impliquant une patiente ayant subi des échecs répétés de FIV.
Qui est candidat au MRT ?
L'IRM est envisagée dans les scénarios cliniques suivants :
• Femmes présentant un dysfonctionnement mitochondrial documenté ou des marqueurs suggérant une mauvaise qualité cytoplasmique des ovocytes
• Patientes d'âge maternel avancé (généralement > 40 ans) présentant des échecs répétés de FIV en raison de facteurs liés aux ovocytes
• Femmes avec une réserve ovarienne normale mais un faible développement embryonnaire ou des taux de fécondation suggérant une insuffisance cytoplasmique
• Les personnes souhaitant avoir un enfant biologiquement apparenté, mais à qui il a été précédemment conseillé d'envisager un don d'ovules en raison de la mauvaise qualité des ovocytes
Contexte scientifique et résultats cliniques :
En 2019, la TRM a permis la naissance d'un enfant en bonne santé en Grèce, grâce à une collaboration menée par le Dr Mitalipov. La mère avait subi plusieurs échecs de FIV en raison de la mauvaise qualité de ses ovules. Ce cas a marqué l'une des premières naissances vivantes utilisant le transfert de fuseau maternel pour traiter l'infertilité plutôt que pour prévenir les maladies génétiques.
Un taux de réussite de 25% a été observé dans cette cohorte, ce qui signifie qu'une femme sur quatre ayant précédemment échoué à une FIV a obtenu une grossesse grâce à la TRM. Bien que ce chiffre puisse paraître modeste, il est significatif pour les femmes auparavant considérées comme non-répondeuses aux protocoles de FIV standard.
Il convient de garder à l'esprit que, bien que les femmes ayant participé à cette étude aient connu plusieurs échecs de FIV, elles étaient âgées de 40 ans ou moins. Le taux 25% pourrait ne pas s'appliquer aux femmes des tranches d'âge plus avancées. Cependant, les femmes participant à l'essai grec ont bénéficié d'un seul prélèvement d'ovocytes et, dans la plupart des cas, leur nombre d'ovocytes était très limité. Au Centre de FIV de Chypre du Nord, nous cherchons généralement à obtenir le plus grand nombre d'ovocytes possible grâce à plusieurs prélèvements d'ovocytes, en particulier chez les patientes de plus de 43 ans, afin d'améliorer les chances de réussite.
Le processus de traitement au centre de FIV de Chypre du Nord
La quantité et la qualité des ovules ayant tendance à diminuer simultanément chez les femmes d'âge avancé, la plupart des candidates auront besoin de deux cycles de ponction ovarienne ou plus pour accumuler un nombre suffisant d'ovocytes matures pour la TRM. Voici le déroulement du processus :
1. Stimulation ovarienne et congélation d'ovules
EChaque cycle de ponction comprend une stimulation et un prélèvement d'ovules, suivis de leur vitrification. Cette opération peut être répétée au besoin (généralement 2 à 3 fois) en fonction de la réponse ovarienne. Certaines patientes obtiennent 9 à 10 ovocytes en un cycle, et d'autres nécessitent 4 à 5 ponctions d'ovocytes avant d'obtenir le nombre idéal d'ovocytes. Certaines patientes préfèrent avoir jusqu'à 15 à 16 ovocytes afin d'obtenir plusieurs embryons et ainsi potentiellement concevoir une fratrie.
2. Coordination des dons d'ovules frais
Une fois qu'un nombre suffisant d'ovules de la patiente a été congelé, des ovocytes frais de donneuse sont disposés pour coïncider avec la procédure d'IRM. Les ovules frais sont essentiels, car l'intégrité mitochondriale et l'activité cytoplasmique se dégradent avec la congélation.
3. MRT et création d'embryons
L'intervention d'IRM est réalisée par transfert de fuseau maternel, suivi d'une ICSI pour féconder les ovocytes reconstitués. Les embryons sont cultivés jusqu'au stade blastocyste et congelés en vue d'un transfert ultérieur. Le Dr Shoukhrat Mitalipov se rend généralement à Chypre deux fois par an (en juillet et en décembre), période à laquelle les interventions sont généralement réalisées. En fonction du nombre de patients, une troisième IRM peut être ajoutée au programme.
4. Préparation de l'endomètre et transfert d'embryons
Lors d'un cycle distinct, l'utérus de la patiente est préparé hormonalement pour recevoir l'embryon. Un transfert d'embryon congelé (TEC) est ensuite réalisé une fois l'épaisseur et la réceptivité de l'endomètre confirmées.
Calendrier et logistique pour les patients internationaux
La plupart de nos patients MRT viennent de l'étranger et nous nous adaptons à des horaires flexibles en coordonnant le bilan initial à distance :
• La stimulation ovarienne et le suivi préliminaire (hormones, scanners) peuvent être réalisés localement sous notre supervision.
• Vous n’aurez besoin de vous rendre à Chypre que pour chaque prélèvement d’ovules, ce qui nécessite généralement un séjour de 3 à 5 jours.
• Une fois la MRT terminée et les embryons congelés, un voyage séparé de 2 jours est nécessaire pour le transfert final de l’embryon.
Coût et planification
Le coût total d'un traitement par IRM dépend du nombre de cycles de prélèvement d'ovocytes nécessaires. En moyenne, les patientes subissent deux prélèvements d'ovocytes, ce qui porte le coût total à environ 14 000 €. Ce coût comprend :
• Deux prélèvements d'ovules et protocoles de médication
• Vitrification et stockage des ovocytes
• Prélèvement d'ovules frais de donneuses
• Procédure MRT (transfert de broche et création d'embryons)
• Culture et congélation de blastocystes
• Transfert final d'embryons congelés avec préparation de l'endomètre
Chaque prélèvement d'ovocytes supplémentaire coûte 2 500 €. Dans certains cas, les patientes choisissent de recourir à un traitement par PRP ovarien et exosomes entre les cycles afin d'améliorer le nombre et la qualité des ovocytes en vue d'un prélèvement ultérieur.
La correspondance des haplogroupes est-elle une préoccupation ?
Français À l'heure actuelle, nous ne procédons pas à la sélection des donneurs mitochondriaux en fonction de la compatibilité des haplogroupes maternels. Bien que le concept de compatibilité des haplogroupes ait été discuté dans la littérature scientifique, la pertinence clinique de l'incompatibilité mito-nucléaire reste théorique et n'a pas été démontrée comme ayant un impact sur le développement embryonnaire, l'implantation ou la santé postnatale précoce dans les cas de MRT humaine. Dans les modèles de primates humains et non humains, y compris ceux réalisés par l'équipe du Dr Mitalipov, l'incompatibilité des haplogroupes n'a pas entraîné de résultats développementaux défavorables (Tachibana et al., 2009, Nature ; Zhang et al., 2017). Bien que le suivi à long terme et multigénérationnel des interactions mito-nucléaires chez l'homme soit toujours en cours, les données actuelles suggèrent que les résultats développementaux à court et moyen terme ne sont pas compromis par les incompatibilités des haplogroupes (Mitalipov & Wolf, Nat Rev Mol Cell Biol, 2014).
De plus, le test d'haplogroupe n'est pas un test de dépistage standard et validé dans les programmes de don d'ovules et n'est pas disponible en routine pour une application clinique. Notre priorité est de sélectionner des donneuses présentant une excellente qualité ovocytaire, une fonction mitochondriale saine et un dépistage clinique des maladies génétiques et infectieuses, qui ont un impact plus important sur les résultats du traitement.
Des études, notamment celles menées par le Dr Mitalipov, ont montré que les embryons créés à partir d’haplogroupes mitochondriaux non appariés (par exemple, issus d’origines ethniques ou de lignées différentes) peuvent se développer normalement et donner lieu à des naissances saines.
Pourquoi choisir la TRM plutôt que le don d’ovules ?
La TRM offre aux femmes une opportunité unique de concevoir grâce à leur propre patrimoine génétique, même lorsque la qualité de leurs ovules a considérablement diminué avec l'âge. Contrairement au don d'ovules, qui donne naissance à un enfant sans lien génétique, la TRM conserve l'ADN nucléaire maternel, ce qui signifie que votre enfant porte votre patrimoine génétique.
Que faire si l'IRM ne fonctionne pas ? Puis-je suivre un cycle de FIV en tandem ?
Oui, absolument, vous pouvez suivre un cycle de FIV en tandem parallèlement à votre traitement MRT, et en fait, c'est quelque chose que nous recommandons activement dans certaines situations cliniques.
Lors d'une thérapie de remplacement mitochondrial (TRM), seul le composant cytoplasmique (mitochondries) de l'ovule de la donneuse est utilisé, tandis que votre propre matériel génétique nucléaire est conservé. L'enfant ainsi obtenu étant génétiquement le vôtre, la compatibilité phénotypique avec la donneuse n'est pas nécessaire lors des cycles de TRM. Les mitochondries de la donneuse sont purement fonctionnelles et ne contribuent pas aux traits physiques ni aux caractéristiques de la personnalité.
Cependant, si nous anticipons une probabilité de succès plus faible, par exemple en raison d'un très faible rendement en ovules ou d'une qualité ovocytaire très diminuée, un cycle de FIV en tandem peut être envisagé comme solution de secours. Cela signifie que nous réalisons un cycle de FIV simultané avec des ovocytes de donneuse, parallèlement à votre cycle de TRM. Cela offre l'avantage de créer deux groupes d'embryons distincts :
• Un groupe dérivé de votre propre matériel génétique via MRT
• Un autre groupe dérivé d’ovules de donneuses.
Comment fonctionne la FIV en tandem avec la TRM ?
• Une stimulation et une ponction ovarienne sont réalisées pour vous permettre d'obtenir des ovocytes destinés à l'IRM.
• En parallèle, nous nous coordonnons avec une donneuse appropriée pour un cycle de don d’ovules frais.
• Vos ovocytes subissent un transfert de fuseau maternel (MST) et sont fécondés par ICSI.
• Les ovocytes du donneur sont fécondés avec le sperme de votre partenaire (ou du donneur sélectionné) pour créer un deuxième ensemble d'embryons.
• Tous les embryons sont cultivés jusqu’au stade blastocyste, stade auquel :
• Un ou plusieurs embryons, issus d’une MRT ou d’une FIV avec donneur, peuvent être sélectionnés pour un transfert immédiat.
• Les embryons restants de l’un ou l’autre groupe peuvent être vitrifiés (congelés) et stockés pour une utilisation ultérieure.
L'un des principaux avantages de l'approche tandem est qu'elle vous permet de conserver une flexibilité totale. Selon la qualité des embryons et vos préférences thérapeutiques, vous pouvez :
• Choisissez de transférer uniquement votre propre embryon (dérivé de la MRT)
• Choisir de transférer un embryon d'ovule de donneuse
• Ou optez pour un transfert d’embryon double, un de chaque groupe, bien que cela comporte un risque plus élevé de jumeaux.
Tous les embryons restants peuvent être congelés en toute sécurité pour les cycles futurs, vous offrant ainsi des options ultérieures sans avoir besoin de répéter la stimulation ou la correspondance des donneurs.
La FIV en tandem offre :
• Rassurance et soutien au cas où les embryons MRT ne se développeraient pas de manière optimale
• Des taux de grossesse cumulés plus élevés en augmentant le nombre d’embryons viables ou simplement la tranquillité d’esprit d’avoir des embryons disponibles pour le transfert si ses propres ovules ne fonctionnent pas.
• Efficacité temporelle, puisque les deux stratégies sont exécutées dans une seule fenêtre de traitement
• Efficacité financière puisque vous n'auriez pas besoin de passer par un cycle de FIV séparé supplémentaire utilisant des ovocytes de donneuse, ce qui imposerait un coût plus élevé.
Prêt à en savoir plus ?
Si on vous a dit que vos chances de réussite avec vos propres ovules étaient trop faibles, ou si vous avez connu des échecs répétés de FIV, la TRM peut vous offrir une nouvelle voie vers la parentalité. Contactez-nous pour prendre rendez-vous pour une consultation ou pour commencer votre évaluation.
Centre de FIV de Chypre du Nord
Le centre de FIV de Chypre du Nord est une clinique de fertilité axée sur le patient, située dans "Hôpital de recherche et de chirurgie d'élite» à Nicosie, Chypre. Notre clinique est l’une des cliniques de fertilité les plus avancées au monde, offrant une plus large sélection d’options de traitement à des prix abordables.
Nous Contacter
Téléphone
Anglais: +90 548 875 8000
Français: +90 548 876 8000
Turc: +90 542 869 8000
Arabe: +90 548 875 8000
Allemand: +90 548 830 1987
Russe: +90 548 828 9955
info@northcyprusivf.net
© 2020 LowCostIVF - Tous droits réservés. politique de confidentialité